Хемофагоцитна лимфохистиоцитоза
Хемофагоцитниот лимфохистиоцитоза, познат и како хемофагоцитен лимфохистицитоза ( британски правопис- Hemophagocytic lymphohistiocytosis), и хемофагоцитен или хемофагоцитен синдром,[1] е невообичаено хематолошко нарушување кое се гледа почесто кај деца отколку кај возрасни. Оваа болест е предизвикана од неконтролирано размножување на активирани лимфоцити и макрофаги, кое се одликува со размножување на морфолошки доброќудни лимфоцити и макрофаги што лачат големи количини на воспалителни цитокини . Тој е класифициран како еден од синдромите на цитокин бура . Постојат наследни и ненаследни причини за хемофагоцитна лимфохистиоцитоза (ХЛХ). Таа претставува група на болести со потекло макрофагите кои се одликувани со брз, фатален тек. Главните клинички симптоми вклучуваат треска, масивна спленомегалија, би- или панцитопенија, гипофибриногенемија, хипертриглицеридемија, симптоми на ЦНС. Лимфохистиоцитозата се дели на две групи - основни (семејни и спорадични) од автосомно рецесивен начин на наследување и секундарни поврзано со разни инфекции, слаб имунитет, автоимуни заболувања и друг вид на клеточна хистиоцитоза.

Епидемиологија
[уреди | уреди извор]Примарната (семејна и спорадична) хемофагоцитна лимфогистиоцитоза се јавува во различни етнички групи и е распространета ширум светот. Инциденцата на примарна хемофагоцитна лимфогистоцитоза, според J.Henter, е околу 1,2 на 1.000.000 деца на возраст под 15 или 1 на 50.000 новороденчиња. Овие показатели се споредливи со распространетоста кај новороденчињата на фенилкетонурија или галактоземија.
Односот на заболени момчиња од девојчиња со примарна хемофагоцитна лимфогистоцитоза е приближно еднаков. Кај 56-80% од децата болеста се развива во првата година од животот, а кај некои од нив се дијагностицира уште при раѓање,а додека кај околу 20% од децата првите клинички знаци на болеста се јавуваат по 3-годишна возраст. Постојат и податоци за развој на болеста на подоцнежна возраст: 6, 8, 12, 25 години. Важно е да се напомене дека возраста на афектираните браќа и сестри е многу често иста. Околу половина од случаите имаат позитивна семејна историја .
Овој тип на хистиоцитоза може да биде примарен или секундарен. Во првиот случај, болеста се пренесува од родители (автозомно рецесивен начин на наследување) со клинички тек од потежок степен (без третман завршува со смртта). Појавата на секундарна лимфохистиоцитоза е поврзана со инфективен или неопластичен процес, како и болести на имунитетот.
Знаци и симптоми
[уреди | уреди извор]Почетокот на ХЛХ се јавува на возраст под една година во приближно 70% од случаите. Семејната ХЛХ се дијагностицира ако симптомите се повторуваат кога терапијата е запрена.
Пациентите со ХЛХ, особено кога не се лекуваат, може да имаат потреба од интензивна терапија . Затоа, ХЛХ треба да биде вклучен во диференцијалната дијагноза на единици за интензивна нега пациенти со цитопенија и хиперферитинемија .[2]
ХЛХ клинички се манифестира со треска, зголемување на црниот дроб и слезината, зголемени лимфни јазли, жолто обезбојување на кожата и очите и осип .
- Треска со продолжено времетраење
- Еритематозно-папуларен осип при достигнување на пикот на високата телесна температура;
- Зголемување на големината на црниот дроб и слезината;
- Оштетување на нервниот систем (менингеални симптоми, зголемен интракранијален притисок, хемиплегија, итн.);
- ДИК синдром; (дисеминирана интраваскуларна коагулопатија);
- панцитопенија (анемија, неутропенија, тромбоцитопенија) во крвта во комбинација со лимфоцитоза;
- зголемени нивоа на серумски трансаминази, билирубин и триглицериди;
- зголемување на концентрацијата на зрелите хистиоцити во црвената коскена срцевина (повеќе од 3%);
- хемофагоцитоза на хистиоцити во коскената срж, слезината или лимфните јазли.
Причини
[уреди | уреди извор]Примарната ХЛХ е предизвикана од мутации за губење на функцијата, (т.е. онеспособување)]] во гените кои кодираат цитотоксични Т-клетки на белковини и НК-клетки кои користат за убивање на насочени клетки, како што се оние заразени со патогени микроорганизми како што се вирусот Епштајн-Бар (ЕБВ) или Денга вирус .[3] Овие мутации ги вклучуваат оние во следниве гени: UNC13D, STX11, RAB27A, STXBP2, LYST, PRF1 1, SH2D1A, BIRC4, ITK, CD27 и MAGT1 .[4]
Секундарната ХЛХ се смета дека е промовирана, од злоќудни и незлоќудни заболувања кои исто така ја ослабуваат способноста на имунитетниот систем да ги напаѓаат клетките заразени со ЕБВ. Злоќудните заболувања поврзани со секундарниот ХЛХ вклучуваат Т-клеточен лимфом, лимфом на Б-клетки, акутна лимфоцитна леукемија, акутна миелоидна леукемија и синдром на миелодиспластичен . Не-злоќудни заболувања поврзани со секундарна ХЛХ вклучуваат: автоимуни нарушувања како што се малолетни идиопатски артритис, малолетничка болест Кавасаки, системски лупус еритематозус, малолетнички почетоци и форми на почетокот на возрасни на Стиленска болест и ревматоиден артритис ;[4] нарушувања на имунодефициенцијата, како што се тешка комбинирана имунодефициенција, синдром ДиГеорге, синдром Вискота - Олдрич, атаксија-телеангиектазија и дисператоза конгенита );[5] и инфекции предизвикани од ЕБВ, цитомегаловирус, ХИВ / СИДА, бактерии, протозои и габи . Секундарната ХЛХ исто така може да биде резултат на јатрогени причини како што се коскена срцевина или други пресадувања на органи; хемотерапија; или терапија со имуносупресивни агенси;[6]
Околу 33% од сите случаи на ХЛХ, 75% од случаите на азилна ХЛХ и скоро 100% од случаите на ХЛХ предизвикани од мутации во SH2D1A (видете X-поврзана лимфопролиферативна болест тип 1 ). Овие случаи на ХЛХ се класифицирани како припаѓаат на класата на лимфопролиферативни заболувања поврзани со вирусот Епштајн-Бар и се нарекуваат EBV + HLH .[7]
Документирано е дека случаите можат да бидат предизвикани од вакцинација, најверојатно заради имунолошка стимулација. Документираните случаи се поврзани со вакцинација против грип.[8]
Патофизиологија
[уреди | уреди извор]Основните причини, или наследни или стекнати, доведуваат до непроверен имунолошки одговор кога се изложени на предизвикувачи. Влошената цитотоксичност на НК-клетките е белег на ХЛХ. Сите генетски дефекти за семејната ХЛХ се поврзани со цитотоксичност зависна од гранула . Оваа неспособност да се отстранат заразените и антигени-клетките присутни и да се прекине имунолошкиот одговор доведува до неконтролирано размножување и активирање на имунолошкиот систем со ослободување на прекумерна цитокини. Овие клетки потоа се инфилтрираат во органи, ослободувајќи повеќе цитокини, што дава клиничка слика. Треската е предизвикана од IL-1, IL-6 и TNF-алфа ; цитопенијата се должи на потиснувачкиот ефект врз хематопоезата од страна на ТНФ-алфа и ТНФ-гама . ТНФ-алфа и ТНФ-гама, исто така, може да доведат до инхибиција на липобелковинска липаза или да ја стимулираат синтезата на триглицерид . Активирани макрофаги лачат феритин и плазминоген активатор што доведува до хиперфибринолиза .[9]
Генетика
[уреди | уреди извор]Опишани се пет генетски поттипови (FHL1, FHL2, FHL3, FHL4 и FHL5), со проценета општа застапеност на еден од 50 000 и еднаква распределба на полот. Молекуларното генетско тестирање за четири од предизвикувачките гени, PRF1 (FHL2), UNC13D (FHL3), STX11 (FHL4) и STXBP2 (FHL5), е достапно на клиничка основа. Симптомите на FHL обично се видливи во првите неколку месеци од животот, па дури може да се појават и во матката . Сепак, симптоматска презентација во текот на детството, па дури и кај младите возрасни години, е забележана во некои случаи.
Петте поттипови на ФХЛ[10] се поврзани со специфичен ген:
- FHL1: HPLH1
- FHL2: PRF1 ( перфорин )
- FHL3: UNC13D (Munc13-4)
- FHL4: STX11 (Синтаксин 11)
- FHL5: STXBP2 (врзувачка белковина со синтаксин 2) / UNC18-2
Скоро половина од случаите на семејна хемофагоцитна лимфохистицитоза од тип 2 се должат на дво-алелични PRF1 мутации.[11]
Дијагноза
[уреди | уреди извор]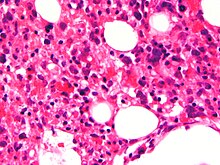
Пребројувањето на крвта обично покажува намален број на крвни клетки - вклучително и намален број на циркуларни црвени крвни зрнца, бели крвни зрнца и тромбоцити . Земање на примерок на коскената срцевина или биопсија на зафатеното ткиво ќе помогне да се потврди дијагнозата. Дијагнозата на хистиоцитозата X се заснова на типични клинички, лабораториски и радиолошки податоци. Сепак, за да се потврди, неопходно е да се изврши пункција на коскената срцевина или биопсија на местото на лезија (коска, лимфен јазол), по што следи патолошка анализа.
За да се избегнат дијагностички грешки, мора да се направи диференцијална дијагностика на следниве болести:
- туберкулоза;
- тумори;
- остеомиелитис;
- лимфогрануломатоза;
- фиброзна остеодистрофија итн.
Коскената срцевина може да покаже хемофагоцитоза .
Тестовите на функцијата на црниот дроб обично се покачени. Ниско ниво на белковински албумин во крвта е вообичаено.
Реактивната белковина во серумот Ц, стапката на седиментација на еритроцитите и нивото на феритин се значително зголемени. Кај деца, феритин над 10000 е многу чувствителен и специфичен за дијагностицирање на ХЛХ,[12] сепак, дијагностичката алатка за феритин е помалку за возрасни пациенти со ХЛХ.[13]
Нивото на серумскиот фибриноген е обично ниско, а нивото на Д-димер е покачено.
Сфингомиелиназата е покачена.[14]
Биопсијата на коскената срцевина покажува хистиоцитоза .
Класификација
[уреди | уреди извор]Примарната ХЛХ, позната и како семејна хемофагоцитна лимфохистиоцитоза (ФХЛ) или семејна еритрофагоцитна лимфохистиоцитоза, е хетерогено автосомно рецесивно нарушување, за кое се смета дека е застапено кај родителската совесност.
Секундарната хемофагоцитна лимфохистиоцитоза (стекната хемофагоцитна лимфохистицитоза) се јавува после силно имунолошко активирање, како што е она што може да се појави со системска инфекција, имунодефициенција или основна злоќуднитет.
Двете форми се одликуваат со огромно активирање на нормални Т лимфоцити и макрофаги, што постојано предизвикува клинички и хематолошки промени и смрт во отсуство на третман.
Опишан е поттип на примарна ХЛХ каде воспалението е ограничено на централниот нервен систем.[15]
Дијагностички критериуми
[уреди | уреди извор]Тековните (2008) дијагностички критериуми за ХЛХ се [16]
1 Молекуларна дијагноза во согласност со ХЛХ. Овие вклучуваат идентификација на патолошки мутации на PRF1, UNC13D или STX11.
ИЛИ
2. Исполнување на пет од осумте критериуми подолу:
- Треска (дефинирана како температура> 100.3)
°F,> 38 °C)
- Проширување на слезината
- Намалени пребројувања на крвните клетки кои влијаат на најмалку две или три лози во периферната крв:
- Хемоглобин <9 g / 100 ml (кај новороденчиња <4 недели: хемоглобин <10 g / 100 ml) ( анемија )
- Тромбоцити <100 × 10 9 / L ( тромбоцитопенија )
- Неутрофили <1 × 10 9 / L ( неутропенија )
- Високо ниво на триглицериди во крвта (постот, поголем или еднаков на 265) mg / 100 ml) и / или намалени количини на фибриноген во крвта (≤ 150 mg / 100 мл)
- Феритин 500 фунти ng / ml
- Хемофагоцитоза во коскената срцевина, слезината или лимфните јазли
- Ниска или отсутна активност на природни убиствени клетки
- Растворлив CD25 (растворлив IL-2 рецептор)> 2400 U / ml (или по локална референтна лабораторија)
Покрај тоа, во случај на семејна ХЛХ, не треба да се појавуваат докази за злоќуднитет.
Не се потребни сите пет од осумте критериуми за дијагностицирање на ХЛХ кај возрасни, а потребен е висок индекс на сомневање за дијагностицирање, бидејќи доцнењето резултира во зголемена смртност. Критериумите за дијагностицирање беа развиени кај педијатриско население и не се потврдени за возрасни пациенти со ХЛХ.[17] Обидите за подобрување на дијагностицирањето на ХЛХ вклучуваат употреба на HScore, што може да се искористи за да се процени ризикот на поединецот од ХЛХ.[18] Кај возрасните, откриено дека растворливиот IL-2 е многу чувствителен маркер за ХЛХ, покажувајќи 100% чувствителност под прекин од 2400 U / ml [19] .
Диференцијална дијагноза
[уреди | уреди извор]Диференцијалната дијагноза на ХЛХ вклучува секундарна ХЛХ и синдром на активирање на макрофагите или други примарни имунодефициенти кои се присутни со хемофагоцитна лимфохистиоцитоза, како што е Х-поврзаната лимфопролиферативна болест .
Други состојби што можат да се мешаат со оваа состојба вклучуваат автоимун лимфопролиферативен синдром .[20] Како синдром на интензивно воспаление треба да се разликува од сепса, што може да биде крајно предизвикувачко.[21]
Дијагнозата на стекнатата или секундарната ХЛХ обично се прави во врска со инфекција со вируси, бактерии, габи или паразити или во врска со лимфом, автоимуна болест или метаболичко заболување. Стекнатиот ХЛХ може да има намалена, нормална или зголемена активност на НК клетки .
Синдром Грисели
[уреди | уреди извор]Главна диференцијална дијагностика на ХЛХ е синдром Гришели (тип 2). Ова е ретко автосомно рецесивно нарушување кое се одликува со делумно албинизам, хепатоспленомегалија, панцитопенија, хепатит, имунолошки абнормалности и лимфохистиоцитоза. Повеќето случаи се дијагностицирани помеѓу 4 месеци и 7 години, со просечна возраст од околу 17 месеци.
Признати се три типа на синдром Гришели : тип 1 има невролошки симптоми и мутации во MYO5A . Прогнозата зависи од сериозноста на невролошките манифестации. Тип 2 има мутации во RAB27A и хемофагоцитниот синдром, со абнормално активирање на Т-клетки и макрофаги. Овој вид има сериозна прогноза ако не се лекува. Тип 3 има мутации во меланофилин и се одликува со делумен албинизам. Овој вид не претставува закана за оние што се засегнати.
Третман
[уреди | уреди извор]Во секундарните случаи, индициран е третман на причината. Покрај тоа, обично е потребен третман за саматаХЛХ.
Додека сè уште се расправа за оптималниот третман на ХЛХ, тековните режими на третман обично вклучуваат кортикостероиди со голема доза, етопозид и циклоспорин. Интравенска имуноглобулин е исто така се користи. Исто така, користени се метотрексат и винкристин. Другите лекови вклучуваат терапија со цитокин насочена. За третман на лицата кои страдаат од хистиоцитоза Х се користат различни опции за комбинирана конзервативна терапија. Добар ефект дава комбинација на кортикостероиди со цитотоксични лекови. Покрај тоа, во третманот може да се користи:
- анти-лимфоцитен глобулин;
- моноклонални антитела кон CD1 антигенот;
- нуклеозидни аналози;
- тимусни препарати;
- терапија со зрачење (на подрачјето на хипофизата);
Со ограничени манифестации на кожата се препишуваат масти со кортикостероиди или ПУВА терапија (терапија со ултравиолетово зрачење во комбинација со фотосензибилизатор). Во примарната хемофагоцитна лимфохистиоцитоза, алогенското пресадување на коскена срцевина се смета за најефикасен третман. Третманот на хемофагоцитна лимфохистиоцитоза вклучува хемотерапија за стабилизирање на пациентот пред да се изврши пресадување на коскена срцевина. Дополнително, се администрираат противгабични агенси, интравенски имуноглобулини. Во тешка спленомегалија се врши спленектомија (отстранување на слезенката). Прогнозата на болеста е сериозна, дури и со соодветен третман, само кај 25% од пациентите стапката на преживување е 5 години. Ремисиите се привремени. Пресадувањето на коскената срцевина е единствениот третман за ова ретко заболување. Третманот кај децата со хистиоцитоза бара мултидисплинарен пристап, однсоно вклучување на имунолог, хематолог, ортопедхирург, стоматолог, специјалистза уво, нос и грло, дерматолог, ендокринолог и други.
На 20 ноември 2018 година, ФДА го одобри анти- МФН -гама моноклонално антитело емапалумаб (комерцијално име Гамифант) за третман на педијатриски и возрасни примарни ХЛХ.[22]
Прогноза
[уреди | уреди извор]Прогнозата се чува со вкупна смртност од 50%. Лошите прогностички фактори вклучуваат ХЛХ поврзани со злоќуднитет, при што половина од пациентите умираат за 1,4 месеци споредено со 22,8 месеци кај пациенти кои не се поврзани со тумор ХЛХ.[23]
Секундарната ХЛХ кај некои лица може да биде самоограничена затоа што пациентите се во можност целосно да се опорават откако добиле само придружен медицински третман (т.е. само IV имуноглобулин ). Како и да е, долгорочната ремисија без употреба на цитотоксични и имуно-потиснувачки терапии е мала веројатност кај повеќето возрасни лица со ХЛХ и кај оние со вклучување на централниот нервен систем (мозок и / или ’рбетниот мозок).[10]
Историја
[уреди | уреди извор]Првиот извештај за случајот на ХЛХ бил објавен во 1952 година.[24]
Истражување
[уреди | уреди извор]Од систематскиот преглед неодамна пријавен процент на содржина е треска 97,2%, хепатомегалија 70,2%, спленомегалија 78,4%, тромбоцитопенија 90,1%, анемија 76,0% и серумски феритин ≥500 μg / L 97,1%. Стапката на смртност во случајот е 14,6% кај пациенти со денга хемофагоцитна лимфохистиоцитоза.[25]
Поврзано
[уреди | уреди извор]Наводи
[уреди | уреди извор]- ↑ Fisman, David N. (2000). „Hemophagocytic syndromes and infection“. Emerging Infect. Dis. 6 (6): 601–8. doi:10.3201/eid0606.000608. PMC 2640913. PMID 11076718.
- ↑ Machowicz, Rafal; Janka, Gritta; Wiktor-Jedrzejczak, Wieslaw (2016-01-01). „Your critical care patient may have HLH (hemophagocytic lymphohistiocytosis)“. Critical Care. 20 (1): 215. doi:10.1186/s13054-016-1369-3. ISSN 1364-8535. PMC 4937543. PMID 27389585.
- ↑ Giang HT, Banno K, Minh LH, Trinh LT, Loc LT, Eltobgy A, Tai LL, Khan A, Tuan NH, Reda Y, Samsom M. Dengue hemophagocytic syndrome: A systematic review and meta‐analysis on epidemiology, clinical signs, outcomes, and risk factors. Reviews in medical virology. 2018 Nov;28(6):e2005. https://onlinelibrary.wiley.com/doi/abs/10.1002/rmv.2005 https://doi.org/10.1002/rmv.2005
- ↑ 4,0 4,1 „Comparing hemophagocytic lymphohistiocytosis in pediatric and adult patients“. Current Opinion in Allergy and Clinical Immunology. 17 (6): 405–413. December 2017. doi:10.1097/ACI.0000000000000405. PMID 28957822.
- ↑ „The syndrome of hemophagocytic lymphohistiocytosis in primary immunodeficiencies: implications for differential diagnosis and pathogenesis“. Haematologica. 100 (7): 978–88. July 2015. doi:10.3324/haematol.2014.121608. PMC 4486233. PMID 26022711.
- ↑ „A consensus review on malignancy-associated hemophagocytic lymphohistiocytosis in adults“. Cancer. 123 (17): 3229–3240. September 2017. doi:10.1002/cncr.30826. PMC 5568927. PMID 28621800.
- ↑ „Epstein–Barr Virus and Hemophagocytic Lymphohistiocytosis“. Frontiers in Immunology. 8: 1902. 2017. doi:10.3389/fimmu.2017.01902. PMC 5766650. PMID 29358936.
- ↑ https://link.springer.com/article/10.1007%2Fs12185-016-2177-x
- ↑ Usmani, G. Naheed; Woda, Bruce A.; Newburger, Peter E. (2013). „Advances in understanding the pathogenesis of HLH“. British Journal of Haematology (англиски). 161 (5): 609–622. doi:10.1111/bjh.12293. ISSN 1365-2141. PMID 23577835.
- ↑ 10,0 10,1 Zhang, Kejian; Filopovich, Alexandra H.; Johnson, Judith; Marsh, Rebecca A.; Villanueva, Joyce (January 17, 2013). „Hemophagocytic Lymphohistiocytosis, Familial“. GeneReviews. PMID 20301617. NBK1444.
- ↑ „Human perforin mutations and susceptibility to multiple primary cancers“. Oncoimmunology. 2 (4): e24185. April 2013. doi:10.4161/onci.24185. PMC 3654607. PMID 23734337.
- ↑ Allen, Carl (June 2008). „Highly elevated ferritin levels and the diagnosis of hemophagocytic lymphohistiocytosis“. Pediatric Blood & Cancer. 50 (6): 1227–35. doi:10.1002/pbc.21423. PMID 18085676.
- ↑ Schram, Alison (March 5, 2015). „Marked hyperferritinemia does not predict for HLH in the adult population“. Blood. 125 (10): 1548–52. doi:10.1182/blood-2014-10-602607. PMID 25573993.
- ↑ „Evaluation of the role of secretory sphingomyelinase and bioactive sphingolipids as biomarkers in hemophagocytic lymphohistiocytosis“. Am. J. Hematol. 88 (11): E265–72. November 2013. doi:10.1002/ajh.23535. PMC 4348111. PMID 23828274.
- ↑ Benson LA, Li H, Henderson LA, Solomon IH, Soldatos A, Murphy J, Bielekova B, Kennedy AL, Rivkin MJ, Davies KJ, Hsu AP, Holland SM, Gahl WA, Sundel RP, Lehmann LE, Lee MA, Alexandrescu S, Degar BA, Duncan CN, Gorman MP (2019) Pediatric CNS-isolated hemophagocytic lymphohistiocytosis. Neurol Neuroimmunol Neuroinflamm 6(3):e560
- ↑ „Hematopoietic cell transplantation for hemophagocytic lymphohistiocytosis: a journey of a thousand miles begins with a single (big) step“. Bone Marrow Transplant. 42 (7): 433–7. October 2008. doi:10.1038/bmt.2008.232. PMID 18679369.
- ↑ Schram, Alison (May 7, 2015). „How I treat hemophagocytic lymphohistiocytosis in the adult patient“. Blood. 125 (19): 2908–14. doi:10.1182/blood-2015-01-551622. PMID 25758828.
- ↑ Fardet, Laurence (September 9, 2014). „Development and Validation of the HScore, a Score for the Diagnosis of Reactive Hemophagocytic Syndrome“. Arthritis & Rheumatology. 66 (9): 2613–20. doi:10.1002/art.38690. PMID 24782338.
- ↑ Hayden, Anna (December 2017). „Soluble interleukin-2 receptor is a sensitive diagnostic test in adult HLH“. Blood Advances. 1 (26): 2529–2534. doi:10.1182/bloodadvances.2017012310. PMC 5728644. PMID 29296904.
- ↑ „Autoimmune lymphoproliferative syndrome misdiagnosed as hemophagocytic lymphohistiocytosis“. Pediatrics. 132 (5): e1440–4. November 2013. doi:10.1542/peds.2012-2748. PMC 3813387. PMID 24101757.
- ↑ „Similar but not the same: Differential diagnosis of HLH and sepsis“. Critical Reviews in Oncology/Hematology. 114: 1–12. March 2017. doi:10.1016/j.critrevonc.2017.03.023. PMID 28477737.
- ↑ „Press Announcements - FDA approves first treatment specifically for patients with rare and life-threatening type of immune disease“. 2019-03-06.
- ↑ Parikh, Sameer (April 2014). „Prognostic factors and outcomes of adults with hemophagocytic lymphohistiocytosis“. Mayo Clinic Proceedings. 89 (4): 484–92. doi:10.1016/j.mayocp.2013.12.012. PMID 24581757. Посетено на December 14, 2015.
- ↑ Farquhar, James W.; Claireaux, Albert E. (December 1952). „Familial Haemophagocytic Reticulosis“. Archives of Disease in Childhood. 27 (136): 519–525. doi:10.1136/adc.27.136.519. PMC 1988563. PMID 13008468.
- ↑ Giang, Hoang Thi Nam; Banno, Keita; Minh, Le Huu Nhat; Trinh, Lam Tuyet; Loc, Le Thai; Eltobgy, Asmaa; Tai, Luu Lam Thang; Khan, Adnan; Tuan, Nguyen Hoang (2018-08-15). „Dengue hemophagocytic syndrome: A systematic review and meta-analysis on epidemiology, clinical signs, outcomes, and risk factors“. Reviews in Medical Virology (англиски). 28 (6): e2005. doi:10.1002/rmv.2005. ISSN 1052-9276. PMID 30109914.
Надворешни врски
[уреди | уреди извор]| Класификација | |
|---|---|
| Надворешни извори |