Tetrakis(dimethylamino)etheen
| Tetrakis(dimethylamino)etheen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van tetrakis(dimethylamino)etheen
| ||||
| Algemeen | ||||
| Molecuulformule | C10H24N4 | |||
| IUPAC-naam | 1N,1N,1N',1N',2N,2N,2N',2N'-octamethyletheen-1,1,2,2-tetra-amine | |||
| Andere namen | octamethyletheentetramine, TDAE | |||
| Molmassa | 200,32 g/mol | |||
| SMILES | CN(C)C(=C(N(C)C)N(C)C)N(C)C
| |||
| InChI | 1S/C10H24N4/c1-11(2)9(12(3)4)10(13(5)6)14(7)8/h1-8H3
| |||
| CAS-nummer | 996-70-3 | |||
| PubChem | 70455 | |||
| Wikidata | Q3546869 | |||
| Beschrijving | Kleurloze vloeistof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H226 - H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 - P310 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Dichtheid | 0,861 g/cm³ | |||
| Smeltpunt | −4 °C | |||
| Brekingsindex | 1,48 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Tetrakis(dimethylamino)etheen of TDAE is een symmetrisch opgebouwd organisch amine met als brutoformule C10H24N4. Formeel kan het beschouwd worden als een derivaat van etheen, waarin de vier waterstofatomen zijn vervangen door dimethylaminogroepen. Deze verbinding behoort tot de klasse van de enamines. Primaire en secondaire enamines hebben de neiging te polymeriseren, maar tertiaire enamines zijn kinetisch stabiel. Het speciale aan deze verbinding wordt gevormd door de symmetrische substitutie met vier aminogroepen. Het symmetrisch pi-donerende vermogen van de vier stikstof-atomen verschaft de dubbele binding een typisch alkeen-karakter.
Synthese
[bewerken | brontekst bewerken]Tetrakis(dimethylamino)etheen werd voor het eerst bereid in 1950 door Roy Pruett en diens medewerkers, door de reactie van dimethylamine met chloortrifluoretheen.[1]
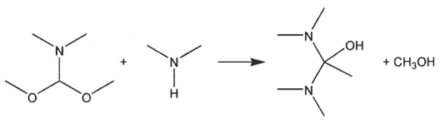
De verbinding valt praktischer (en minder duur) te bereiden via de reactie van (dimethoxymethyl)dimethylamine met dimethylamine:
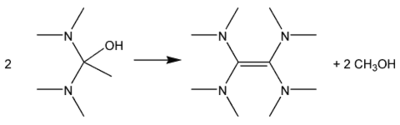
Door het reactiemengsel te destilleren wordt methanol afgevoerd, waarna tetrakis(dimethylamino)etheen overblijft:
Fysische eigenschappen
[bewerken | brontekst bewerken]Tetrakis(dimethylamino)etheen is een sterke reductor, die in chemische reacties als elektronendonor kan optreden, of als initiator van polymerisatiereacties.
Tetrakis(dimethylamino)etheen is een vloeistof, die kookt bij 367 °C onder een druk van 1,3 mbar. Ze is stabiel in water, maar reageert met zuurstofgas uit de lucht. Ze moet dus bewaard worden zonder in contact te komen met de lucht.[2]
Chemische eigenschappen
[bewerken | brontekst bewerken]De verbinding kan beschreven worden als het dimeer van een relatief stabiel carbeen met neiging tot dimerisatie.
Bij contact van tetrakis(dimethylamino)etheen met luchtzuurstof treedt chemoluminescentie op, een algemeen verschijnsel bij 1,2-dioxetaan-derivaten die snel gevormd worden bij contact met luchtzuurstof. Er wordt blauw-groen licht met een golflengte rond 510 nm uitgezonden. Dit effect treedt op zodra de stof aan de lucht wordt blootgesteld[3] en het kan gebruikt worden voor speciale effecten, zoals de zogenaamde lichtgevende handen: wanneer enkele druppels van de stof op latex-handschoenen uitgewreven worden, blijven die gedurende enkele minuten lichtgevend. Direct contact met de huid moet evenwel vermeden worden want het is een corrosieve verbinding die brandwonden kan veroorzaken. De reactie tussen tetrakis(dimethylamino)etheen en zuurstofgas wordt oncontroleerbaar bij een temperatuur van 70 °C of meer en kan resulteren in brand of een explosie.[2] Onderstaand schema geeft deze reactie weer.
Met buckminsterfullereen vormt het een zout met de brutoformule C60(TDAE), dat een zuiver organische, niet-polymere ferromagneet is met een Curietemperatuur van 16,1 K.[4]
Bij oxidatie ontstaat het dikation. Beide π-elektronen worden uit het molecuul weggeoxideerd.
Structuur
[bewerken | brontekst bewerken]Röngendiffractie laat zien dat TDAE een sterk vervwrongen alkeen is. De twee N-C-N-delen van het molecuul maken een hoek van 28° met elkaar (0° is normaal). De koolstof-koolstaf-afstand is met 135 pm even groot als in het bijna isostructurele tetra-iso-propyletheen waarvan echter alle 6 atomen van en direct aan de dubbele band in één plat vlak liggen.
In tegenstelling tot de neutrale verbinding is het dikation voor zijn centrale binding (150 pm) goed te beschrijven als een alkaan. De duidelijk korter geworden koolstof-stikstofbinding geeft aan dat de N-C-N-delen een sterkere band (= meer dubbele band karakter) vertonen.[5]

- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Tétrakis(diméthylamino)éthylène op de Franstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Tetrakis(dimethylamino)ethylene op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Verwijzingen in de tekst
- ↑ (en) R.L. Pruett, J.T. Barr, K.E. Rapp, C.T. Bahner, J.D. Gibson & R.H. Lafferty, jr. (1950) – Reactions of Polyfluoro Olefins. II. Reactions with Primary and Secondary Amines, J. Am. Chem. Soc., 72 (8), 3646-3650
- ↑ a b U.S. Patent 3293299, "Process for making tetrakis(dimethylamino)ethylene" van 20 december 1966 aan E.I. Du Pont de Nemours and Company
- ↑ (en) H.E. Winberg, J.R. Downing & D.D. Coffman (1965) – The Chemiluminescence of Tetrakis(dimethylamino)ethylene, J. Am. Chem. Soc., 87 (9), 2054-2055
- ↑ (en) Pierre-Marc Allemand et al. (1991) – Organic Molecular Soft Ferromagnetism in a Fullerene C60, Science, pp. 301-303
- ↑ a b Bock, Hans, Borrmann, Horst, Havlas, Zdenek, Oberhammer, Heinz, Ruppert, Klaus (1991). Tetrakis(dimethylamino)ethene: An Extremely Electron-Rich Molecule with Unusual Structure both in the Crystal and in the Gas Phase. Angewandte Chemie International Edition in English 30 (12): 1678–1681. DOI: 10.1002/anie.199116781.



![{\displaystyle {\ce {C2(N(CH3)2)4\ +\ C60\ ->\ [C2(N(CH3)2)4]^{+}[C60]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd3a92053fbc8f84b21b41e05f9af60a3f00f827)