Agar czekoladowy
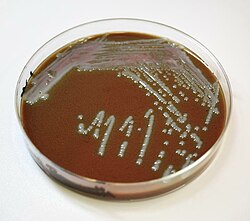
Agar czekoladowy (CHOC; ang. chocolate agar) – nieselektywna mikrobiologiczna pożywka specjalna, w której skład wchodzi zlizowana krew (wzbogacająca pożywkę o NAD, hem i inne składniki odżywcze), umożliwiająca hodowlę wybrednych szczepów bakterii[2].
Pożywka nie zawiera czekolady, a nazwa została jej nadana wyłącznie ze względu na czekoladową barwę spowodowaną obecnością zhemolizowanych erytrocytów.
Historia
[edytuj | edytuj kod]Na początku XX wieku nie znano idealnej pożywki nadającej się do hodowli bakterii o wysokich wymaganiach odżywczych, takich jak gonokoki[3]. Stosowano podłoża z węglanem sodu, cielęciną, albuminami (z krwi lub płynu mózgowo-rdzeniowego), brzeczką piwną, serwatką, sacharozą, moczem, wyciągiem z jąder lub jajek; rezultaty były jednak niezadowalające[3]. W 1910 Cohen i Fitzgerald opracowali krwawy agar czekoladowy, który został użyty do hodowli Haemophilus[4]. W 1927 McLeod opracował podłoże[5], użyte po raz pierwszy do (udanej) hodowli gonokoków[4]. W latach 30. XX wieku agar czekoladowy przygotowywano poprzez podgrzewanie agaru z krwią[6], natomiast wcześniej ogrzewano wyciąg z mięsa[4].
Problemem podłoża był wzrost bakterii stanowiących florę fizjologiczną – przykładowo przy posiewie w kierunku gonokoków częściej wyrastał Proteus mirabilis[7]. Dopiero dodawanie do pożywki ristocetyny i polimyksyn (1964), wankomycyny i nystatyny (1967) oraz trimetoprymu (1970) rozwiązało problem bakterii komensalnych[7].
Skład
[edytuj | edytuj kod]W skład agaru czekoladowego wchodzą[8]:
- agar-agar;
- pepton;
- mąka kukurydziana;
- K2HPO4;
- KH2PO4;
- oryginalnie krew, najczęściej owcy, przy czym jakość pożywki czekoladowej zależnie od źródła krwi (koza, baran, owca, świnia[9]) jest podobna[10], obecnie źródłem niezbędnych substancji (hem, NAD etc.) nie jest zwykle krew, ale są one dodawane osobno[2];
- ewentualne dodatki (patrz sekcja warianty).
Przygotowanie
[edytuj | edytuj kod]Pożywkę przygotowuje się poprzez kilkukrotne podgrzewanie i ochładzanie w łaźni wodnej agaru z krwią w temperaturze 100 °C[10] i pod wyższym ciśnieniem[8]; po pewnym czasie pojawia się jednolite zabarwienie, oznaczające hemolizę krwinek czerwonych (istnieje wiele protokołów z różnymi czasami ogrzewania i temperaturą). W przypadku przygotowania pożywki z krwi świni temperatura musi być nieco wyższa[9]. Krew kozy posiada termowrażliwy inhibitor wzrostu działający na Haemophilus, co wymusza wydłużenie czasu ogrzewania do 15 minut w celu zdezaktywowania go[10]. Efekt inhibitora nie jest neutralizowany dodatkiem NAD do nieogrzewanej pożywki[10].
Po wysterylizowaniu i wymieszaniu pożywka rozlewana jest do odpowiednich naczyń hodowlanych (np. szalek Petriego)[8].
Obecnie przy produkcji CHOC niezbędne do wzrostu czynniki (NAD, hemoglobina i inne) są dodawane osobno, nie ma więc potrzeby dodawania krwi i lizy erytrocytów[2].
Zastosowanie
[edytuj | edytuj kod]Zaletą agaru czekoladowego jest to, że umożliwia wzrost wymagającym bakteriom takim jak Haemophilus[11] czy Neisseria[11], Moraxella[12], które nie rosną na rutynowo stosowanych pożywkach[13]. Gatunki te nie wytwarzają hemolizyn niszczących erytrocyty, a równocześnie potrzebują do wzrostu związków obecnych we wnętrzu tych komórek. Dlatego wzrost tych drobnoustrojów jest możliwy dopiero po uszkodzeniu erytrocytów (lizie) poprzez ich ogrzanie. Równocześnie niskie stężenie agaru zapewnia dostateczną wilgoć niezbędną do wzrostu[14]. Podłoże stosowane jest do hodowli bakterii tlenowych lub fakultatywnych beztlenowców[12]. Wzrastają na nim – podobnie jak na agarze krwawym – paciorkowce i gronkowce[15].
Agar czekoladowy jest najlepszym podłożem do hodowli Bartonella henselae (obok agaru z krwi króliczej)[16] oraz Eikenella corrodens[17].
Wyniki odczytuje się zazwyczaj po 48 godzinach (18–24 w przypadku gonokoków)[18].
- Krew
Agar czekoladowy jest rutynowo wykorzystywany podczas posiewu krwi przy podejrzeniu bakteriemii[18] lub infekcyjnego zapalenia wsierdzia[19].
- Płyn mózgowo-rdzeniowy
Przy podejrzeniu zapalenia opon-mózgowo rdzeniowych należy bezwzględnie wykonać posiew na agarze czekoladowym, ponieważ dwoinka zapalenia opon mózgowo-rdzeniowych nie wzrasta na innych podłożach[20][21][22][23][24].
- Plwocina
Agar czekoladowy z bacytracyną jest używany przy posiewie plwociny[25].
- Żółć
Rutynowe posiewy żółci na agar czekoladowy nie są zalecane, chyba że preparat bezpośredni będzie charakterystyczny dla Haemophilus[26].
- Mocz
0,27% przypadków zakażeń układu moczowego jest spowodowane przez Haemophilus, natomiast w podgrupie dzieci wskaźnik ten wzrasta do 0,88%[27]. Z tego powodu zaleca się posiew moczu na agar czekoladowy przynajmniej u dzieci[27], nie jest to jednak wymogiem[28].
- Posiew z tkanek
Agar czekoladowy jest wykorzystywany przy posiewach w przypadku zapaleń tkanek głębokich – na przykład tkanki łącznej[25], zapalenia ucha[29] oraz szpiku u dzieci[25]. Przy wymazie z oka należy zawsze wykonać posiew także na agarze czekoladowym[30].
Agar czekoladowy nie jest zalecany przy posiewie bioptatów żołądka, ponieważ inne rutynowo stosowane podłoża zapewniają efektywniejszy wzrost Helicobacter pylori[31][32][32][33].
- Hodowla grzybów
Podłoże to nie jest stosowane podczas diagnostyki zakażeń grzybiczych[34] jednak wzrastają na nim liczne grzyby[35]. W badaniu porównawczym 5 podłóż (w tym Sabourauda) najszybszy wzrost grzybów uzyskano na agarze czekoladowym[35]. Wyjątkiem było Histoplasma capsulatum gdzie nie uzyskiwano wzrostu – być może wzrost tych grzybów na agarze z krwią jest dłuższy, a metodologia zakładała hodowlę podłóż krwawych jedynie przez 3 dni[35]. Z powodu H. capsulatum nie zaleca się ograniczania tradycyjnych podłóż w kierunku grzybów[35].
- Badanie oporności
Badanie oporności prątków gruźlicy za pomocą E-testów nie powinno się odbywać na agarze czekoladowym ze względu na długi czas oczekiwania wyników (21 dni); agar krwawy zapewnia krótszy okres oczekiwania (10 dni) i to on powinien być stosowany jeśli laboratorium nie dysponuje podłożem Middlebrooka 7H11[36].
Ograniczenia
[edytuj | edytuj kod]Wadą pożywki jest to, że wyrastają na nich praktycznie wszystkie możliwe bakterie pobrane w biomateriale, dlatego posiew np. z kału jest niemożliwy. Z tych przyczyn, jeśli jest to możliwe, wykorzystuje się inne podłoża, na których może wyrosnąć tylko jeden rodzaj bakterii.
Nie jest możliwa ocena strefy hemolizy wokół kolonii (w przeciwieństwie do agaru z krwią); występuje natomiast zmiana zabarwienia jeśli szczepy bakterii wytwarzają peroksydazę[6].
Warianty
[edytuj | edytuj kod]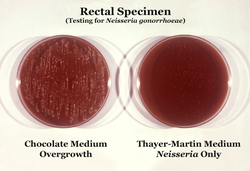
- Isovitalex
Wersja agaru czekoladowego wzbogacona o składnik isovitalex (IVX), będący źródłem dodatkowych cząsteczek NAD dla H. influenzae[37]. Nieznacznie przyspiesza on wzrost na płytkach z agarem czekoladowym (kolonie bakterii w porównaniu do podłoża standardowego większe o około 1mm), jednak cena takiej pożywki jest dwa razy większa[37]; dlatego nie jest preferowana przez część badaczy[37].
W skład dodatku isovitalex wchodzi glukoza, L-cysteina, L-glutamina, adenina, guanina, witamina B12, tiamina oraz NAD[8].
- Witamina B6
Pożywka z dodatkiem witaminy B6 używana do hodowli niektórych paciorkowców[18].
- Agar czekoladowy II
Głównym dodatkiem jest kazeina oraz inne źródło peptonu[8].
- Antybiotyki
Antybiotyki są dodawane w celu selekcji niepożądanych szczepów (agar czekoladowy po ich dodaniu staje się z pożywki nieselektywnej, pożywką selektywną)[2].
- Bacytracyna – wybiórcza dla Haemophilus; dodatek ten jest zalecany dla posiewu z górnych dróg oddechowych (zanieczyszczenia florą fizjologiczną)[18];
- Wankomycyna – hamuje wzrost bakterii Gram-dodatnich (oraz rzadko także poszukiwane N. gonorrhoeae[2]). Można stosować zamiennie teikoplaninę[38] lub linkomycynę[39];
- Kolistyna – hamuje wzrost bakterii Gram-ujemnych;
- Nystatyna – hamuje wzrost grzybów. Ponieważ część szczepów Candida albicans jest oporna na nystatynę, stosuje się zamiennie anizomycynę lub amfoterycynę B[2];
- Trimetoprym – hamuje wzrost bakterii z rodzaju Proteus.
Przypisy
[edytuj | edytuj kod]- ↑ B.W. Reary, S.A. Klotz. Enhancing recovery of Francisella tularensis from blood. „Diagn Microbiol Infect Dis”. 11 (2), s. 117–119, Oct 1988. PMID: 3229097.
- ↑ a b c d e f Chocolate Agar Media. PML microbiologicals, Nov 2008. [dostęp 2009-11-22]. (ang.).
- ↑ a b E. Gejdel. [Complicated pregnancy]. „Pieleg Polozna”, s. 5, 1983. PMID: 6558701.
- ↑ a b c M.L. Koch. Pancreatic Digest Chocolate Blood Agar for the Isolation of the Gonococcus. „J Bacteriol”. 56 (1), s. 83–87, Jul 1948. PMID: 16561550.
- ↑ HARDY DIAGNOSTICS: CHOCOLATE AGAR. [dostęp 2009-11-17]. [zarchiwizowane z tego adresu (2010-05-05)]. (ang.).
- ↑ a b E. Leifson. Types of Bacteria on Blood and Chocolate Agar and the Immediate Cause of These Types. „J Bacteriol”. 24 (6), s. 473–487, Dec 1932. PMID: 16559599.
- ↑ a b R.H. Riddell, A.C. Buck. Trimethoprim as an additional selective agent in media for the isolation of N. gonorrhoeae. „J Clin Pathol”. 23 (6), s. 481–483, Sep 1970. PMID: 4990999.
- ↑ a b c d e Ronald M. Atlas: Handbook of microbiological media. Boca Raton, Fla.: CRC Press, 2004, s. 343. ISBN 978-0-8493-1818-4.
- ↑ a b C. Anand, R. Gordon, H. Shaw, K. Fonseca i inni. Pig and goat blood as substitutes for sheep blood in blood-supplemented agar media. „J Clin Microbiol”. 38 (2), s. 591–594, Feb 2000. PMID: 10655351.
- ↑ a b c d M. Gratten, D. Battistutta, P. Torzillo, J. Dixon i inni. Comparison of goat and horse blood as culture medium supplements for isolation and identification of Haemophilus influenzae and Streptococcus pneumoniae from upper respiratory tract secretions. „J Clin Microbiol”. 32 (11), s. 2871–2872, Nov 1994. PMID: 7852593.
- ↑ a b X.Y. Han, T. Hong, E. Falsen. Neisseria bacilliformis sp. nov. isolated from human infections. „J Clin Microbiol”. 44 (2), s. 474–479, Feb 2006. DOI: 10.1128/JCM.44.2.474-479.2006. PMID: 16455901.
- ↑ a b Gilbert Smolin, Charles Stephen Foster, Dimitri T. Azar, Claes H. Dohlman: Smolin and Thoft’s The cornea: scientific foundations and clinical practice. 2005, s. 254.
- ↑ Podstawy mikrobiologii lekarskiej. Podręcznik dla studentów. Warszawa: Państwowy Zakład Wydawnictw Lekarskich, 1979, s. 507–508. ISBN 83-200-0181-1.
- ↑ Essential Procedures for Clinical Microbiology. s. 53. ISBN 978-1-55581-125-9.
- ↑ B.A. Gunn. Chocolate agar, a differential medium for gram-positive cocci. „J Clin Microbiol”. 20 (4), s. 822–823, Oct 1984. PMID: 6490866.
- ↑ H. Tsuneoka, C. Ishida, A. Umeda, H. Inokuma i inni. [Evaluation of isolation media for the detection of Bartonella henselae--isolation of Bartonella henselae from domestic cats]. „Kansenshogaku Zasshi”. 78 (7), s. 574–579, Jul 2004. PMID: 15359889.
- ↑ E.J. Goldstein, E.O. Agyare, R. Silletti. Comparative growth of Eikenella corrodens on 15 media in three atmospheres of incubation. „J Clin Microbiol”. 13 (5), s. 951–953, May 1981. PMID: 6787077.
- ↑ a b c d BBL Chocolate II Agar with Bacitracin. BD Medical Technology, Advancing the World of Health. [dostęp 2018-11-02]. (ang.).
- ↑ L.I. Kupferwasser, A.S. Bayer. [Culture-negative endocarditis: etiology, diagnosis, management and therapy]. „Herz”. 26 (6), s. 398–408, Sep 2001. PMID: 11683070.
- ↑ S. Catania, M.P. Ronchetti, N. Catania, G. Berardelli i inni. Hemophilus influenzae type b meningitis: pediatric overview. „Riv Eur Sci Med Farmacol”. 18 (4). s. 163–167. PMID: 9177616.
- ↑ N.M. Weis, I. Lind. [Meningococcal disease: are patients carriers of meningococci after treatment with antibiotics?]. „Ugeskr Laeger”. 152 (19), s. 1362–1365, May 1990. PMID: 2111593.
- ↑ T.D. Sullivan, L.J. LaScolea, E. Neter. Relationship between the magnitude of bacteremia in children and the clinical disease. „Pediatrics”. 69 (6), s. 699–702, Jun 1982. PMID: 6804923.
- ↑ J.V. Hirschmann, E.D. Everett. Haemophilus influenzae infections in adults: report of nine cases and a review of the literature. „Medicine (Baltimore)”. 58 (1), s. 80–94, Jan 1979. PMID: 310943.
- ↑ S.C. Singhi, D. Mohankumar, P.D. Singhi, S. Sapru i inni. Evaluation of polymerase chain reaction (PCR) for diagnosing Haemophilus influenzae b meningitis. „Ann Trop Paediatr”. 22 (4), s. 347–353, Dec 2002. DOI: 10.1179/027249302125002010. PMID: 12530285.
- ↑ a b c Peter Hawkey, Deirdre Lewis: Medical bacteriology: a practical approach. s. 67, 142, 167.
- ↑ E.J. Bottone, D.Y. Zhang. Haemophilus parainfluenzae biliary tract infection: rationale for an ascending route of infection from the gastrointestinal tract. „J Clin Microbiol”. 33 (11), s. 3042–3043, Nov 1995. PMID: 8576372.
- ↑ a b F. Galán, P. García-Martos, J. Mira. [Urinary tract infection caused by Haemophilus spp. in pediatrics: a rarely studied disease]. „Enferm Infecc Microbiol Clin”. 14 (8), s. 483–485, Oct 1996. PMID: 9011206.
- ↑ D.E. Boyd, D.J. Flournoy, S.M. Hussain Qadri. An evaluation of the gram stain and chocolate agar culture as part of a routine urine culture set-up. „Med Microbiol Immunol”. 169 (1), s. 63–66, 1980. PMID: 6162084.
- ↑ G. Ninkovic, V. Dullo, N.C. Saunders. Microbiology of otitis externa in the secondary care in United Kingdom and antimicrobial sensitivity. „Auris Nasus Larynx”. 35 (4), s. 480–484, Dec 2008. DOI: 10.1016/j.anl.2007.09.013. PMID: 18314283.
- ↑ Linda Casser, Murray Fingeret,H. Ted Woodcome: Atlas of Primary Eyecare Procedures. s. 201.
- ↑ F.J. Merino, A.M. Andrés, A. Campos, I. Carramiñana i inni. [Evaluation of 4 media for the isolation of Helicobacter pylori from gastric biopsies]. „Enferm Infecc Microbiol Clin”. 12 (4), s. 200–203, Apr 1994. PMID: 8031887.
- ↑ a b W. Tee, S. Fairley, R. Smallwood, B. Dwyer. Comparative evaluation of three selective media and a nonselective medium for the culture of Helicobacter pylori from gastric biopsies. „J Clin Microbiol”. 29 (11), s. 2587–2589, Nov 1991. PMID: 1774265.
- ↑ M.J. Fresnadillo Martínez, M. Rodríguez Rincón, A.M. Blázquez de Castro, E. García Sánchez i inni. Comparative evaluation of selective and nonselective media for primary isolation of Helicobacter pylori from gastric biopsies. „Helicobacter”. 2 (1), s. 36–39, Mar 1997. PMID: 9432320.
- ↑ C.C. Sheth, E. Johnson, M.E. Baker, K. Haynes i inni. Phenotypic identification of Candida albicans by growth on chocolate agar. „Med Mycol”. 43 (8), s. 735–738, Dec 2005. PMID: 16422305.
- ↑ a b c d G.W. Procop, F.R. Cockerill, E.A. Vetter, W.S. Harmsen i inni. Performance of five agar media for recovery of fungi from isolator blood cultures. „J Clin Microbiol”. 38 (10), s. 3827–3829, Oct 2000. PMID: 11015411.
- ↑ A.Y. Coban, K. Bilgin, M. Uzun, A. Akgunes i inni. Comparative study for determination of Mycobacterium tuberculosis susceptibility to first- and second-line antituberculosis drugs by the Etest using 7H11, blood, and chocolate agar. „J Clin Microbiol”. 46 (12), s. 4095–4098, Dec 2008. DOI: 10.1128/JCM.01104-08. PMID: 18945843.
- ↑ a b c S.K. Saha, A.H. Baqui, G.L. Darmstadt, M. Islam i inni. Addition of isovitalex in chocolate agar for the isolation of Haemophilus influenzae. „Indian J Med Res”. 129 (1), s. 99–101, Jan 2009. PMID: 19287066.
- ↑ Z. Csukás, I. Cserba. A new selective method for isolation of Haemophilus species. „Acta Microbiol Immunol Hung”. 44 (4), s. 355–359, 1997. PMID: 9554169.
- ↑ Z. Csukás. New selective medium for the isolation of Haemophilus species. „Acta Microbiol Acad Sci Hung”. 27 (2), s. 141–145, 1980. PMID: 6968151.
Bibliografia
[edytuj | edytuj kod]- Podstawy mikrobiologii lekarskiej. Podręcznik dla studentów. Warszawa: Państwowy Zakład Wydawnictw Lekarskich, 1979, s. 498. ISBN 83-200-0181-1.
- Mikrobiologia i choroby zakaźne. Wrocław: Urban & Partner, 2000, s. 103. ISBN 83-85842-59-4.