Auramina O
| |||||||||||||||||||
| |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Wzór sumaryczny |
C17H22ClN3 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
303,83 g/mol | ||||||||||||||||||
| Wygląd |
żółte igły[1] | ||||||||||||||||||
| Identyfikacja | |||||||||||||||||||
| Numer CAS | |||||||||||||||||||
| PubChem | |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||
Auramina O – organiczny związek chemiczny z grupy związków difenylometanowych, będący chlorowodorkiem iminiowym. Zaliczana jest do zasadowych barwników difenylometanowych wraz z podobną do niej strukturalnie auraminą G.
Stosowana jest przede wszystkim do barwienia papieru i w preparatyce histologicznej. W innych zastosowaniach jej znaczenie maleje, a jako barwnik spożywczy jest zakazana w wielu państwach. Jest substancją prawdopodobnie rakotwórczą dla człowieka.
Otrzymywanie
[edytuj | edytuj kod]Auramina O nie występuje naturalnie, jest substancją pochodzenia syntetycznego[5]. Po raz pierwszy otrzymali ją w 1883 roku Heinrich Caro i Alfred Kern w reakcji ketonu Michlera (4,4′-bis(dimetyloamino)benzofenonu) z chlorkiem amonu i chlorkiem cynku, prowadzonej w temperaturze rzędu 150–160 °C[6].
Współcześnie stosowaną metodą jest przepuszczanie amoniaku przez mieszaninę reakcyjną złożoną z zasady Michlera, tj. 4,4′-metylenobis(N,N-dimetyloaniliny), siarki i chlorku amonu w temperaturze 200 °C. Produktem przejściowym w tej reakcji jest tioketon Michlera – 4,4′-bis(dimetyloamino)tiobenzofenon[7].
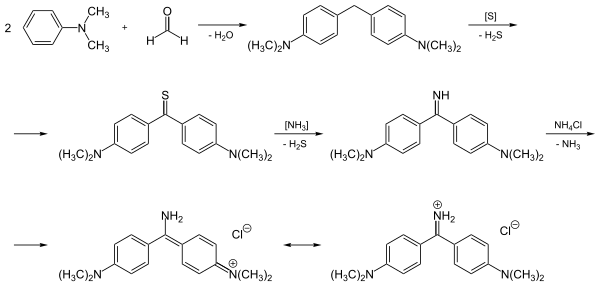
- Schemat otrzymywania auraminy O obejmujący etap syntezy zasady Michlera z formaldehydu i N,N-dimetyloaniliny, następnie ogrzewania go wraz z pozostałymi składnikami mieszaniny reakcyjnej i przepuszczania przez nią amoniaku
Właściwości
[edytuj | edytuj kod]Jest to żółte ciało stałe, które średnio rozpuszcza się w zimnej wodzie, znacznie lepiej w ciepłej[2]. Podobną rozpuszczalność wykazuje w pirydynie, jeszcze lepiej rozpuszcza się w takich rozpuszczalnikach jak etanol, gliceryna, glikol etylenowy, 2-etoksyetanol czy alkohol benzylowy, jednak znacznie słabiej w chloroformie, dioksanie czy ksylenie[8]. Podczas ogrzewania powyżej 250 °C rozkłada się[2], jednak w roztworach wodnych może ulegać rozkładowi już przy ogrzewaniu powyżej 50 °C[8]. Wykazuje właściwości fluorescencyjne[5]. Maksimum absorpcji przypada na długości fal 370 nm i 432 nm, natomiast maksimum emisji na 550 nm[3].
-
Próbka auraminy O
-
Wodny roztwór auraminy O
Zastosowanie
[edytuj | edytuj kod]Auramina O, jak również inne sole auraminy, znalazła zastosowanie przede wszystkim jako barwnik w wielu działach przemysłu. Barwiono nią skórę, włókna jutowe i bawełniane, woski i oleje, była stosowana w taśmach barwiących, tuszach długopisów i kalkach. Duże znaczenie odgrywała w barwieniu papieru i fleksografii[5]. Już w czasie I wojny światowej była stosowana jako składnik mieszanin pirotechnicznych służących do wytwarzania żółego, żółtozielonego bądź zielonego dymu[9][10].
Jako barwnik histologiczny stosowana jest w preparatyce do barwienia bakterii kwasoopornych, w tym w mieszaninie z rodaminą B jest wykorzystywana jako technika diagnostyczna do barwienia prątków gruźlicy (barwienie metodą Truanta)[5][11].
Szczególnie w latach 30. XX wieku bywała składnikiem brylantyny do włosów. W części państw była stosowana jako barwnik spożywczy. Również obecnie wykrywana jest w niektórych produktach spożywczych pochodzących z Azji[5], choć w wielu państwach jej stosowanie w żywności jest zabronione[12]. W wielu zastosowaniach została wyparta przez mniej toksyczne substancje, a produkcja w Stanach Zjednoczonych i Unii Europejskiej została zaprzestana. Większość jej światowej produkcji odbywa się w Chinach i Indiach, a jej głównym zastosowaniem pozostaje barwienie papieru[5].
Zagrożenia
[edytuj | edytuj kod]Międzynarodowa Agencja Badań nad Rakiem sklasyfikowała auraminę jako czynnik grupy 2B, tj. substancję prawdopodobnie rakotwórczą dla człowieka. Nie ma wystarczających badań, które potwierdzałyby rakotwórczość auraminy u ludzi, jednak potwierdzają one rakotwórczość tej substancji u zwierząt. Jednocześnie produkcja auraminy została sklasyfikowana w grupie 1, a więc warunki narażenia podczas pracy przy produkcji auraminy określone zostały jako rakotwórcze dla człowieka[5][13].
Nazewnictwo
[edytuj | edytuj kod]Nazwa „auramina” pochodzi od łac. aurum (złoto) i „amina”, co związane jest z kolorem tej substancji oraz strukturą chemiczną (obecnością grup aminowych)[14]. Auraminą nazywana jest wolna zasada (forma nieprotonowana w postaci iminy), auraminą O zaś jej sól w postaci chlorowodorku iminiowego[5]. W zastosowaniach medycznych i weterynaryjnych, wykorzystujących właściwości antyseptyczne auraminy, stosowana była niegdyś nazwa pyoctaninum aureum[15].
Przypisy
[edytuj | edytuj kod]- ↑ CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 3-30, ISBN 978-1-4987-5429-3 (ang.).
- ↑ a b c d e Auramine hydrochloride, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 510727 [dostęp 2023-09-06] (niem. • ang.).
- ↑ a b R.W. Sabnis, Handbook of Biological Dyes and Stains. Synthesis and Industrial Applications, Hoboken: John Wiley & Sons, [cop. 2010], s. 27, ISBN 978-0-470-40753-0 (ang.).
- ↑ a b Auramina O (C.I. 41000) do mikroskopii [online], karta charakterystyki produktu Sigma-Aldrich, 30 maja 2023, numer katalogowy: 1.04193 [dostęp 2023-09-06]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d e f g h Auramine and Auramine Production, [w:] Some Aromatic Amines, Organic Dyes, and Related Exposures, Lyon: International Agency for Research on Cancer, 2010 (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, t. 99), s. 111–135, ISBN 978-92-832-1299-7 (ang.).
- ↑ R.L.M. Allen, Colour Chemistry, New York: Appleton-Century-Crofts, [cop. 1971] (Studies in Modern Chemistry), s. 104, DOI: 10.1007/978-1-4615-6663-2 (ang.).
- ↑ Robert M. Christie, Colour Chemistry, wyd. 2, Cambridge: Royal Society of Chemistry, [cop. 2015], s. 158–160, ISBN 978-1-84973-328-1 (ang.).
- ↑ a b Edward Gurr, Synthetic Dyes in Biology, Medicine And Chemistry, London–New York: Academic Press, 1971, s. 66–67, ISBN 0-12-309650-2, OCLC 608611711 (ang.).
- ↑ Military Explosives. Department of the Army Technical Manual 9-1300-214, Washington: Department of the Army, 1984, s. 2–11, 10–3, 10–4, OCLC 29010280 (ang.).
- ↑ Amos A. Fries, Clarence J. West, Chemical Warfare, New York: Mc-Graw Hill Book Company, 1921, s. 333, OCLC 570125 (ang.).
- ↑ Piotr Centkowski i inni, Współistnienie ziarnicy złośliwej i gruźlicy w szyjnych węzłach chłonnych, „Onkologia w Praktyce Klinicznej”, 1 (1), 2005, s. 54–58, DOI: 10.5603/ocp.9421.
- ↑ Jia-Chen Tung i inni, Auramine O, an incense smoke ingredient, promotes lung cancer malignancy, „Environmental Toxicology”, 32 (11), 2017, s. 2379–2391, DOI: 10.1002/tox.22451 (ang.).
- ↑ Auramine and Auramine Production, [w:] Chemical Agents and Related Occupations, Lyon: International Agency for Research on Cancer, 2012 (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, t. 100F), s. 101–104, ISBN 978-92-832-1323-9 (ang.).
- ↑ auramine, [w:] Alexander Senning, Elsevier’s Dictionary of Chemoetymology. The Whies and Whences of Chemical Nomenclature and Terminology, Amsterdam: Elsevier, [cop. 2007], s. 35, ISBN 978-0-444-52239-9 (ang.).
- ↑ Fritz Mayer, Chemie der organischen Farbstoffe, Berlin–Heidelberg: Springer, 1921, s. 77, DOI: 10.1007/978-3-662-05535-9 (niem.).



