Arcetamina
| Arcetamina Alerta sobre risco à saúde | |
|---|---|
| |

| |
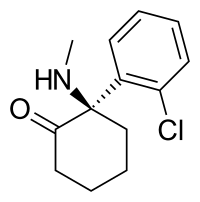
| Nome IUPAC | (R)-2-(2-Chlorophenyl)-2-(methylamino)cyclohexanone |
| Outros nomes | PCN-101, HR-071603 |
| Identificadores | |
| Número CAS | |
| PubChem | |
| SMILES |
|
| Propriedades | |
| Fórmula química | C13H16ClNO |
| Massa molar | 237.72 g mol-1 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Arcetamina (DCB) ou arketamina (DCI, EMA; códigos de desenvolvimento: PCN-101, HR-071603), também conhecida como (R)-cetamina ou (R)-(−)-cetamina, é o enantiômero (R)-(−) da cetamina.[1][2][3] Assim como a cetamina, sua forma racêmica, e a escetamina, o enantiômero S(+) da cetamina, a arcetamina é biologicamente ativa; mas é menos potente como antagonista do receptor NMDA e em seu potencial anestésico, por isso nunca foi aprovada ou comercializada para uso clínico em forma enantiopura.[1][3] A arcetamina está em fase de testes clínicos por suas propriedades antidepressivas.[4][5]
Farmacologia
[editar | editar código-fonte]Comparada à escetamina, a arcetamina possui afinidade de, aproximamdamente, 4 a 5 vezes menor para o sítio de ligação PCP do receptor NMDA.[2][6] A acetamina é menos potente que a cetamina (forma racêmica da droga) e, especialmente, é muito menos potente que a escetamina em termos de efeitos anestésicos, analgésicos e sedativo-hipnóticos.[6]
A cetamina em forma racêmica tem fraca afinidade pelo receptor sigma (σ) onde atua como agonista, enquanto a escetamina se liga de forma insignificante a esse receptor, e assim a atividade do receptor sigma da cetamina racêmica está nligada ao enantiômero da arcetamina.[7] A partir de seu perfil de atividade farmacológica, hipotetiza-se que a arcetamina pode desempenhar um papel nos efeitos alucinógenos da cetamina racêmica e que pode ser responsável pela redução do limiar convulsivo observado com cetamina racêmica.[7] No entanto, estudos subsequentes indicam que a escetamina tem maior probabilidade de induzir eventos dissociativos,[8][9] bem como estudos em pessoas submetidas à terapia eletroconvulsiva sugerem que a escetamina é um potente indutor de convulsões.[10]
A escetamina inibe o transportador de dopamina com potência cerca de 8 vezes mais do que a arcetamina e, portanto, é cerca de 8 vezes mais potente como inibidor da recaptação de dopamina.[11] Arcetamina e escetamina possuem potência semelhante na interação com os receptores muscarínicos de acetilcolina.[12]
Potencial como antidepressivo
[editar | editar código-fonte]Em estudos pré-clínicos, a arcetamina aparenta ser mais eficaz como antidepressivo de ação rápida do que a escetamina.[13]
Em estudos com roedores, a escetamina produziu hiperlocomoção, défice na inibição pré-pulso (PP) e efeitos recompensadores, enquanto a arcetamina, por conta de sua menor potência como antagonista do receptor NMDA e na inibição da recaptação de dopamina, não aparenta demonstrar tais efeitos a nível clinicamente relevante.[14] Com base nesses estudos, é sugerido que a arcetamina tem maior propensão para produzir efeitos psicotomiméticos e um menor potencial de abuso, além de uma eficácia antidepressiva superior.[14]
Um estudo realizado em ratos descobriu que a atividade antidepressiva da cetamina não é causada pelo inibidor NMDAR da cetamina, mas sim pela ativação constante de um receptor de glutamato diferente, o receptor AMPA, pelo metabólito (2R,6R) -hidroxinorcetamina; Até 2017, não existiam evidências de qe esse efeito é reproduzido em humanos.[15][16] A arcetamina é um agonista do receptor AMPA.[17]
De modo oposto, a arcetamina mostra efeitos antidepressivos rápidos maiores e mais duradouros em testes de modelos animais para avaliar o potencial de ação da arcetamina na depressão comparada à escetamina.[13][18][14][19] Tem sido sugerido que isso pode ser devido à possibilidade de diferentes atividades da arcetamina e escetamina e seus respectivos metabólitos no receptor nicotínico alfa-7 (α7), uma vez que a norcetamina e a hidroxinorcetamina são antagonistas potentes desse receptor e possui marcadores de potenciais efeitos antidepressivos rápidos (especificamente, aumentando o efeito de ação da rapamicima em mamíferos); o que estaria estreitamente relacionado com o seu perfil de afinidade de ligação.[20][21][22] No entanto, outros mecanismos também foram propostos, e não há consenso sobre o tema.[14]
Pesquisa médica
[editar | editar código-fonte]Desde novembro de 2019, a arcetamina está em desenvolvimento como tratamento potencncial da depressão pela farmacêutica Perception Neuroscience nos Estados Unidos, sob o código de desenvolvimento PCN-101, e pela Jiangsu Hengrui Medicine na China, sob o código HR-071603.[4][23]
Ver também
[editar | editar código-fonte]Referências
- ↑ a b C.R. Ganellin; David J. Triggle (21 de novembro de 1996). Dictionary of Pharmacological Agents. [S.l.]: CRC Press. pp. 1188–. ISBN 978-0-412-46630-4
- ↑ a b David T. Yew (6 de março de 2015). Ketamine: Use and Abuse. [S.l.]: Taylor & Francis. pp. 269–. ISBN 978-1-4665-8340-5
- ↑ a b Singh, Jaskaran B.; Fedgchin, Maggie; Daly, Ella; Xi, Liwen; Melman, Caroline; De Bruecker, Geert; Tadic, Andre; Sienaert, Pascal; Wiegand, Frank (2015). «Intravenous Esketamine in Adult Treatment-Resistant Depression: A Double-Blind, Double-Randomization, Placebo-Controlled Study». Biological Psychiatry. 80 (6): 424–31. ISSN 0006-3223. PMID 26707087. doi:10.1016/j.biopsych.2015.10.018

- ↑ a b Hashimoto, Kenji (2019). «Rapid‐acting antidepressant ketamine, its metabolites and other candidates: A historical overview and future perspective». Psychiatry and Clinical Neurosciences. 73 (10): 613–627. ISSN 1323-1316. PMC 6851782
 . PMID 31215725. doi:10.1111/pcn.12902
. PMID 31215725. doi:10.1111/pcn.12902
- ↑ «Arketamine - Jiangsu Hengrui Medicine - AdisInsight»
- ↑ a b Paul G. Barash; Bruce F. Cullen; Robert K. Stoelting; Michael Cahalan; M. Christine Stock (28 de março de 2012). Clinical Anesthesia. [S.l.]: Lippincott Williams & Wilkins. pp. 456–. ISBN 978-1-4511-4795-7
- ↑ a b Joris C. Verster; Kathleen Brady; Marc Galanter; Patricia Conrod (6 de julho de 2012). Drug Abuse and Addiction in Medical Illness: Causes, Consequences and Treatment. [S.l.]: Springer Science & Business Media. pp. 205–. ISBN 978-1-4614-3375-0
- ↑ Vollenweider, F.X.; Leenders, K.L.; Øye, I.; Hell, D.; Angst, J. (fevereiro de 1997). «Differential psychopathology and patterns of cerebral glucose utilisation produced by (S)- and (R)-ketamine in healthy volunteers using positron emission tomography (PET)». European Neuropsychopharmacology (em inglês). 7 (1): 25–38. PMID 9088882. doi:10.1016/S0924-977X(96)00042-9
- ↑ Engelhardt, W (1997). «[Recovery and psychomimetic reactions following S-(+)-ketamine].». Anaesthesist. 46: S38-42. PMID 9163277. doi:10.1007/pl00002463
- ↑ Zavorotnyy, Maxim; Kluge, Ina; Ahrens, Kathrin; Wohltmann, Thomas; Köhnlein, Benjamin; Dietsche, Patricia; Dannlowski, Udo; Kircher, Tilo; Konrad, Carsten (dezembro de 2017). «S -ketamine compared to etomidate during electroconvulsive therapy in major depression». European Archives of Psychiatry and Clinical Neuroscience (em inglês). 267 (8): 803–813. ISSN 0940-1334. PMID 28424861. doi:10.1007/s00406-017-0800-3
- ↑ Nishimura M, Sato K (1999). «Ketamine stereoselectively inhibits rat dopamine transporter». Neurosci. Lett. 274 (2): 131–4. PMID 10553955. doi:10.1016/s0304-3940(99)00688-6
- ↑ J. Vuyk; Stefan Schraag (6 de dezembro de 2012). Advances in Modelling and Clinical Application of Intravenous Anaesthesia. [S.l.]: Springer Science & Business Media. pp. 270–. ISBN 978-1-4419-9192-8
- ↑ a b Zhang JC, Li SX, Hashimoto K (2014). «R (-)-ketamine shows greater potency and longer-lasting antidepressant effects than S (+)-ketamine». Pharmacol. Biochem. Behav. 116: 137–41. PMID 24316345. doi:10.1016/j.pbb.2013.11.033
- ↑ a b c d Yang C, Shirayama Y, Zhang JC, Ren Q, Yao W, Ma M, Dong C, Hashimoto K (2015). «R-ketamine: a rapid-onset and sustained antidepressant without psychotomimetic side effects». Transl Psychiatry. 5 (9): e632. PMC 5068814
 . PMID 26327690. doi:10.1038/tp.2015.136
. PMID 26327690. doi:10.1038/tp.2015.136
- ↑ Tyler, Marshall W.; Yourish, Harmony B.; Ionescu, Dawn F.; Haggarty, Stephen J. (21 de abril de 2017). «Classics in Chemical Neuroscience: Ketamine». ACS Chemical Neuroscience. 8 (6): 1122–1134. ISSN 1948-7193. PMID 28418641. doi:10.1021/acschemneuro.7b00074
- ↑ Zanos, Panos; Moaddel, Ruin; Morris, Patrick J.; Georgiou, Polymnia; Fischell, Jonathan; Elmer, Greg I.; Alkondon, Manickavasagom; Yuan, Peixiong; Pribut, Heather J. (2016). «NMDAR inhibition-independent antidepressant actions of ketamine metabolites». Nature. 533 (7604): 481–486. Bibcode:2016Natur.533..481Z. ISSN 0028-0836. PMC 4922311
 . PMID 27144355. doi:10.1038/nature17998
. PMID 27144355. doi:10.1038/nature17998
- ↑ Yang, Chun; Zhou, Wei; Li, Xiaomin; Yang, Jianjun; Szewczyk, Bernadeta; Pałucha-Poniewiera, Agnieszka; Poleszak, Ewa; Pilc, Andrzej; Nowak, Gabriel (2012). «A bright future of researching AMPA receptor agonists for depression treatment». Expert Opinion on Investigational Drugs. 21 (5): 583–585. PMID 22375566. doi:10.1517/13543784.2012.667399
- ↑ Hashimoto, Kenji (2014). «The R-Stereoisomer of Ketamine as an Alternative for Ketamine for Treatment-resistant Major Depression». Clinical Psychopharmacology and Neuroscience. 12 (1): 72–73. ISSN 1738-1088. PMC 4022771
 . PMID 24851126. doi:10.9758/cpn.2014.12.1.72
. PMID 24851126. doi:10.9758/cpn.2014.12.1.72
- ↑ Yang, C; Shirayama, Y; Zhang, J-c; Ren, Q; Yao, W; Ma, M; Dong, C; Hashimoto, K (setembro de 2015). «R-ketamine: a rapid-onset and sustained antidepressant without psychotomimetic side effects». Translational Psychiatry (9): e632. ISSN 2158-3188. PMC 5068814
 . PMID 26327690. doi:10.1038/tp.2015.136. Consultado em 19 de março de 2022
. PMID 26327690. doi:10.1038/tp.2015.136. Consultado em 19 de março de 2022
- ↑ van Velzen, Monique; Dahan, Albert (2014). «Ketamine Metabolomics in the Treatment of Major Depression». Anesthesiology. 121 (1): 4–5. ISSN 0003-3022. PMID 24936919. doi:10.1097/ALN.0000000000000286

- ↑ Paul RK, Singh NS, Khadeer M, Moaddel R, Sanghvi M, Green CE, O'Loughlin K, Torjman MC, Bernier M, Wainer IW (2014). «(R,S)-Ketamine metabolites (R,S)-norketamine and (2S,6S)-hydroxynorketamine increase the mammalian target of rapamycin function». Anesthesiology. 121 (1): 149–59. PMC 4061505
 . PMID 24936922. doi:10.1097/ALN.0000000000000285
. PMID 24936922. doi:10.1097/ALN.0000000000000285
- ↑ Singh NS, Zarate CA, Moaddel R, Bernier M, Wainer IW (2014). «What is hydroxynorketamine and what can it bring to neurotherapeutics?». Expert Rev Neurother. 14 (11): 1239–42. PMC 5990010
 . PMID 25331415. doi:10.1586/14737175.2014.971760
. PMID 25331415. doi:10.1586/14737175.2014.971760
- ↑ «Arketamine - Jiangsu Hengrui Medicine - AdisInsight». adisinsight.springer.com. Consultado em 19 de março de 2022