Carbocátion piramidal

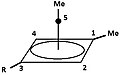
Um carbocátion piramidal é um tipo de carbocátion com uma configuração específica. Este íon existe como uma terceira classe, além dos íons clássicos e não clássicos. Nesses íons, um único átomo de carbono paira sobre um polígono de quatro ou cinco lados, formando uma pirâmide. O íon piramidal de quatro lados carrega uma carga de 1+ e o piramidal de cinco lados carrega 2+. Nas imagens (no canto superior direito), o ponto preto na linha vertical representa o átomo de carbono pairando.
O número aparente de coordenação de cinco, ou mesmo seis, associado ao átomo de carbono no topo da pirâmide é uma raridade em comparação com o máximo habitual de quatro.
História
[editar | editar código-fonte]O estudo desses cátions foi desencadeado, na época, por resultados surpreendentes em química computacional. Ao calcular a geometria ideal do monocátion que surge da extração de cloreto de 3-clorotriciclo[2.1.0.02,5]pentano, esperava-se que as três pontes orientassem no espaço com ângulos de aproximadamente 120°. No entanto, os cálculos mostraram que a pirâmide de quatro lados era a configuração mais estável. No topo desta pirâmide, reside um átomo de carbono, ainda conectado a um hidrogênio. A estrutura original esperada mostrou-se nem perto de um mínimo de energia: representou um máximo.[1]
- Figura 1: Diversas possibilidades para o cátion (CH) 5

- 1a situação inicial nos cálculos: o íon cloreto apenas à esquerda.
- 1b a estrutura esperada. A carga foi deslocalizada em três átomos de carbono
- 1c representação do íon piramidal.
Dependendo do método utilizado, o íon 1c na figura 1 é um mínimo absoluto ou apenas um valor relativo.
Bases teóricas
[editar | editar código-fonte]Uma discussão teórica completa usará todos os orbitais de todos os átomos contribuintes. Uma primeira aproximação pode usar um LCAO dos orbitais moleculares no polígono, formando a base da pirâmide e os orbitais do átomo apical, como o átomo de carbono no topo da pirâmide. Essa aproximação fornecerá informações sobre a estabilidade intrínseca das estruturas.
Átomo de carbono apical
[editar | editar código-fonte]O átomo de carbono apical está conectado a apenas um outro substituinte, portanto, é esperada uma hibridação sp. O substituinte será orientado para cima. Para o polígono básico, três orbitais estão disponíveis:
- O segundo sp-orbital. Este orbital é relativamente baixo em energia devido à contribuição do s-orbital. Com relação aos planos nodais nos orbitais p restantes, a simetria desse orbital pode ser escrita como SxSy,[2] simétrica em relação a ambos os planos. O orbital possui uma energia bastante baixa, em termos do método de Hückel, seu valor não é fácil de estimar, embora seja menor que α, pois o orbital terá um caráter s considerável.
- Dois orbitais p. Esses orbitais têm um conteúdo energético mais alto que o orbital sp. Em termos do método de Huckel, a energia será α. Em termos de simetria, esses orbitais são ortogonais, descritos como AxSy e SxAy[2]
Base da pirâmide
[editar | editar código-fonte]| Figura 2: Orbitais do átomo de carbono apical (acima) e os MOs da base (abaixo)[2] |
 |
| Figura 3: Interação entre os orbitais apical e basal. O "A" no topo é carbono apical, "P" indica a estrutura piramidal, "B" é para a parte basal da pirâmide. |
 |
A aproximação para a base da pirâmide é um anel fechado de átomos de carbono, todos eles sp2 hibridadas. Os resultados exatos dependem do tamanho do anel; conclusões gerais podem ser formuladas como:
- O orbital molecular mais baixo tem, observado desde o ápice da pirâmide, nenhum plano nodal. A simetria será SxSy.[2] No método de Hückel, sua energia é (α - 2β)
- O próximo nível de energia é ocupado por dois orbitais degenerados. Em termos de simetria, eles são escritos como SxAy e AxSy.[2] A energia depende do tamanho do anel:
| tamanho do anel | nível de energia |
|---|---|
| 3 | (α + β) |
| 4 | α |
| 5 | (α - 0,618β) |
| 6 | (α - β) |
- Dependendo do tamanho da base, haverá outros MOs, mas eles são irrelevantes para a presente discussão.
Interação entre ápice e base
[editar | editar código-fonte]Para obter interações de ligação entre átomos ou partes de moléculas, duas condições devem ser atendidas:
- Os orbitais a serem combinados devem ter a mesma simetria.
- Uma menor diferença de energia entre os orbitais combinados produzirá um maior efeito estabilizador.
Os orbitais no carbono apical e no polígono básico são capazes de combinar com suas simetrias. O resultado será uma configuração mais estável para as pirâmides. Na figura 2, os aspectos de simetria estão representados.
- O orbital sp apical combina com o MO mais baixo do anel básico para uma ligação baixa e um orbital anti-ligação alto.
- Os dois orbitais p apicais combinam-se com os segundos níveis mais baixos de energia no anel básico. Dois orbitais de ligação e dois anti-ligação resultam. A Figura 3 é uma representação gráfica dos resultados.
O preenchimento dos orbitais atômicos e moleculares em estruturas piramidais de diferentes tamanhos de base leva à tabela a seguir. Apenas os orbitais de ligação são contabilizados.
| n=3
(trigonal) |
n=4
(quadrado) |
n=5
(pentagonal) |
n=6
(hexagonal) | |||||
|---|---|---|---|---|---|---|---|---|
| orbitais | carga | orbitais | carga | orbitais | carga | orbitais | carga | |
| orbitais 1s em carbono | 4 | −8 | 5 | −10 | 6 | −12 | 7 | −14 |
| ligação σ entre o hidrogênio e o carbono apical | 1 | −2 | 1 | −2 | 1 | −2 | 1 | −2 |
| ligação σ entre o hidrogênio e o carbono básico | 3 | –6 | 4 | –8 | 5 | 10 | 6 | –12 |
| ligação σ entre carbonos básicos | 3 | –6 | 4 | –8 | 5 | –10 | 6 | –12 |
| MO entre o apical e o orbital básico mais baixo | 1 | –2 | 1 | –2 | 1 | –2 | 1 | –2 |
| MO entre os orbitais básicos apical e segundo menor | 2 | –4 | 2 | –4 | 2 | –4 | 2 | –4 |
| número total de elétrons | –28 | –34 | –40 | –46 | ||||
| carga nuclear total: (n+1)*(C+H)=(n+1)*(6+1) | +28 | +35 | +42 | +49 | ||||
| Encargo líquido da estrutura | 0 | 1+ | 2+ | 3+ | ||||
No caso da pirâmide de três lados, claramente nenhum resultado de íons; surge uma espécie neutra conhecida: tetrahedrane. Para esta molécula, esse modo de descrição é uma descrição mecânica quântica alternativa.
As outras estruturas piramidais serão carregadas em relação ao tamanho da base.
Exemplos
[editar | editar código-fonte]Monocátion
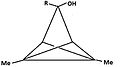
[editar | editar código-fonte]- Figura 4: Um número de derivados de triclo[3,1,0,02,4]pentano (TCP) levando ao mesmo cátion piramidal. O átomo de carbono que transporta o grupo lábil se torna básico, enquanto o carbono na posição anti se torna apical. O grupo "R" é 1H ou 2H (D):
-
4a: 3-hidroxi-1,4-dimetil-TCP
-
4b: 3-hidroxi-1,5-dimetil-TCP
-
4c: 3-metoxi-3,5-dimetil-TCP
-
4d: carbocátion resultante
Em 1972, Masamune descreve os resultados da dissolução de vários precursores para 4d (figura 4) a - 70°C. em superácido (uma mistura de SO2ClF e FSO3H). Com base no espectro 13C e 1H-NMR, a evidência é clara: em cada caso, o mesmo intermediário é formado. Além disso, quando o meio superácido é destruído, com metanol ou ácido benzóico, o mesmo produto é formado. (veja: Reação... abaixo).[3]
| Tabela 2: Dados de RMN do íon 1,5-dimetila-piramidal (em relação a TMS = 0)[4] | |||
|---|---|---|---|
| grupo/átomo ( ! ) | 13C | 1H | |
| 1 1 | 93,56 | - | 
|
| 2/4 | 73,00 | 4,62 | |
| 3 (se R = 1H) | 60,97 | 4,68 | |
| 5 | -23.04 | - | |
| Metila a 1 | 7,45 | 2,15 | |
| Metila a 5 | -1,03 | 1,84 | |
| ( ! ) Nesta tabela átomos de carbono são chamados, em 1H-RMN o sinal do hidrogênio transportada pelos chamados carbonos estão representados | |||
- A atribuição no espectro de hidrogênio está parcialmente na intensidade (hidrogênio no anel básico) parcialmente na experiência comum dos hidrogênio no lado externo de um sistema conjugado circular tem sinais em ppm mais altos em relação ao TMS, enquanto aqueles posicionados sobre o anel terão menor, mesmo negativos, sinais relativos ao TMS.
- A atribuição em 13C-RMN segue as mesmas considerações que para 1H. Embora na RMN do carbono a intensidade seja um mau guia para o número de átomos, no anel básico os carbonos não substituídos são semelhantes o suficiente para usar a intensidade como indicação de seu número. Uma ferramenta poderosa também é a multiplicidade do sinal de carbono devido ao acoplamento com os hidrogênios ligados ao carbono.
- O próprio Masamune não afirma nada sobre a natureza do íon intermediário.[5] No entanto, com base nas regras formuladas por Olah,[6] ele é capaz de descartar cátions localizados (como 1-butila) ou deslocalizados (como alila). Para esses íons, são esperados cerca de 200 ppm.
Reação com metanol e ácido benzóico
[editar | editar código-fonte]- Figura 5: Produtos de desreação do cátion dimetila piramidal com metanol e ácido benzóico. O grupo "R" é 1H ou 2H (D):
-
5a = 4d Cátion piramidal
-
5b Produto de reação com ácido benzóico em solvente aprótico diploar
-
5c produto de reação com metanol em metanol
Como descrito acima, independente da sua rota sintética, o íon piramidal 5a reage com metanol ou benzoato, dando origem a produtos governados pelo reagente e ao meio de reação, como é evidente pelos padrões de substituição. Em 1972, Masamune[3][4] é incapaz de explicar o comportamento diferente do intermediário. Em termos da teoria HSAB, uma explicação pode ser dada.
Em 1975, Masamune calculou[7] no íon não substituído a maior parte da carga nos átomos de hidrogênio. Substituindo hidrogênio por carbono, o átomo central do grupo metil, um substituinte mais eletronegativo (2,5 versus 2,1 na escala de Pauling) concentrará a carga no carbono esquelético. Essa concentração de carga tem vários efeitos:
- A reação com benzoato é governada por interações π - π. A degeneração no sistema MO básico será perdida. Como o lado apical é inacessível, o benzoato se aproxima do lado inferior da pirâmide. A interação entre os dois sistemas π, ambos perturbados em um ponto, forçará uma orientação específica. A orientação na qual a interação entre a carga positiva gerada pelo grupo metil na pirâmide e a carga adjacente ao grupo carboxila direcionará o sistema a uma reação do grupo carboxila com o carbono 2 ou 4 da base da pirâmide. Quando a reação com benzoato ocorre no carbono, duas pontes se formam entre o carbono apical e os átomos 1 e 3. Também se formará uma ligação entre o anti- carbono 4 e o ápice. A reação no carbono 4 terá o mesmo efeito, embora a molécula resultante tenha uma relação de espelho em relação à molécula que resulta da reação na posição 2.
- A reação com metanol é acionada por carga. No sistema básico, um centro identificável de carga positiva está presente no carbono que transporta o grupo metil. O metanol, com sua base rígida em oxigênio, reagirá no centro da positividade. O grupo metoxila aparece no carbono 1, forçando a formação de pontes entre o carbono 2 e 4 até o ápice, bem como entre o agora anti-carbono 3.
Bis-homo monocarbocátion
[editar | editar código-fonte]Em química, o prefixo "homo" designa um homólogo, um composto da mesma forma contendo um, ou, como neste caso dois, adicionais grupos CH2. O aspecto comum dos íons bis-homo é a posse de um anel 1,4-ciclohexadieno em vez de um anel ciclobutadieno.
-
Pontes entre os homoátomos bis-homo-carbocátion
-
Os planos que contêm os átomos com sp2 hibridados e aqueles átomos ligados a eles
-
Desbridamento da carbocondução bis-homo
A estabilidade desse íon a princípio pode parecer estranha, pois o aumento do anel geralmente diminui a sobreposição de ligações entre os orbitais no centro da estrutura piramidal. Aqui, a hibridização sp2 e, consequentemente, a planaridade dos átomos de e aqueles diretamente ligado ao centro de sp2, força os topos das orbitais p dos carbonos basais em relação um ao outro, criando, assim, uma base sólida para o carbono apical sente-se. O reforço da configuração por uma ponte entre os homo-átomos, convertendo a base da pirâmide em um norbornadieno, cria uma estrutura ainda mais estável.
Dicátion
[editar | editar código-fonte]De acordo com os resultados apresentados na Tabela 1, um carbocátion piramidal de cinco lados será divalente. Isso é confirmado pelo trabalho teórico[8] e prático de Hogeveen.[9][10] Em contraste com o monocátion, que é descrito com vários padrões de substituição, o dicátion é estudado principalmente por sua hexametila derivada. A síntese começa no hexametileno benzeno de Dewar (composto I na tabela 4) reagindo com Cl2 em 5,6-dicloro-1,2,3,4,5,6-hexametilbiciclo [2.1.1] hex-2-eno (composto II na tabela 4). A dissolução deste composto em ácido fluorossulfônico dá origem ao dicátion (estrutura III na tabela 4).
| Tabela 4: Via sintética para o cátion piramidal divalente | ||

|

|

|
| I: Me6 - benzeno de Dewar | II: Produto da reação do benzeno de Dewar Me6 com cloro | III: o dicátion piramidal |
A presença de um íon piramidal na solução de ácido fluorossulfónico é evidenciado pelo 1H- e o espectro 13C-RMN (Tabela 5).
| Tabela 5: Dados de RMN da dicação piramidal. | |||
|---|---|---|---|
| Intensidade | 1H | 13CSinguleto | 13CQuarteto |
| 1 | 1,96 (s) | 22,5 | -2,0 |
| 5 | 2,65 (s) | 126,3 | 10,6 |
A atribuição dos sinais é baseada em suas intensidades e multiplicidades. A atribuição da estrutura piramidal baseia-se na simplicidade observada dos espectros: cinco iguais C-CH 3 grupos combinados com um excelente grupo C-CH3. A única maneira de construir uma entidade molecular a partir desses dados é uma pirâmide de cinco lados. Os equilíbrios rápidos entre carbocátions degenerados clássicos ou não clássicos são descartados, pois a posição dos sinais não corresponde aos valores esperados para esse tipo de estrutura.[8]
A estrutura cristalina de [C6(CH3)6]2+ (SbF6-)2 • HSO3 F foi obtida em 2017. Embora o átomo de carbono apical seja hexacoordenado, a regra da tetravalência do carbono ainda é cumprida. Enquanto o C-CH3 comprimento de ligação de 1,479 (3) Å é típico para uma ligação simples CC, os outros cinco distâncias CC muito longas de 1,694 (2) -1,715 (3) Å indicam uma ordem de ligação de <1.[11]
| Figura 6: Reações do carbodicátion piramidal |
|---|
 |
|
As reações do dicátion se dividem em três grupos:[9][10]
- Reações térmicas A dicação substituída com hexametil é uma estrutura estável até 40 °C (104 °F). Acima dessa temperatura ocorre a reação: um íon hidreto é absorvido, seguido de um rearranjo irreversível para um complexo de Meisenheimer que é estável no meio de ácido fluorossulfônico (veja: Figura 6, reação superior).
- Os nucleófilos carregados (hidreto, metóxido, hidróxido) reagem de maneira reversível, levando, independentemente do nucleofile em questão, a derivados idênticos de triciclo [3.1.0.03,6] hexano substituídos em 2,4 idênticos, por exemplo: com metóxido: 2,4-dimetoxi -triciclo [3.1.0.03,6]hexano é formado (veja: Figura 6, caminho de reação do meio).
- Os nucleófilos não carregados (aminas como trietilamina) atuam como base, extraindo reversivelmente dois hidrogênios do íon, produzindo com efeito um derivado de dimetileno do benzvaleno (veja: Figura 6, reação mais baixa).
Outros padrões de substituição nos dicátions
[editar | editar código-fonte]O produto da reação do dicátion com trietilamina oferece um caminho para outros padrões de substituição, em seguida a hexametila.[12] Uma ou ambas as ligações duplas são oxidadas para uma cetona. A cetona é então reagida com um composto organometálico produzindo um hidróxido alquilado. Os compostos formados desta maneira possuem um ou dois outros grupos alquil, dependendo do número de ligações duplas oxidadas. Quando os álcoois são dissolvidos em ácido fluorossulfônico, eles novamente dão origem a novas dicações piramidais. Ambos os grupos não metílicos ocupam posições basais. Outra posição no esqueleto piramidal ainda carrega um grupo metil. Tabela 6 resume esses achados.
Até este ponto, o padrão de substituição do íon piramidal divalente é de menor importância para seu comportamento. Uma clara diferença surge quando a estabilidade térmica se os íons do tipo V (Tabela 6) é estudada: at −40 °C (−40 °F) o íon apical substituído por etil é estável por 48 horas, enquanto que nenhum vestígio do íon apical isopropil é mais detectável.
Íons tervalentes e superiores
[editar | editar código-fonte]Na época da pesquisa bibliográfica (final de 1978), não havia relatos de cátions piramidais tervalentes ou superiores.
Referências
- ↑ Stohrer. «Bond-stretch isomerism and polytopal rearrangements in (CH)5+, (CH)5-, and (CH)4CO». J. Am. Chem. Soc. 94: 1661–1668. doi:10.1021/ja00760a039
- ↑ a b c d e S indica que o orbital é simétrico em relação ao plano indicado pelo subscrito.
- ↑ a b Masamune. «Nature of the (CH)5+ species. I. Solvolysis of 1,5-dimethyltricyclo[2.1.0.02,5]pent-3-yl benzoate». J. Am. Chem. Soc. 94: 8955–8956. doi:10.1021/ja00780a078
- ↑ a b S. Masamune. «Nature of the (CH)5+ species. II. Direct observation of the carbonium ion of 3-hydroxyhomotetrahedrane derivatives». J. Am. Chem. Soc. 94. doi:10.1021/ja00780a079
- ↑ Embora Masamune apresente seus resultados práticos no final do mesmo ano que Stöhrer e Hoffmann, seus teóricos, é improvável que Masamune tenha conseguido editar seu trabalho no momento em que as implicações do trabalho teórico se tornaram claras.
- ↑ Olah. «The α, 1-dimethylcyclopropylcarbinyl cation». Tetrahedron Letters. 19: 4779–4782. doi:10.1016/s0040-4039(01)85729-4
- ↑ Masamune. «Some aspects of strained systems. [4]Annulene and its CH+ adduct». Pure and Applied Chemistry. 44: 861–884. doi:10.1351/pac197544040861
- ↑ a b «Electronic spectra of pyramidal dications, (CCH3)62+ and (CCH)62+». Tetrahedron Letters. 15: 4351–4354. 1974. doi:10.1016/S0040-4039(01)92161-6
- ↑ a b Hogeveen (1974). «Chemistry and spectroscopy in strongly acidic solutions. XL. (CCH3)62+, an unusual dication». Journal of the American Chemical Society. 96: 2208–2214. doi:10.1021/ja00814a034
- ↑ a b Hogeveen (1973). «Direct observation of a remarkably stable dication of unusual structure: (CCH3)62⊕». Tetrahedron Letters. 14: 1665–1670. doi:10.1016/S0040-4039(01)96023-X
- ↑ Malischewski. «Crystal Structure Determination of the Pentagonal-Pyramidal Hexamethylbenzene Dication C6(CH3)6 2+». Angewandte Chemie International Edition (em inglês). 56: 368–370. ISSN 1433-7851. PMID 27885766. doi:10.1002/anie.201608795
- ↑ G. Giordano. «Pyramidal dications. Introduction of basal and apical substituents». J. Am. Chem. Soc. 99: 5181–5183. doi:10.1021/ja00457a050