Carboxipeptidase A

Carboxipeptidase A geralmente se refere à pancreática exopeptidase que hidrolisa ligações peptídicas de resíduos C-terminais com aromáticos ou alifáticos cadeia lateral. A maioria dos cientistas da área agora se refere a essa enzima como CPA1, e a uma carboxipeptidase pancreática relacionada como CPA2.
Caracteristicas gerais
[editar | editar código-fonte]As carboxipeptidases pertencem as exopeptidases e podem ser encontradas nas formas A e B dependendo do mecanismo de atuação das mesmas.[1] Elas são responsáveis por catalisarem a remoção de ácidos carboxílicos terminais em proteínas. A carboxipeptidase A bovina foi a terceira proteína a ter sua estrutura tridimensional resolvida. Em sua estrutura o sítio ativo do zinco está ligado aos aminonácidos His- 69, Glu- 72, His- 196 e a uma molécula de água e geometria resultante é tetraédrica.[2]
Em estudos computacionais recentes, o mecanismo de catálise é semelhante, mas a diferença de mecanismo é que a molécula de água desprotonada se liga ao carbono da carbonila, enquanto o grupo hidroxila permanece coordenado ao zinco. Em seguida, ocorre a proteólise e a molécula de água é então introduzida de volta no sítio ativo para coordenar o zinco.[3]
A carboxipeptase A é uma enzima digestiva que promovem a quebra de carbono terminais em grande cadeias aromáticas Semelhante a Anidrase carbônica, seus sítios ativos possuem o Zinco em estado de oxidação (II).[4]
Mecanismo
[editar | editar código-fonte]O zinco metálico se comporta como um ácido de Lewis que por sua vez estabiliza uma molécula de água que está coordenada a ele e é um dos principais responsáveis por estabilizar os intermediários negativos durante o prosseguimento da reação. O processo de estabilização da molécula de água ocorre por resíduos polares que estão próximo ao sítio ativo que ajudam a estabilizar uma ligação de hidrogênio. [5]
Estudos realizados a baixa temperatura demostraram que os peptídeos e os esteres são hidrolisados através de um mecanismo simplificado representado por E + S ⇌ ES1 ⇌ ES2 ⇌ E + P (E- Enzima, S- substrato, ES- complexo enzima substrato, P-produto).[5] Estudos cinéticos sugeriram que os substratos se coordenam com o íon metálico antes da etapa determinante da velocidade da reação, e assim os intermediários dessas reações possuem estruturas distintas. Nessas reações existem propostas que são distintas e notavelmente diferentes para os substratos, porém sugere-se que isso aconteça graças a papeis diferentes estabelecidos para o zinco e o grupo Arg-127 na estrutura da proteína.[5]
Um caracteristica interessante da enzima Carboxipeptiase A é que mesma não possue grandes desvios cinéticos quanto a cinética de Michaelis-Menten, e exibem valores de constante catalítica (Kcat) próximas a 10-2 s1 para peptídeos e 103 s-1 para ésteres.[5][3]

O sitio ativo da enzima conhecido como S1 e S1' (Fig.1) é o locus da catalise. O S1' é um local essencialmente hidrofóbico e possui um grupo Tyr-248 como uma “capa” para esse local um vez que o substrato for ligado esse local é um dos principais responsáveis pela preferência de cadeias aromáticas e alifáticas[5][3]. Uma interação que foi relatada de grande importância para a catálise consiste na interação do grupo Arg- 127 que interagem em conjunto com o ácido carboxílico terminal e o oxigênio da cadeia peptídica que está coordenada ao zinco.[3]
Os estudos cristalográficos da enzima mostram a existência de cinco subsítios alostéricos que estão envolvidos na criação especifica ligante-enzima que é observada na maioria das enzimas bioativas. Um desses subsítios induz uma mudança conformacional importante na Tyr-248 que ocorre após a ligação do substrato ao sítio ativo da enzima. Os modelos a formação de duas ligações de hidrogênio na interação enzima-substrato, uma entre o hidroxil fenólico da tirosina com o carboxilato terminal do ligante, e a outra, é constituída entre a tirosina e a ligação peptídica com os substratos peptídicos mais longos. Essas mudanças que são observadas caracterizam uma propriedade importante observada na CPA que está ligada a força existente entre a ligação entre a enzima e o substrato.
Atualmente Existem dois mecanismos hipotéticos propostos para a ação catalítica da carboxipeptidase como observado. Uma conhecida como via da água, onde uma etapa inicial de uma adição nucleofilica, onde a água ligada ao zinco promove um ataque ao carbono da carboxila e depois promove a transferência de próton da água para o oxigênio do carboxilato. Logo em seguida ele promove uma eliminação atuando como um ácido e promovendo a transferência do próton para o nitrogênio.[1] O segundo mecanismo proposto, demostra um ataque direto a carbonila pelo Glu (270), o que resulta em um intermediário da Acil-enzima.[1]
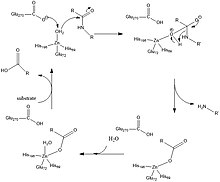
Segundo estudos, os ions vizinhos que são carregados positivamente e estão ligados ao Zi (II) diminuem o pKa da água no lugar de polarizar o grupo carbonil que está ligado o que promoveria efeito inverso na água aumentando seu pKa, no lugar disso, o que é observado é carbonila promovendo uma interação com o grupo arginina (127) que promove uma estabilização das cargas negativas (Fig 2).[4] Logo em seguida o hidróxido que está ligado ao zinco ataca a amida e o Zi (II) proporciona a estabilização eletrostática ao estado de transição e nesse momento os resíduos de aminoácidos de Arg também ajudam nessa estabilização.[4] O metal zinco é rico em elétrons devido ao seu ligante glutamina (Glu- 72) que antes da interação enzima-substrato se coordena de forma bidentada e posteriormente muda essa conformação para monodentada, um resultado dessa interação é que o zinco não é capaz de desprotonar a água para formar um nucleófilo hidroxila. (Fig 2) [6]
Os ligantes Glu-270 e Arg-127 desempenham um importante papel no processo catalítico da CPA, assim como pode ser observado na Fig. 2, eles atuam na estabilização da carbonila do substrato que por sua vez está ligado ao grupo amino. Concomitantemente, ocorre a desprotonação da molécula de água que está ligado ao centro metálico da enzima peplo resíduo de aminoácido Glu-270 e ainda promove uma interação com a carbonila estabilizada pelo Arg-127. Nesse contexto, observa-se o intermediário observado na fig.2 onde temos um oxigênio carregado coordenado ao zinco, assim observa-se interações desfavoráveis que ocorre entre o resíduo Glu-270 o que facilita a liberação do produto ao final do processo catalítico. [6]
Referências
- ↑ a b c Robert R. Crichton, Biolgical Inorganic Chemistry a New Introduction to molecular Struture and Function, p. 233,Elsevier, 2012
- ↑ 1
- ↑ a b c d Valdez CE, Morgenstern A, Eberhart ME, Alexandrova AN (novembro de 2016). «Predictive methods for computational metalloenzyme redesign - a test case with carboxypeptidase A». Physical Chemistry Chemical Physics. 18 (46): 31744–31756. Bibcode:2016PCCP...1831744V. PMID 27841396. doi:10.1039/c6cp02247b
- ↑ a b c Ivano Bertini e colaboradores, Biological Inorganic Chemistry Structure and Reactivity, UNIVERSITY SCIENCE BOOKS, 2007
- ↑ a b c d e William N. Lipscomb, Carboxypeptidase A, American Chemical Society, pp62-69, 1989
- ↑ a b Christianson, D., W., and Lipscomb, W., N. (1989) Carboxypeptidase A. American Chemical Society, Vol (22): 62-69.
