Coloração de Romanowsky
A coloração de Romanowsky é uma técnica de coloração protótipo que foi a precursora de vários métodos distintos mas similares, incluindo a coloração de Giemsa, a coloração de Jenner, a de Wright, a de Field e a de Leishman, que são usadas para diferenciar as células em amostras patológicas. Foi nomeado em homenagem ao médico russo Dmitri Leonidovich Romanowsky (1861-1921), que a inventou em 1875.[1][2][3][4][5][6]
É uma técnica de coloração que encontra aplicação no diagnóstico em linfonodos.[7][8]
Exame microscópico de esfregaços de sangue corados
[editar | editar código-fonte]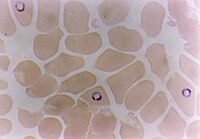
[9]Hempelmann E, Tesarowicz I, Oleksyn BJ (2008). </ref>
Paul Ehrlich tinha usado misturas de corantes ácidos e básicos para esta finalidade em 1879, por exemplo: fucsina (corante ácido) e azul de metileno (corante básico).[10] Em 1891, Romanowsky[11][12][13] desenvolveu técnicas utilizando uma mistura de eosina Y e azul de metileno modificado que produziu um matiz surpreendente não atribuível a qualquer componente de coloração: uma bela sombra característica de roxo. Na solução envelhecida (após dias do preparo do corante), o azul de metileno se oxida em gradações diferentes, originando os azures de metileno.[14][15] Os requisito para a ocorrência do efeito de Romanowsky-Giemsa são:
- Um corante catiônico: o melhor corante é Azure B e, embora Azure A dê a cor roxa nuclear, o azul citoplasmático é inferior. Nenhum outro corante catiónico, tal como o azul de metileno é adequado.[3]
- Um corante aniônico: Mais comumente a eosina Y é usada.[16]
Uma vez que as soluções aquosas de corante são instáveis, o metanol foi introduzido como um solvente, e William Boog Leishman [17] e James Homer Wright [18] defenderam seu uso como um fixador antes da coloração. Gustav Giemsa melhorou esta técnica, padronizando as soluções corantes e adicionando glicerol para aumentar a estabilidade.[19]
A desmetilação de azul de metileno em solução aquosa, utilizando calor e alcalino produz uma mistura de Azure A, Azure B, violeta de metileno, e azul de metileno. Eosina Y é então adicionada para produzir um corante de "ponto morto". O precipitado é então dissolvido numa mistura de metanol e glicerol, para formar uma solução de reserva; esta é diluída com água ou um tampão aquoso para formar uma solução 'de trabalho' que é utilizada na coloração de espécimes de patologia. A solução 'trabalho' é estável durante 3 horas.[20]
Procedimentos de captura imunocromatográficos (testes rápidos de diagnóstico, tais como os testes de detecção de antígeno da malária) são opções de diagnóstico não-microscópicas para o laboratório que podem não ter experiência microscopia apropriado disponível.[21]
Colorações características obtidas
[editar | editar código-fonte]Diferentes componentes celulares e as colorações características obtidas com corante de Romanowsky:[22]
| Componente celular | Cor |
|---|---|
| Cromatina incluindo os corpúsculos de Howell-Jolly | Púrpura |
| Grânulos promielocíticos e bastões de Auer | Vermelho-purpúreo |
| Citoplasma dos linfócitos | Azul |
| Citoplasma dos monócitos | Azul-acinzentado |
| Citoplasma rico em RNA (i.e., citoplasma basófilo) | Azul-escuro |
| Corpúsculos de Döhle | Azul-acinzentado |
| Grânulos específicos dos neutrófilos, grânulos dos linfócitos, granulômero das plaquetas | Púrpura-claro ou cor-de-rosa |
| Grânulos específicos dos basófilos | Púrpura-escuro |
| Grânulos específicos dos eosinófilos | Laranja |
| Eritrócitos | Cor-de-rosa |
Método de coloração dos espécimes
[editar | editar código-fonte]- Etapa de fixação: a preparação a ser corada deverá ser previamente fixada, sendo o fixador rotineiramente mais usado em hematologia, o metanol, que deve ser aplicado sobre a lâmina um período de tempo de 1 a 3 minutos.
- Aplicação do corante: a solução de corante, preparada em solução alcoólica, é aplicado em gotas sobre a lâmina, pelo mesmo período de tempo em que foi realizada a fixação.
- Coloração propriamente dita: adicionando-se água tamponada (chamada no meio de "água de coloração"), a pH 7, ou água destilada, recentemente fervida, sobre o corante, o que ioniza os sais contidos na solução.
- Lavagem do espécime: após a coloração, as lâminas são lavadas sob jato de água corrente e em seguida procede-se a uma secagem ao ar.
Uma formulação de água tamporada ("água de coloração"), com pH regulado a 7,0 é:
- Fosfato diácido de potássio (fosfato monopotássico, KH2PO4) 1 grama
- Fosfato monoácido de sódio (fosfato dissódico, Na2HPO4) 3 gramas
- Água destilada 1000 mL.
Comportamentos em determinadas aplicações
[editar | editar código-fonte]É observado que a heparina frequentemente provoca alterações de nuances de coloração quando da aplicação da solução corante de Romanowsky, promovendo a formação de halos róseos em volta dos leucócitos somando causar aglutinação de heterófilos, tendo como consequência um aumento do espalhamento da população destas células, quando comparados com a homogeineidade das mesmas se em meio contendo citrato.[23][24]
Pode ser usado assim como o corante panótico rápido, em citologia de células presentes no escarro.[25]
A coloração de Romanowsky encontra aplicação no diagnóstico citopatológico de lesões da tiróide,[26][27] e mastócitos em mastocitomas de mamíferos como cães, por exemplo.[28]
É utilizado na citologia de células-tronco de medula óssea,[29] e no hemograma de mamíferos como equinos,[30][31] assim como eritograma e leucograma de aves como a ema.[32]
Permite a contagem de leucócitos em répteis, como quelônios,[33] assim como em peixes.[34]
Visando a caracterização e contagem dos leucócitos, por processamento de imagens, a partir de alterações, desenvolve-se corantes de fase única que coram diferenciadamente os leucócitos em meio líquido.[35]
Os corantes de Romanowsky, mesmo sendo amplamente empregados na rotina laboratorial para a coloração de extensões sanguíneas (esfregaços), evidenciam os reticulócitos apenas através de leve basofilia, não permitindo a sua quantificação de forma precisa.[36]
Ver também
[editar | editar código-fonte]Referências
- ↑ R. W. Fairbrother, Geoffrey A. Taylor; A Text-Book of Bacteriology; Butterworth-Heinemann, 2014. pg 476
- ↑ Harsh Mohan; Pathology Practical Book; JP Medical Ltd, 2012. pg 202
- ↑ a b Horobin RW; How Romanowsky stains work and why they remain valuable - including a proposed universal Romanowsky staining mechanism and a rational troubleshooting scheme. Biotech Histochem. 2011 Feb;86(1):36-51. doi: 10.3109/10520295.2010.515491.
- ↑ Bhupesh Bagulkar, Minal Chaudhary; Romanowsky Stains: Handbook on Romanowsky Stain Family for Hematology; LAP Lambert Academic Publishing, 2012.
- ↑ Gary W. Gill; Cytopreparation - Chapter Romanowsky Stains; Volume 12 of the series Essentials in Cytopathology pp 217-225, 2012.
- ↑ Paulo Henrique da Silva, Hemerson Bertassoni Alves, Samuel Ricardo Comar, Railson Henneberg, Júlio Cezar Merlin, Sérvio Túlio Stinghen; Hematologia Laboratorial: Teoria e Procedimentos; Artmed Editora, 2015.
- ↑ Paolo Gattuso, Vijaya B. Reddy, Shahla Masood; Differential Diagnosis in Cytopathology Book and Online Bundle; Cambridge University Press, 2014. pg 400
- ↑ Marcio Antônio Batistela Moreira, et al; Aplicação da técnica de imunofluorescência direta para o diagnóstico da leishmaniose visceral canina em aspirado de linfonodo [2002]; Brazilian Journal of Veterinary Research and Animal Science.
- ↑ Hempelmann E, Tesarowicz I, Oleksyn BJ (2008). «Malaria wciąż groźna». Wszechświat. 109: 180–189
- ↑ Ehrlich P (1880). «Methodologische Beiträge zur Physiologie und Pathologie der verschiedenen Formen der Leukocyten» (PDF). Z klin Med. 1: 553–560. Consultado em 2 de janeiro de 2016. Arquivado do original (PDF) em 19 de julho de 2011
- ↑ Романовскiй Д.Л. (1890). "Къ вопросу о строенiи чужеядныхъ малярiи". Врачъ 52: 1171–1173.
- ↑ Романовскiй Д.Л. Къ вопросу о паразитологiи и терапiи болотной лихорадки. Диссертацiя на степень доктора медицины. Спб. 1891 г., 118 с.
- ↑ Romanowsky D (1891). «Zur Frage der Parasitologie und Therapie der Malaria». St Petersburg Med Wochenschr. 16: 297–302, 307–315
- ↑ Horobin RW, Walter KJ (1987). «Understanding Romanowsky staining. I: The Romanowsky-Giemsa effect in blood smears». Histochemistry. 86 (3): 331–336. PMID 2437082. doi:10.1007/bf00490267
- ↑ Woronzoff-Dashkoff KK. (2002). «The wright-giemsa stain. Secrets revealed». Clin Lab Med. 22 (1): 15–23. PMID 11933573. doi:10.1016/S0272-2712(03)00065-9
- ↑ Wittekind D (1979). «On the nature of Romanowsky dyes and the Romanowsky-Giemsa effect». Clin Lab Haematol. 1 (4): 247–262. PMID 94558. doi:10.1111/j.1365-2257.1979.tb01090.x
- ↑ Leishman W (1901). «Note on a Simple and Rapid Method of Producing Romanowsky Staining in Malarial and other Blood Films». Br Med J. 2 (2125): 757–758. PMC 2507168
 . PMID 20759810. doi:10.1136/bmj.2.2125.757
. PMID 20759810. doi:10.1136/bmj.2.2125.757
- ↑ Wright JH (1902). «A Rapid Method for the Differential Staining of Blood Films and Malarial Parasites». J Med Res. 7 (1): 138–144. PMC 2105822
 . PMID 19971449
. PMID 19971449
- ↑ Giemsa G (1904). «Eine Vereinfachung und Vervollkommnung meiner Methylenazur-Methylenblau-Eosin-Färbemethode zur Erzielung der Romanowsky-Nochtschen Chromatinfärbung». Centralbl f Bakt etc. 37: 308–311
- ↑ Marshall PN, Bentley SA, Lewis SM (1978). «Staining properties and stability of a standardised Romanowsky stain». J Clin Pathol. 31 (3): 280–282. PMC 1145244
 . PMID 76638. doi:10.1136/jcp.31.3.280. Consultado em 2 de janeiro de 2016. Arquivado do original em 18 de janeiro de 2013
. PMID 76638. doi:10.1136/jcp.31.3.280. Consultado em 2 de janeiro de 2016. Arquivado do original em 18 de janeiro de 2013
- ↑ Hempelmann E, Wilson RJ (1982). «Immunoprecipitation of malarial enzymes». Protozoology. 29. 637 páginas
- ↑ Barbara J. Bain; Células Sanguíneas - 5ª Edição: Um Guia Prático; Artmed Editora, 2016 - pg 12
- ↑ CAROLINE FAGUNDES TARCITANO; Hemograma de Calopsitas (Nymphicus hollandicus) Criadas no Estado do Rio de Janeiro; Dissertação submetida como requisito parcial para obtenção do grau de Mestre em Ciências, no Curso de Pós-Graduação em Medicina Veterinária, Área de Concentração em Patologia Animal. UNIVERSIDADE FEDERAL RURAL DO RIO DE JANEIRO, INSTITUTO DE VETERINÁRIA; Seropédica, RJ, 2010.
- ↑ GREEN-R.BLUE Mc LENDON, A. ratite hematology (1201-1206 p). In: FELDMAN, B.F. ; ZINK, J.G. & JAIN, N.C. Schalm´s Veterinary Hematology. 5 nd Ed. Philadelphia:Lippincot Willians, 2000,1344 p.
- ↑ Jéssica Gonçalves, et al; Confiabilidade da coloração hematológica rápida para citologia de escarro; J. bras. pneumol. vol.40 no.3; São Paulo, May/June, 2014.
- ↑ Willian Rebouças Schmitt; PUNÇÃO ASPIRATIVA POR AGULHA FINA E A SUA IMPORTÂNCIA DIAGNÓSTICA NAS LESÕES DA TIRÓIDE; Instituto de CIências Médicas Abel Salazar - Universidade do Porto; Porto, 2011.
- ↑ Sudha R. Kini; Thyroid Cytopathology: An Atlas and Text; Lippincott Williams & Wilkins, 2008. - pg 11
- ↑ Raquel Rubia Rech; MASTÓCITOS EM CONDIÇÕES NORMAIS E PATOLÓGICAS COM ÊNFASE EM MASTOCITOMAS DE CÃES Arquivado em 24 de dezembro de 2016, no Wayback Machine.; UFSM Dissertação de Mestrado; Santa Maria, RS, Brasil 2003.
- ↑ Anna Paula Balesdent Barreira, Daniela Tendler Leibel Bacellar, Rosemberg Gomes Kiffer* Ana Liz Garcia Alves; Punção aspirativa de medula óssea em eqüinos adultos para obtenção de células-tronco Arquivado em 20 de dezembro de 2016, no Wayback Machine.; R. bras. Ci. Vet., v. 15, n. 1, p. 56-59, jan./abr. 2008. Outra fonte PDF: www.abraveq.com.br
- ↑ HELENA ISABEL SOARES BORGES E SILVA; CONTRIBUIÇÃO PARA O ESTUDO DO HEMOGRAMA DO CAVALO PURO SANGUE LUSITANO; Dissertação apresentada para a obtenção do Grau de Mestre em Medicina Veterinária no Curso de Mestrado Integrado em Medicina Veterinária conferido pela Universidade Lusófona de Humanidades e Tecnologias. Universidade Lusófona de Humanidades e Tecnologias Faculdade de Medicina Veterinária Lisboa 2011.
- ↑ Rick L. Cowell,Ronald D. Tyler; Diagnostic Cytology and Hematology of the Horse; Elsevier Health Sciences, 2001. pg 8
- ↑ EUNICE ANITA DE MOURA FORTES; MORFOLOGIA, ERITROGRAMA E LEUCOGRAMA DO SANGUE PERIFÉRICO DE EMA (Rhea americana, Linnaeus, 1758); Dissertação apresentada ao Programa de Pós-Graduação do Centro de Ciências Agrárias da Universidade Federal do Piauí; TERESINA, Estado do Piauí - Brasil, novembro - 2004.
- ↑ REGINA MAMEDE COSTA; RESPOSTA HUMORAL E CINÉTICA LEUCOCITÁRIA DE TRACAJÁS (PODOCNEMIS UNIFILIS (TROSCHEL, 1848)) INOCULADAS EXPERIMENTALMENTE COM ESCHERICHIA COLI; UVV – CENTRO UNIVERSITÁRIO VILA VELHA - PROGRAMA DE MESTRADO EM CIÊNCIA ANIMAL; VILA VELHA – ESPÍRITO SANTO, Março de 2011.
- ↑ Fernanda Maria Carvalho SOUSA, Airton Mendes CONDE JÚNIOR, Heliana de Barros FERNANDES, Evelin Nildiane da Silva EDLIN, Eunice Anita de Moura FORTES; MORFOLOGIA DAS CÉLULAS SANGUÍNEAS DE MANDI (PIMELODUS MACULATUS, LACÉPÈDE, 1803); REVISTA CIENTÍFICA DE MEDICINA VETERINÁRIA-ISSN:1679-7353, Ano XII-Número 23 – Julho de 2014 – Periódico Semestral
- ↑ V. A. O. Nascimento, T. F. Moraes, H. J. Q. Oliveira; COLORAÇÃO DE LEUCÓCITOS EM MEIO LÍQUIDO PARA AQUISIÇÃO E DIFERENCIAÇÃO POR PROCESSAMENTO DE IMAGENS; XXIV Congresso Brasileiro de Engenharia Biomédica – CBEB 2014.
- ↑ MACKELLY SIMIONATTO; ESTUDO COMPARATIVO DE MÉTODOS DE CONTAGEM DE RETICULÓCITOS PARA CONTROLE DE QUALIDADE; Dissertação apresentada como requisito parcial à obtenção do grau de Mestre em Ciências Farmacêuticas, Universidade Federal do Paraná; CURITIBA, 2009.
Ligações externas
[editar | editar código-fonte]- Diagnosis and Treatment of Malaria CDC website on malaria diagnosis and treatment
- Field stain Staining methods for the identification of malaria parasites
- Laboratory Diagnosis of Malaria This Royal Perth Hospital (Australia) website provides an excellent overview of malaria diagnostics
- UK malaria advisory, diagnostic and reference service for malaria The Malaria Reference Laboratory of the Public Health Laboratory Service in the UK
- Chenzinsky and Romanowsky(Russian)(English) On the 120th Anniversary of the Discovery of the Romanowsky Effect