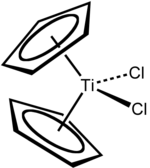
Dicloreto de titanoceno
Dicloreto de titanoceno é o composto de organotitânio de fórmula (η5-C5H5)2TiCl2, comumente abreviado Cp2TiCl2. Este metaloceno é um reagente comum em síntese orgânica e organometálica. Existe como um sólido vermelho e brilhante que lentamente se hidrolisa ao ar.[1] Cp2TiCl2 não adota a estrutura típica de "sanduíche" como o ferroceno devido aos 4 ligantes ao redor do centro de metal, mas toma a forma de tetraedro distorcido.[2]
Preparação
[editar | editar código-fonte]Cp2TiCl2 continua a ser preparado a partir do tetracloreto de titânio, o mesmo método originalmente usado em sua síntese por Wilkinson e Birmingham:[3]
- 2 NaC5H5 + TiCl4 → (C5H5)2TiCl2 + 2 NaCl
A reação é conduzida em THF. O trabalho de acompanhamento inclui lavagem com ácido clorídrico para converter derivados da hidrólise em dicloreto. Recristalização após dissolução em tolueno forma cristais aciculares.
Cp2TiCl2 pode ser preparado ainda usando ciclopentadieno recentemente destilado:
- 2 C5H6 + TiCl4 → (C5H5)2TiCl2
Esta reação é conduzida sob atmosfera de nitrogênio e usando THF como solvente. O produto é purificado por extração de Soxhlet, tendo o tolueno como solvente.[4]
O complexo é pseudotetraedral. Cada um dos dois anéis Cp estão unidos como ligantes η5. Vendo os ligantes Cp como tridentados, o complexo tem um número de coordenação 8.
Aplicações em síntese orgânica
[editar | editar código-fonte]Cp2TiCl2 é um reagente geralmente útil que se comporta efetivamente como fonte de Cp2Ti2+. Uma longa série de nucleófilos substitui cloreto. Exemplos:
- O reagente de Petasis, Cp2Ti(CH3)2, é preparado da ação de CH3MgCl ou MeLi sobre Cp2TiCl2. Este reagente é eficiente na conversão de ésteres em vinil-éteres.
- O reagente de Tebbe, Cp2TiCl(CH2)Al(CH3)2, resulta da ação de 2 equivalentes Al(CH3)3 sobre Cp2TiCl2.
Reações
[editar | editar código-fonte]Cp2TiCl2 sofre reações de troca de ânions, por exemplo, para gerar os pseudohaletos. Com NaSH e sais de polissulfeto, pode-se obter os derivados de sulfito Cp2Ti(SH)2 e Cp2TiS5.
É possível remover um ligante Cp do Cp2TiCl2 para formar CpTiCl3 tetraedral. Esta conversão pode ser efetuada por TiCl4 ou pela reação com SOCl2.[5]
Derivados de Ti(II)
[editar | editar código-fonte]Cp2TiCl2 é um precursor para muitos derivados de Ti(II). O composto Cp não foi isolado: esta espécie (, Cp*) sofre inúmeras reações, tais como cicloadições de alcinos.[6] Uma família de derivados é a dos titanociclopentadienos.[7]
Usos medicinais
[editar | editar código-fonte]Dicloreto de titanoceno foi investigado como uma droga anticâncer.[8] O mecanismo de ação não é compreendido, mas conjetura-se que isso possa se dever a suas interações com a proteína transferrina.[9]
Referências
[editar | editar código-fonte]- ↑ S. Budaver, ed. (1989). The Merck Index (11th ed.). [S.l.]: Merck & Co, Inc.
- ↑ Clearfield,; Warner, David Keith; Saldarriaga-Molina, Carlos Herman; Ropal, Ramanathan; Bernal, Ivan; et al. (1975). «Structural Studies of (π-C5H5)2 MX2 Complexes and their Derivatives. The Structure of Bis(π-cyclopentadienyl)titanium Dichloride». Canadian Journal of Chemistry. 53 (11): 1621–1629. doi:10.1139/v75-228
- ↑ G. Wilkinson and J.G. Birmingham (1954). «Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta». Journal of the American Chemical Society. 76 (17): 4281–4284. doi:10.1021/ja01646a008
- ↑ J.M. Birmingham; Birmingham, J. M. (1964). «Synthesis of Cyclopentadienyl Metal Compounds». Adv. Organometal. Chem. 2 (17). 373 páginas. doi:10.1021/ja01646a008
- ↑ Chandra, K.; Sharma, R. K.; Kumar, N.; Garg, B. S. (1980). «Preparation of η5-Cyclopentadienyltitanium Trichloride and η5-Methylcyclopentadienyltitanium Trichloride». Chem. Industry: 288–9
- ↑ S.L. Buchwald and R.B. Nielsen (1988). «Group 4 Metal Complexes of Benzynes, Cycloalkynes, Acyclic Alkynes, and Alkenes». Chemical Reviews. 88 (7): 1047–1058. doi:10.1021/cr00089a004
- ↑ U. Rosenthal,; et al. (2000). «What Do Titano- and Zirconocenes Do with Diynes and Polyynes?». Chemical Reviews. 33 (2): 119–129. doi:10.1021/ar9900109
- ↑ R. J. Knox and P. C. McGowan. «Metallocenes as Anti-Tumour Reagents». International patent application, WO 2004/005305
- ↑ M. Guo,; et al. (2000). «TiIV Uptake and Release by Human Serum Transferrin and Recognition of TiIV-Transferrin by Cancer Cells: Understanding the Mechanism of Action of the Anticancer Drug Titanocene Dichloride». Biochemistry. 39 (33): 10023–10033. PMID 10955990. doi:10.1021/bi000798z
Leitura posterior
[editar | editar código-fonte]- Payack, J. F.; Hughes, D. L.; Cai, D.; Cottrell, I. F.; Verhoeven, T. R. "Dimethyltitanocene Titanium, bis(η5-2,4-cyclopentadien-1-yl)dimethyl-" Organic Syntheses, Coll. Vol. 10, p. 355 (2004); Vol. 79, p. 19 (2002).
- S. Gambarotta, C. Floriani, A. Chiesi-Villa and C. Guastini (1983). «Cyclopentadienyldichlorotitanium(III): a free-radical-like reagent for reducing azo (N:N) multiple bonds in azo and diazo compounds». J. Am. Chem. Soc. 105 (25): 7295–7301. doi:10.1021/ja00363a015