Ocratoxina A
| Ocratoxina A Alerta sobre risco à saúde | |
|---|---|

| |
| Nome IUPAC | N-{[(3R)-5-chloro-8-hydroxy-3-methyl-1-oxo-3,4-dihydro-1H-isochromen-7-yl]carbonyl}-L-phenylalanine |
| Outros nomes | (R)-N- [(5-Chloro- 3,4-dihydro- 8-hydroxy- 3-methyl- 1-oxo- 1H-2-benzopyran-7-yl) -carbonyl]- L- phenylalanine (-)-N- [(5-Chloro- 8-hydroxy- 3-methyl- 1-oxo- 7-isochromanyl) carbonyl]- 3-phenylalanine |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| Propriedades | |
| Fórmula química | C20H18ClNO6 |
| Massa molar | 403.78 g mol-1 |
| Compostos relacionados | |
| Compostos relacionados | Fenilalanina |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A ocratoxina A (OTA) é uma micotoxina produzida por algumas espécies de fungos filamentosos pertencentes ao género Aspergillus e Penicillium e é, entre todas as ocratoxinas, a mais tóxica e a mais relevante.[1] A sua importância deve-se às suas propriedades carcinogénicas, nefrotóxicas, teratogénicas, imunotóxicas e neurotóxicas. A ocratoxina A está associada à nefropatia em humanos e tem sido sugerida uma relação entre a exposição a esta toxina e a Nefropatia Endémica dos Balcãs, uma doença progressiva caracterizada por redução da função renal e frequentemente fatal.[2]
Estrutura
[editar | editar código-fonte]É constituída por uma di-hidroisocumarina ligada pelo grupo 7-carboxilo a uma molécula de L-β-fenilalanina, através de uma ligação amida. O seu nome químico é (R)-N-((5-cloro-3,4-di-hidro-8-hidroxi-3-metil-1-oxo-1H-2-benzopirano-7-il)carbonil)-L-fenilalanina.[1]
Exposição humana
[editar | editar código-fonte]Sendo os cereais a principal fonte de alimentação no mundo, não é de estranhar que estes sejam considerados a maior fonte de propagação de ocratoxina A. Estima-se que a contaminação dos cereais por uma ou mais micotoxinas se situe entre os 25 e 40%. Esta contaminação pode decorrer quer na plantação, quer durante o armazenamento.[1]
A principal via de exposição humana à ocratoxina A é a via directa, que ocorre através do consumo de alimentos contaminados como os cereais, mas também frutos secos, vinhos, café e outros. Por outro lado, pode também ocorrer por via indirecta, através do consumo de produtos animais contendo resíduos da micotoxina resultantes da sua alimentação com produtos contaminados. A transmissão pelo ar também pode ocorrer, embora muito raramente e em condições particulares.[1]
Toxicocinética
[editar | editar código-fonte]Existem poucos dados sobre a toxicocinética em seres humanos. Estudos em animais sugerem que o principal local de absorção da ocratoxina A é o duodeno e o jejuno.[2] A absorção passiva é altamente favorecida pela alta afinidade de ligação às proteínas plasmáticas,[2] sendo que 99% da ocratoxina A encontra-se ligada a proteínas séricas, principalmente à albumina.[3] A OTA tem rápida absorção mas lenta eliminação. É excretada pelos túbulos renais recorrendo a proteínas orgânicas aniónicas,[2] mas pode ser reabsorvida nos túbulos renais atrasando a sua eliminação e aumentando o risco de acumulação nos tecidos.[3]
A principal via metabólica da OTA é a hidrólise num composto não tóxico, OTα, formado pela quebra das ligações peptídicas, que ocorre principalmente a nível intestinal por acção enzimática da microflora local.[2]
Manifestações de toxicidade
[editar | editar código-fonte]A nefrotoxicidade é o efeito mais notório da OTA, manifesto em todos os mamíferos não ruminantes.[1] Esta micotoxina está associada à nefropatia em humanos e tem sido sugerida uma relação entre a exposição a esta toxina e a Nefropatia Endémica dos Balcãs (BEN), uma doença progressiva caracterizada por redução da função renal e frequentemente fatal.[1] A BEN manifesta-se como uma fibrose renal progressiva,[4] não tratável e fatal, caracterizada por urémia, anemia, proteinúria, depósitos renais, redução do poder renal de concentração da urina, cefaleias, anorexia e fadiga.[2][5] A presença da micotoxina é responsável por degeneração tubular, fibrose intersticial e pela diminuição da função renal, uma vez que afecta múltiplos sítios no nefrónio, sendo que uma exposição crónica induz danos dos túbulos proximais.[6] Contudo, também é capaz de exercer outros efeitos nefastos, tais como hepatotóxicos, neurotóxicos, teratogénicos e imunotóxicos em diferentes espécies de animais.[7]
Mecanismos de Toxicidade
[editar | editar código-fonte]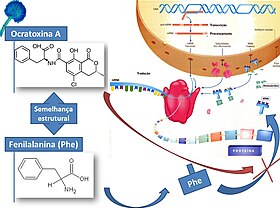
A semelhança estrutural com a fenilalanina (aminoácido) explica a sua acção na inibição da síntese proteica, possivelmente por inibição da elongação péptica e, consequentemente, prejudica indirectamente a actividade de diversas enzimas celulares.[9] A inibição da enzima responsável pela formação do complexo fenilalanina-tRNA (fenilalanina-tRNA sintetase) provoca a interrupção da reacção de aminoacilação e, consequentemente, a síntese proteica cessa após a transcrição.[4][7]
Existem diversos estudos que sugerem o envolvimento de stress oxidativo na toxicidade da OTA. A OTA é responsável pela quelatação dos iões Fe3+ presentes no CP450, facilitando a sua redução na presença do sistema NADPH-citocromo P450 reductase. Desta forma, aumenta a produção de iões Fe2+ que, na presença de oxigénio, formam radicais livres.[10] A produção de radicais de oxigénio está envolvida no dano de macromoléculas, incluindo peroxidação lipídica e lesão do DNA, a qual pode levar a posterior mutação e cancro.[9]
A OTA ainda tem sido associada a fenómenos de inibição da respiração mitocondrial, a alteração da homeostasia do cálcio e a formação de aductos de DNA.[2][9]
Controle e Prevenção
[editar | editar código-fonte]A ocratoxina A é estável e geralmente resistente ao calor e ao processamento, pelo que o controle de ocratoxina A baseia-se no controle do crescimento dos fungos produtores de toxinas.[11] Algumas medidas específicas incluem a redução do teor de humidade do grão na pré-colheita e fases de colheita; manutenção das boas condições do solo e nutrição de plantas; prevenção de contaminações por fungos durante o plantio.[11][12]
Para os consumidores são aconselhados a seguir o conselho geral da dieta de uma alimentação saudável, consumindo uma grande variedade de cereais e ter uma dieta equilibrada e variada. Aconselha-se a procura de conhecimento das condições dos produtos alimentares antes da compra e não comprar ou consumir alimentos onde a presença de fungos seja visível.[11][12]
Notas e referências
- ↑ a b c d e f Khoury, A.; Atoui, A. (2010). Ochratoxin A: General Overview and Actual Molecular Status. Toxins 2: 461-493
- ↑ a b c d e f g Pfohl-Leszkowicz, A.; Manderville, R. (2007). Ochratoxin A: An overview on toxicity and carcinogenicity in animals and humans. Molecular Nutrition & Food Research 51: 61-99
- ↑ a b E. Petzinger; K. Ziegler (2000). Ochratoxin A from a toxicological perspective. Pharmacology & Therapeutics 23: 91-98
- ↑ a b Schaaf, G. et al. (2002). The role of oxidative stress in the ochratoxin A-mediated toxicity in proximal tubular cells. Biochimica et Biophysica Acta 1588: 149-158
- ↑ Barceloux, D. (2008). Medical Toxicology of Natural Substances. United States of America: Wiley. pp: 343-347
- ↑ Gagliano, N. et al. (2005). Ochratoxin A–Induced Renal Cortex Fibrosis and Epithelial-to-Mesenchymal Transition: Molecular Mechanisms of Ochratoxin A-Injury and Potential Effects of Red Wine. Molecular Medicine 11: 30-38
- ↑ a b Bennett, J.; Klich, M. (2003). Mycotoxins. Clinical Microbiology Reviews 16(3): 504-505
- ↑ «Ocratoxina A (pt)». Sites.google.com
- ↑ a b c Schilter, B. et al. (2005). Ochratoxin A: Potencial epigenetic mechanisms of toxicity and carcinogenicity. Food Additives and Contaminants, Supplement 1: 88-93
- ↑ Omar, R. et al. (1990). Mechanism of ochratoxin A stimulated lipid peroxidation. Biochemical Pharmacology 40: 1183–1191
- ↑ a b c World Health Organization (PDF) http://www.who.int/ipcs/food/jecfa/summaries/en/summary_56.pdf. Consultado em 10 de Maio de 2011 Em falta ou vazio
|título=(ajuda) - ↑ a b Code of Practice For The Prevention and Redution of Mycotoxin Contamination in Cereals, ALINORM 03/12A, 108-115