Paratungstato de amônio
As referências deste artigo necessitam de formatação. (Agosto de 2024) |
O paratungstato de amônio (ou APT, do inglês Ammonium ParaTungstate) é um sal cristalino branco com a fórmula química (NH
4)
10(H
2W
12O
42)
·4H
2O
. É descrito como "a matéria-prima mais importante para todos os outros produtos de tungstênio".[1]
| Ammonium paratungstate Alerta sobre risco à saúde | |
|---|---|

| |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| InChI | 1/10H3N.41O.12W/h10*1H3;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;/q;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;;5*-2;;;;;;;;;;;;/p+10/r10H3N.12O3W.5O/c;;;;;;;;;;12*1-4(2)3;;;;;/h10*1H3;;;;;;;;;;;;;;;;;/q;;;;;;;;;;;;;;;;;;;;;;5*-2/p+10
|
| Propriedades | |
| Fórmula molecular | (NH4)10(H2W12O42)·4H2O |
| Massa molar | 3132.2 g/mol |
| Aparência | Sólido branco |
| Densidade | 4.60 g/cm3[2] |
| Ponto de ebulição |
Decompõe a 600 °C |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Produção
[editar | editar código-fonte]A partir de minérios de tungstênio
[editar | editar código-fonte]Minérios de tungstênio, que são tipicamente óxidos, são digeridos em base para dar soluções de tungstato juntamente com muitas espécies contaminantes. Este extrato bruto é acidificado e tratado com sulfeto para separar trissulfeto de molibdênio. Após acidificação adicional, o APT eventualmente cristaliza.[1]
Métodos de laboratório
[editar | editar código-fonte]Se for utilizado um trióxido de tungstênio calcinado, é aconselhável refluxar a solução de amônia para acelerar sua dissolução.
Conversão para tungstênio metálico
[editar | editar código-fonte]O aquecimento do paratungstato de amônio até sua temperatura de decomposição de 600°C produz trióxido de tungstênio (WO
3
), conforme descrito nesta equação química idealizada:
- (NH4)10[H2W12O42]·4H2O → 12WO3 + 10NH3 + 6H2O
A partir daí, o trióxido é aquecido em uma atmosfera de hidrogênio, produzindo tungstênio elementar[3]:
- WO3 + 3H2 → W + 3H2O
Estrutura
[editar | editar código-fonte]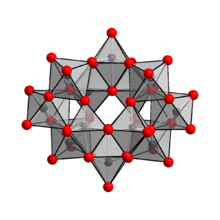
12O
42]12– , enfatizando os poliedros de coordenação. No APT, esse ânion liga dois prótons e é associado a dez contra-íons NH+
4 .
O ânion em {{chem2|(NH4)10(W12O41)·5H
2O
demonstrou ser [H
2W
12O
42]10–
, contendo dois átomos de hidrogênio, mantendo dois átomos de hidrogênio dentro da gaiola.[4] A notação de fórmula correta para paratungstato de amônio é, portanto,(NH
4)
10[H
2W
12O
42]
·4H
2O
. O íon [H
2W
12O
42]10–
conhecido como íon paratungstato B, em oposição ao íon paratungstato A, que tem a fórmula [W
7O
24]6–
, semelhante ao íon paramolibdato. A existência do íon paratungstato A, no entanto, não pôde ser confirmada por espectroscopia de RMN.[2]
Antes de 1930, houve alguma disputa sobre a composição exata do sal, e tanto (NH
4)
10[W
12O
41]
·4H
2O
quanto (NH
4)
6[W
7O
24]
foram propostos. OW Gibbs comentou sobre isso:
"Os tungstatos alcalinos são numerosos e incomumente complexos. Sais de fórmulas essencialmente diferentes se aproximam tanto em composição percentual, que as diferenças ficam muito próximas dos erros inevitáveis das análises. As análises dificilmente são suficientemente próximas para decidir a questão com base em fundamentos puramente analíticos."[5]
Outros hidratos
[editar | editar código-fonte]Ao concentrar uma solução amoniacal de ácido túngstico (ou seja, WO
3
hidratado), o produto obtido é paratungstato de amônio. Abaixo de 50 °C, o hexahidrato é formado, enquanto que quando a temperatura da solução está acima de 50 °C, o pentahidrato ou heptahidrato é formado. O primeiro cristaliza como placas triclínicas ou prismas, enquanto o último como agulhas pseudorrômbicas. O tetrahidrato é mais significativo em um sentido comercial. Também conhecido:
- decahidrato [6]
- nonahidrato.
Referências
- ↑ a b Predefinição:Ullmann
- ↑ a b d'Amour, Hedwig; Allmann, Rudolf (1972). «Die Kristallstruktur des Ammoniumparawolframat-tetrahydrats (NH4)10[H2W12O42]·4H2O». Zeitschrift für Kristallographie. 136 (1–2): 23–47. Bibcode:1972ZK....136...23D. doi:10.1524/zkri.1972.136.1-2.23
- ↑ D. J. Jones, "Practical aspects of Sintering Tungsten and Molybdenum" (as referenced in Comprehensive Inorganic Chemistry, J. C. Bailar Jr. et al., p. 744, vol. 3, 1st edition 1973)
- ↑ d'Amour, Hedwig; Allmann, Rudolf (1972). «Die Kristallstruktur des Ammoniumparawolframat-tetrahydrats (NH4)10[H2W12O42]·4H2O». Zeitschrift für Kristallographie. 136 (1–2): 23–47. Bibcode:1972ZK....136...23D. doi:10.1524/zkri.1972.136.1-2.23
- ↑ Greenwood & Earnshaw, Chemistry of the Elements, 2nd ed. 1997, pp. 1012–1014
- ↑ Allmann, R. (1971). «Die Struktur des Ammoniumparawolframates (NH4)10[H2W12O42].10H2O». Acta Crystallographica Section B. 27 (7): 1393–1404. doi:10.1107/S0567740871004047