Телапревир
| Телапревир | |
|---|---|
 | |
 | |
| Химическое соединение | |
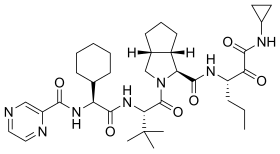
| ИЮПАК | (1S,3aR,6aS)-2-[(2S)-2-[[(2S)-2-Cyclohexyl-2-(pyrazine-2-carbonylamino)acetyl]amino]-3,3-dimethylbutanoyl]-N-[(3S)-1-(cyclopropylamino)-1,2-dioxohexan-3-yl]-3,3a,4,5,6,6a-hexahydro-1H-cyclopenta[c]pyrrole-1-carboxamide |
| Брутто-формула | C36H53N7O6 |
| CAS | 402957-28-2 |
| PubChem | 3010818 |
| DrugBank | DB05521 |
| Состав | |
| Классификация | |
| АТХ | J05AP02 |
| Фармакокинетика | |
| Связывание с белками плазмы | 59–76% [1] |
| Метаболизм | extensive hepatic |
| Период полувывед. | 9–11 часов |
| Экскреция | 90% (желчь), 9% (выдыхаемый воздух), 1% (моча) |
| Способы введения | |
| Перорально[2] | |
Телапревир (VX-950), продаваемый под торговыми марками Incivek и Incivo, представляет собой фармацевтический препарат для лечения гепатита С, разработанный совместно Vertex Pharmaceuticals и Johnson & Johnson. Он является членом класса противовирусных препаратов, известных как ингибиторы протеазы[3]. В частности, Телапревир подавляет сериновую протеазу NS3/4A вируса гепатита C[4]. Телапревир показан только для использования против вирусных инфекций гепатита C генотипа 1, и не было доказано, что он влияет на другие генотипы вируса или является безопасным. Стандартная терапия пегилированным интерфероном и рибавирином менее эффективна, чем Телапревир, у пациентов с генотипом 1.
Клинические испытания и одобрения
[править | править код]В рандомизированном контролируемом исследовании (PROVE3) пациентов, у которых стандартное лечение пегинтерфероном альфа-2a и рибавирином не помогло, повторное лечение с добавлением телапревира с большей вероятностью дало устойчивый вирусологический ответ (УВО), чем повторное лечение только пегинтерфероном альфа-2а и рибавирином[5]. У пациентов, получавших пегинтерферон альфа-2а и рибавирин в течение года, добавление телапревира в течение 24 недель привело к достижению УВО 53 % по сравнению с 14 % у пациентов, которые не получали телапревир. В этом исследовании кратковременное лечение с использованием всего трех месяцев телапревира и шести месяцев лечения пегинтерфероном альфа-2а и рибавирином позволило достичь УВО 51 %. Во втором рандомизированном контролируемом исследовании (REALIZE) пациентов, у которых ранее был рецидив или имелась только частичная реакция, частота УВО была выше у пациентов, получавших телапревир (83-88 %), по сравнению с 24 % в контрольной группе[6]. В третьем исследовании (ADVANCE) с участием ранее нелеченных пациентов[7], пациенты, принимавшие телапревир, имели УВО (от 69 % до 75 %) по сравнению с 44 % в контрольной группе.
28 апреля 2011 года Консультативный комитет Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) по противовирусным препаратам проголосовал 18-0 за рекомендацию одобрения Телапревира для людей с хроническим гепатитом C генотипа 1. Комитет рассмотрел данные клинических испытаний (включая результаты исследований фазы III ADVANCE, ILLUMINATE и REALIZE.), показавший, что сочетание телапревира с пегилированным интерфероном и рибавирином дает более высокий процент излечения — и за меньшее время — по сравнению с одной стандартной терапией. Это улучшение особенно заметно у пациентов с тяжелым лечением, включая пациентов с генотипом 1 HCV, людей с циррозом печени и тех, кто не имел реакцию на предыдущий курс терапии на основе интерферона. Боцепревир, разработанный фармацевтической компанией Мерк и Ко, также является новым препаратом против гепатита С, получивший положительную рекомендацию того же комитета[8]. Телапревир был полностью одобрен для использования в США в мае 2011 года[9].
Побочные эффекты
[править | править код]Самый частый побочный эффект — сыпь. Нежелательные явления 3 степени (в основном анемия и лейкопения/нейтропения) чаще встречались в группах телапревира, чем в контрольной группе (37 % против 22 %). После получения сообщений о серьезных кожных реакциях, в том числе со смертельным исходом, у пациентов, принимающих препарат против гепатита С Incivek (телапревир) в сочетании с препаратами пегинтерферон альфа и рибавирин (комбинированное лечение Incivek), FDA добавил предупреждение в виде черного ящика на этикетку этого продукта Vertex Pharmaceutical Inc. 19 декабря 2012 года Vertex Pharmaceutical объявила, что добавит предупреждение о возможных побочных эффектах в рамку на этикетках телапревира в США после «сообщения о небольшом количестве фатальных кожных реакций у пациентов, которые продолжали получать комбинированную терапию Incivek после того, как была выявлена серьезная кожная реакция». FDA сообщило, что два человека умерли от серьезных кожных реакций, вызванных комбинированным лечением Incivek, и в общей сложности у 112 пациентов развились серьезные кожные реакции двух разных типов[10].
Доступность
[править | править код]Стоимость тройной терапии гепатита С на основе телапревира составляет $189 000 за один устойчивый вирусный ответ[11]. 12 августа 2014 года Vertex Pharmaceuticals объявила о прекращении производства своего бренда телапревира, Incivek, в связи с падением спроса на препарат, вызванным конкуренцией со стороны более новых препаратов для лечения гепатита С[12].
Примечания
[править | править код]- ↑ Kiser JJ, Burton JR, Anderson PL, Everson GT (May 2012). "Review". Hepatology. 55 (5): 1620—8. doi:10.1002/hep.25653. PMC 3345276. PMID 22331658.
- ↑ Kim, Jenny; Culley, Colleen; Mohammad Rima, Telaprevir (2012). "An Oral Protease Inhibitor for Hepatitis C Virus Infection". Am J Health Syst Pharm. 69 (1): 19—33. doi:10.2146/ajhp110123. PMID 22180548.
- ↑ Revill P, Serradell N, Bolos J, Rosa E (2007). "Telaprevir". Drugs of the Future. 32 (9): 788. doi:10.1358/dof.2007.032.09.1138229. Архивировано 22 августа 2021. Дата обращения: 22 августа 2021.
- ↑ Lin C, Kwong AD, Perni RB (March 2006). "Discovery and development of VX-950, a novel, covalent, and reversible inhibitor of hepatitis C virus NS3.4A serine protease". Infect Disord Drug Targets. 6 (1): 3—16. doi:10.2174/187152606776056706. PMID 16787300.
- ↑ McHutchison JG, Manns MP, Muir AJ, et al. (2010). "Telaprevir for previously treated chronic HCV infection". N Engl J Med. 362 (14): 1292—303. doi:10.1056/NEJMoa0908014. hdl:1887/117348. PMID 20375406.
- ↑ Zeuzem S, Andreone P, Pol S, et al. (2011). "Telaprevir for retreatment of HCV infection". N Engl J Med. 364 (25): 2417—28. doi:10.1056/NEJMoa1013086. hdl:1854/LU-1850472. PMID 21696308.
- ↑ Jacobson IM, McHutchison JG, Dusheiko G, et al. (2011). "Telaprevir for previously untreated chronic hepatitis C virus infection" (PDF). N Engl J Med. 364 (25): 2405—16. doi:10.1056/NEJMoa1012912. hdl:2318/97842. PMID 21696307. Архивировано (PDF) 14 ноября 2021. Дата обращения: 22 августа 2021.
- ↑ "FDA recommends approval for Telaprevir and Boceprevir". hivandhepatitis.com (2011). Дата обращения: 22 августа 2021. Архивировано 22 августа 2021 года.
- ↑ Emma Hitt. "FDA Approves Telaprevir for HCV". medscape.com (23 мая 2011). Дата обращения: 22 августа 2021. Архивировано 22 августа 2021 года.
- ↑ Chris Reidy and Robert Weisman. Vertex updates label of hepatitis C drug after reports of a ‘small number of fatal skin reactions’. boston.com (19 декабря 2012). Дата обращения: 22 августа 2021. Архивировано 22 августа 2021 года.
- ↑ Miriam E. Tucker. "Costs for Hepatitis C Treatment Skyrocket". Medscape Medical News (13 ноября 2013). Дата обращения: 22 августа 2021. Архивировано 22 августа 2021 года.
- ↑ Ed Silverman. "From Riches to Rags: Vertex Discontinues Incivek as Sales Evaporate". The Wall Street Journal (12 августа 2014). Дата обращения: 22 августа 2021. Архивировано 22 августа 2021 года.