Orthornavirae
| Orthornavirae | ||||||||
|---|---|---|---|---|---|---|---|---|
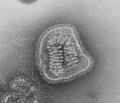
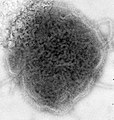
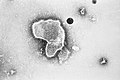
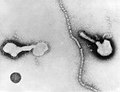
 По часовой стрелке сверху слева: ПЭМ птичьего коронавируса, вируса полиомиелита, бактериофага Qβ, эболавируса, вируса табачной мозаики, вируса гриппа А, ротавируса, вирус везикулярного стоматита. Центр: филогенетическое древо белка общей репликации RdRp. | ||||||||
| Научная классификация | ||||||||
| Международное научное название | ||||||||
| Orthornavirae | ||||||||
| Типы и классы | ||||||||
| ||||||||
Orthornavirae — царство вирусов, геномы которых состоят из рибонуклеиновой кислоты (РНК) и кодируют РНК-зависимую РНК-полимеразу (RdRp). RdRp используется для транскрипции генома вирусной РНК в информационную РНК (мРНК) и для репликации генома. Вирусы этого царства также имеют ряд общих характеристик, связанных с эволюцией, включая высокую скорость генетических мутаций, рекомбинаций и реассортации.
Вирусы Orthornavirae принадлежат к реалму Riboviria. Они произошли от общего предка, который мог быть невирусной молекулой, кодирующей обратную транскриптазу вместо RdRp для репликации. Царство подразделяется на пять типов, которые разделяют вирусы-члены на основе их типа генома, диапазона хозяев и генетического сходства. Включаются вирусы с тремя типами генома: РНК-вирусы с положительной цепью, РНК-вирусы с отрицательной цепью и двухцепочечные РНК-вирусы .
Многие из наиболее широко известных вирусных заболеваний вызываются РНК-вирусами в королевстве, включая коронавирусы, вирус Эбола, вирусы гриппа, вирус кори и вирус бешенства. Первый обнаруженный вирус, вирус табачной мозаики, относится к королевству. В современной истории РНК-вирусы, кодирующие RdRp, вызывали многочисленные вспышки болезней и поражали многие экономически важные сельскохозяйственные культуры. Большинство эукариотических вирусов, включая большинство вирусов человека, животных и растений, представляют собой РНК-вирусы, кодирующие RdRp. Напротив, в королевстве относительно мало прокариотических вирусов.
Этимология
[править | править код]Первая часть Orthornavirae происходит от греческого ὀρθός [orthós], что означает «прямой», средняя часть, rna, относится к РНК, а -virae — это суффикс, используемый для царств вирусов[2].
Характеристика
[править | править код]Структура
[править | править код]
РНК-вирусы Orthornavirae обычно не кодируют множество белков. Большинство одноцепочечных (+ssRNA) вирусов с положительным смыслом и некоторые двухцепочечные РНК-вирусы (dsRNA) кодируют основной белок капсида, который имеет одиночную желеобразную укладку, так называемую потому что складчатая структура белка содержит структуру, напоминающую рулет из желе[3]. Многие также обладают оболочкой из липидной мембраны, которая обычно окружает капсид. В частности, вирусная оболочка почти универсальна среди одноцепочечных (-ssRNA) вирусов с отрицательным смыслом[4][5].
Геном
[править | править код]Вирусы Orthornavirae имеют три различных типа геномов: dsRNA, +ssRNA и -ssRNA. Одноцепочечные РНК-вирусы имеют либо положительную, либо отрицательную смысловую цепь, а вирусы dsRNA имеют обе. Эта структура генома важна с точки зрения транскрипции для синтеза вирусной мРНК, а также репликации генома, которые осуществляются вирусным ферментом РНК-зависимой РНК-полимеразой (RdRp), также называемой РНК-репликазой[2][3].
Репликация и транскрипция
[править | править код]РНК-вирусы с положительной цепью
[править | править код]РНК-вирусы с положительной цепью имеют геномы, которые могут функционировать как мРНК, поэтому транскрипция не требуется. Однако +ssRNA будут продуцировать формы dsRNA как часть процесса репликации их геномов. Из dsRNA синтезируются дополнительные положительные цепи, которые можно использовать в качестве мРНК или геномов для потомства. Поскольку вирусы +ssRNA создают промежуточные формы dsRNA, им приходится избегать иммунной системы хозяина, чтобы размножаться. Вирусы +ssRNA достигают этого путем репликации в ассоциированных с мембраной везикулах, которые используются в качестве фабрик репликации[6]. Для многих вирусов +ssRNA субгеномные части генома будут транскрибироваться для трансляции определённых белков, тогда как другие будут транскрибировать полипротеин, который расщепляется с образованием отдельных белков[7][8].
РНК-вирусы с отрицательной цепью
[править | править код]РНК-вирусы с отрицательной цепью имеют геномы, которые функционируют как матрицы, из которых мРНК может быть синтезирована непосредственно с помощью RdRp[9]. Репликация — это тот же процесс, но выполняемый на антигеноме положительного смысла, во время которого RdRp игнорирует все сигналы транскрипции, так что может быть синтезирован полный геном -ssRNA[10]. Вирусы -ssRNA различаются между вирусами, которые инициируют транскрипцию с помощью RdRp, создавая кэп на 5'-конце (обычно произносится как «5 прайм конец») генома, или отрывая кэп от мРНК хозяина и прикрепляя его к вирусу. РНК[11]. У многих вирусов -ssRNA в конце транскрипции RdRp «заикается» на урациле в геноме, синтезируя сотни аденинов подряд как часть создания полиаденилированного хвоста для мРНК[12]. Некоторые вирусы -ssRNA по существу амбисенсны и имеют белки, кодируемые как положительной, так и отрицательной цепью, поэтому мРНК синтезируется непосредственно из генома и из комплементарной цепи[13].
Двухцепочечные РНК-вирусы
[править | править код]Для вирусов dsRNA RdRp транскрибирует мРНК, используя отрицательную цепь в качестве матрицы. Положительные цепи также можно использовать в качестве матриц для синтеза отрицательных цепей для конструирования геномной dsRNA. dsRNA не является молекулой, продуцируемой клетками, поэтому клеточная жизнь выработала механизмы для обнаружения и инактивации вирусной dsRNA. Чтобы противостоять этому, вирусы dsRNA обычно сохраняют свои геномы внутри вирусного капсида, чтобы уклониться от иммунной системы хозяина[14].
Эволюция
[править | править код]РНК-вирусы Orthornavirae подвержены высокой частоте генетических мутаций, потому что RdRp склонен к ошибкам при репликации, поскольку в нём обычно отсутствуют механизмы корректуры для исправления ошибок[note 1]. На мутации РНК-вирусов часто влияют факторы хозяина, такие как дцРНК-зависимые аденозиндеаминазы, которые редактируют вирусные геномы, заменяя аденозины на инозины[15][16]. Мутации в генах, которые необходимы для репликации, приводят к уменьшению числа потомков, поэтому вирусные геномы обычно содержат высококонсервативные последовательности с относительно небольшим количеством мутаций[17].
Многие РНК-вирусы, кодирующие RdRp, также испытывают высокую скорость генетической рекомбинации, хотя скорость рекомбинации значительно различается: более низкая скорость у вирусов -ssRNA и более высокая скорость у вирусов dsRNA и +ssRNA. Существует два типа рекомбинации: рекомбинация выбора копии и реассортация. Рекомбинация выбора копии происходит, когда RdRp переключает матрицы во время синтеза, не высвобождая предшествующую, вновь созданную цепь РНК, которая генерирует геном смешанного происхождения. Реассортация, которая ограничена вирусами с сегментированными геномами, имеет сегменты из разных геномов, упакованные в один вирион или вирусную частицу, которая также производит гибридное потомство[15][18].
Для рекомбинации некоторые сегментированные вирусы упаковывают свои геномы в несколько вирионов, в результате чего геномы представляют собой случайные смеси родителей, тогда как для тех, которые упакованы в один вирион, обычно отдельные сегменты меняются местами. Обе формы рекомбинации могут возникать только в том случае, если в клетке присутствует более одного вируса, и чем больше аллелей присутствует, тем более вероятна рекомбинация. Ключевое различие между рекомбинацией выбора копии и реассортацией состоит в том, что рекомбинация выбора копии может происходить в любом месте генома, тогда как реассортация меняет местами полностью реплицированные сегменты. Следовательно, рекомбинация выбора копии может продуцировать нефункциональные вирусные белки, тогда как реассортация не может[15][18][19].
Скорость мутаций вируса связана со скоростью генетических рекомбинаций. Более высокие скорости мутаций увеличивают количество как полезных, так и неблагоприятных мутаций, тогда как более высокие скорости рекомбинации позволяют отделить полезные мутации от вредных. Следовательно, более высокие скорости мутаций и рекомбинаций до определённого момента улучшают способность вирусов к адаптации[15][20]. Известные примеры этого включают рекомбинацию, которая способствует межвидовой передаче вирусов гриппа, что привело к многочисленным пандемиям, а также появление штаммов гриппа с лекарственной устойчивостью через мутации, которые были реассортированы[21].
Филогенетика
[править | править код]
Точное происхождение Orthornavirae точно не установлено, но вирусный RdRp демонстрирует связь с ферментами обратной транскриптазы (RT) интронов группы II, которые кодируют RT и ретротранспозоны, последние из которых представляют собой самореплицирующиеся последовательности ДНК, которые интегрируются в другие частей одной и той же молекулы ДНК. Внутри королевства вирусы +ssRNA, вероятно, являются самой старой линией, вирусы dsRNA, по-видимому, неоднократно возникали из вирусов +ssRNA, а вирусы -ssRNA, в свою очередь, по-видимому, связаны с реовирусами, которые являются вирусами dsRNA[2][22].
Классификация
[править | править код]РНК-вирусы, кодирующие RdRp, отнесены к царству Orthornavirae, которое содержит пять типов и несколько таксонов, не отнесенных к типу из-за отсутствия информации. Пять типов разделены на основе типов генома, диапазонов хозяев и генетического сходства вирусов-членов[2][23].
- Тип: Duplornaviricota, который содержит вирусы dsRNA, инфицирующие прокариоты и эукариоты, которые не кластеризуются с членами Pisuviricota и которые кодируют капсид, состоящий из 60 гомо- или гетеродимеров капсидных белков, организованных на решетке с псевдосимметрией T=2.
- Тип: Kitrinoviricota, содержащий вирусы +ssRNA, инфицирующие эукариот и не группирующиеся с представителями Pisuviricota.
- Тип: Lenarviricota, содержащий вирусы +ssRNA, инфицирующие прокариоты и эукариоты и не группирующиеся с представителями Kitrinoviricota.
- Тип: Negarnaviricota, который содержит все вирусы -ssRNA[note 2].
- Тип: Pisuviricota, который содержит вирусы +ssRNA и dsRNA, инфицирующие эукариоты и не кластеризующиеся с другими типами.
Неназначенные таксоны перечислены ниже (-viridae обозначает семейство, а -virus обозначает род)[2][23].
- Birnaviridae
- Permutotetraviridae
- Botybirnavirus
Королевство состоит из трех групп в системе классификации Балтимора, которая объединяет вирусы на основе их способа синтеза мРНК и часто используется вместе со стандартной таксономией вирусов, основанной на истории эволюции. Эти три группы представляют собой группу III: вирусы dsRNA, группу IV: вирусы + ssRNA и группу V: вирусы -ssRNA[2][24].
Болезни
[править | править код]РНК-вирусы связаны с широким спектром заболеваний, включая многие из наиболее широко известных вирусных заболеваний. Известные болезнетворные вирусы Orthornavirae включают:[23]
- Coronaviruses
- Crimean-Congo hemorrhagic fever orthonairovirus
- Dengue virus
- Ebolavirus
- Hantaviruses
- Hepatitis A virus
- Hepatitis C virus
- Hepatitis E virus
- Human orthopneumovirus
- Influenza viruses
- Japanese encephalitis virus
- Lassa mammarenavirus
- Measles morbillivirus
- Mumps orthorubulavirus
- Norovirus
- Poliovirus
- Rabies lyssavirus
- Rhinoviruses
- Rift Valley fever phlebovirus
- Rotavirus
- Rubella virus
- West Nile virus
- Yellow fever virus
- Zika virus
Вирусы животных в Orthornavirae включают орбивирусы, которые вызывают различные заболевания у жвачных животных и лошадей, в том числе вирус катаральной лихорадки, вирус африканской чумы лошадей, вирус энцефалеза лошадей и вирус эпизоотической геморрагической болезни[25]. Вирус везикулярного стоматита вызывает заболевание крупного рогатого скота, лошадей и свиней[26]. Летучие мыши являются переносчиками многих вирусов, включая эболавирусы и генипавирусы, которые также могут вызывать заболевания у людей[27]. Аналогично, вирусы членистоногих родов Flavivirus и Phlebovirus многочисленны и часто передаются человеку[28][29]. Коронавирусы и вирусы гриппа вызывают заболевания у различных позвоночных, включая летучих мышей, птиц и свиней[30][31].
Вирусы растений в королевстве многочисленны и поражают многие экономически важные культуры. По оценкам, вирус пятнистого увядания томатов ежегодно наносит ущерб на сумму более 1 миллиарда долларов США, поражая более 800 видов растений, включая хризантему, салат, арахис, перец и помидоры. Вирус мозаики огурца поражает более 1200 видов растений и также вызывает значительные потери урожая. Вирус Y картофеля вызывает значительное снижение урожайности и качества перца, картофеля, табака и томатов, а вирус оспы сливы является наиболее важным вирусом среди косточковых культур. Вирус мозаики костреца, хотя и не вызывает значительных экономических потерь, встречается на большей части мира и в основном поражает травы, в том числе злаки[32][33].
История
[править | править код]Заболевания, вызываемые РНК-содержащими вирусами Orthornavirae, были известны на протяжении большей части истории, но их причина была обнаружена только в наше время. В целом, РНК-вирусы были открыты в период крупных достижений в области молекулярной биологии, включая открытие мРНК как непосредственного носителя генетической информации для синтеза белка[34]. Вирус табачной мозаики был обнаружен в 1898 году и стал первым обнаруженным вирусом[35]. Вирусы в королевстве, которые передаются членистоногими, были ключевой мишенью в разработке средств борьбы с переносчиками, которые часто направлены на предотвращение вирусных инфекций[36]. В современной истории многочисленные вспышки заболеваний были вызваны РНК-вирусами, кодирующими RdRp, включая вспышки, вызванные коронавирусами, лихорадкой Эбола и гриппом[37].
Orthornavirae была создана в 2019 году как царство в реалме Riboviria, предназначенное для размещения всех РНК-вирусов, кодирующих RdRp. До 2019 года Riboviria была создана в 2018 году и включала только RdRp-кодирующие РНК-вирусы. В 2019 году Riboviria были расширены за счет включения вирусов с обратной транскрипцией, помещенных в царство Pararnavirae, поэтому Orthornavirae была создана для отделения РНК-вирусов, кодирующих RdRp, от вирусов с обратной транскрипцией[2][38].
Галерея
[править | править код]-
Parotiditis (Paramyxoviridae) -->
Заметки
[править | править код]Использованная литература
[править | править код]- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ 1 2 3 4 5 6 7 Create a megataxonomic framework, filling all principal taxonomic ranks, for realm Riboviria (англ.). International Committee on Taxonomy of Viruses (ICTV) (18 октября 2019). Дата обращения: 20 августа 2022. Архивировано 15 мая 2020 года.
- ↑ 1 2 Yuri I. Wolf, Darius Kazlauskas, Jaime Iranzo, Adriana Lucía-Sanz, Jens H. Kuhn. Origins and Evolution of the Global RNA Virome (англ.) // mBio / Vincent R. Racaniello. — 2018-12-21. — Vol. 9, iss. 6. — P. e02329–18. — ISSN 2150-7511 2161-2129, 2150-7511. — doi:10.1128/mBio.02329-18. Архивировано 5 июля 2022 года.
- ↑ Viral budding ~ ViralZone. viralzone.expasy.org. Дата обращения: 20 августа 2022. Архивировано 20 августа 2022 года.
- ↑ Paula Tennant. Viruses : molecular biology, host interactions, and applications to biotechnology. — London, 2018. — 1 online resource (xvi, 375 pages) с. — ISBN 978-0-12-811194-9, 0-12-811194-1.
- ↑ Leonid Andronov, Mengting Han, Yanyu Zhu, Ashwin Balaji, Anish R. Roy, Andrew E. S. Barentine, Puja Patel, Jaishree Garhyan, Lei S. Qi, W. E. Moerner. Nanoscale cellular organization of viral RNA and proteins in SARS-CoV-2 replication organelles (англ.) // Nature Communications. — 2024-05-31. — Vol. 15, iss. 1. — P. 4644. — ISSN 2041-1723. — doi:10.1038/s41467-024-48991-x.
- ↑ +RNA virus replication/transcription ~ ViralZone. viralzone.expasy.org. Дата обращения: 20 августа 2022. Архивировано 26 января 2020 года.
- ↑ Subgenomic RNA transcription. ViralZone. Swiss Institute of Bioinformatics. Дата обращения: 6 августа 2020. Архивировано 6 января 2022 года.
- ↑ Negative-stranded RNA virus transcription ~ ViralZone. viralzone.expasy.org. Дата обращения: 20 августа 2022. Архивировано 23 мая 2021 года.
- ↑ Negative stranded RNA virus replication. ViralZone. Swiss Institute of Bioinformatics. Дата обращения: 6 августа 2020. Архивировано 5 мая 2021 года.
- ↑ Cap snatching. ViralZone. Swiss Institute of Bioinformatics. Дата обращения: 6 августа 2020. Архивировано 8 октября 2020 года.
- ↑ Negative-stranded RNA virus polymerase stuttering. ViralZone. Swiss Institute of Bioinformatics. Дата обращения: 6 августа 2020. Архивировано 10 мая 2021 года.
- ↑ Ambisense transcription in negative stranded RNA viruses. ViralZone. Swiss Institute of Bioinformatics. Дата обращения: 6 августа 2020. Архивировано 26 февраля 2021 года.
- ↑ dsRNA replication/transcription ~ ViralZone. viralzone.expasy.org. Дата обращения: 20 августа 2022. Архивировано 20 сентября 2020 года.
- ↑ 1 2 3 4 Rafael Sanjuán, Pilar Domingo-Calap. Mechanisms of viral mutation (англ.) // Cellular and Molecular Life Sciences. — 2016-12. — Vol. 73, iss. 23. — P. 4433–4448. — ISSN 1420-9071 1420-682X, 1420-9071. — doi:10.1007/s00018-016-2299-6.
- ↑ Smith EC (2017-04-27). "The not-so-infinite malleability of RNA viruses: Viral and cellular determinants of RNA virus mutation rates". PLOS Pathog. 13 (4): e1006254. doi:10.1371/journal.ppat.1006254. PMID 28448634.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Highly conserved regions of influenza a virus polymerase gene segments are critical for efficient viral RNA packaging". J Virol. 82 (5): 2295—2304. March 2008. doi:10.1128/JVI.02267-07. PMID 18094182.
- ↑ 1 2 Etienne Simon-Loriere, Edward C. Holmes. Why do RNA viruses recombine? (англ.) // Nature Reviews Microbiology. — 2011-08. — Vol. 9, iss. 8. — P. 617–626. — ISSN 1740-1534 1740-1526, 1740-1534. — doi:10.1038/nrmicro2614. Архивировано 30 июля 2022 года.
- ↑ "Reassortment in segmented RNA viruses: mechanisms and outcomes". Nat Rev Microbiol. 14 (7): 448—460. July 2016. doi:10.1038/nrmicro.2016.46. PMID 27211789.
- ↑ "Mutation rates among RNA viruses". Proc Natl Acad Sci U S A. 96 (24): 13910—13913. 1999-11-23. Bibcode:1999PNAS...9613910D. doi:10.1073/pnas.96.24.13910. PMID 10570172.
- ↑ "RNA Virus Reassortment: An Evolutionary Mechanism for Host Jumps and Immune Evasion". PLOS Pathog. 11 (7): e1004902. 2015-07-09. doi:10.1371/journal.ppat.1004902. PMID 26158697.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Yuri I. Wolf, Darius Kazlauskas, Jaime Iranzo, Adriana Lucía-Sanz, Jens H. Kuhn. Origins and Evolution of the Global RNA Virome (англ.) // mBio / Vincent R. Racaniello. — 2018-12-21. — Vol. 9, iss. 6. — P. e02329–18. — ISSN 2150-7511 2161-2129, 2150-7511. — doi:10.1128/mBio.02329-18. Архивировано 5 июля 2022 года.
- ↑ 1 2 3 Current ICTV Taxonomy Release | ICTV. ictv.global. Дата обращения: 20 августа 2022. Архивировано 20 марта 2020 года.
- ↑ "Origins and Evolution of the Global RNA Virome". mBio. 9 (6): e02329-18. 2018-11-27. doi:10.1128/mBio.02329-18. PMID 30482837.
- ↑ "Re-emergence of bluetongue, African horse sickness, and other orbivirus diseases". Vet Res. 41 (6): 35. December 2010. doi:10.1051/vetres/2010007. PMID 20167199. Архивировано 25 мая 2022. Дата обращения: 15 августа 2020.
- ↑ "Vesicular Stomatitis Virus Transmission: A Comparison of Incriminated Vectors". Insects. 9 (4): 190. 2018-12-11. doi:10.3390/insects9040190. PMID 30544935.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Viruses in bats and potential spillover to animals and humans". Curr Opin Virol. 34: 79—89. February 2019. doi:10.1016/j.coviro.2018.12.007. PMID 30665189.
- ↑ "Historical Perspectives on Flavivirus Research". Viruses. 9 (5): 97. 2017-04-30. doi:10.3390/v9050097. PMID 28468299.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Rift Valley Fever". Clin Lab Med. 37 (2): 285—301. June 2017. doi:10.1016/j.cll.2017.01.004. PMID 28457351.
- ↑ Coronaviruses. — С. 1–23. — ISBN 978-1-4939-2437-0.
- ↑ "Continuing challenges in influenza". Ann N Y Acad Sci. 1323 (1): 115—139. September 2014. Bibcode:2014NYASA1323..115W. doi:10.1111/nyas.12462. PMID 24891213.
- ↑ Virus Taxonomy: 2019 Release. talk.ictvonline.org. International Committee on Taxonomy of Viruses. Дата обращения: 6 августа 2020. Архивировано 20 марта 2020 года.
- ↑ "Top 10 plant viruses in molecular plant pathology". Mol Plant Pathol. 12 (9): 938—954. December 2011. doi:10.1111/j.1364-3703.2011.00752.x. PMID 22017770.
- ↑ "A short biased history of RNA viruses". RNA. 21 (4): 667—669. April 2015. doi:10.1261/rna.049916.115. PMID 25780183. Архивировано 27 февраля 2022. Дата обращения: 6 августа 2020.
- ↑ "Milestones in the Research on Tobacco Mosaic Virus". Philos Trans R Soc Lond B Biol Sci. 354 (1383): 521—529. 1999-03-29. doi:10.1098/rstb.1999.0403. PMID 10212931.
- ↑ "The Importance of Vector Control for the Control and Elimination of Vector-Borne Diseases". PLOS Negl Trop Dis. 14 (1): e0007831. 2020-01-16. doi:10.1371/journal.pntd.0007831. PMID 31945061.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "An Evaluation of Emergency Guidelines Issued by the World Health Organization in Response to Four Infectious Disease Outbreaks". PLOS ONE. 13 (5): e0198125. 2018-05-30. Bibcode:2018PLoSO..1398125N. doi:10.1371/journal.pone.0198125. PMID 29847593.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Gorbalenya; Krupovic, Mart; Siddell, Stuart; Varsani, Arvind; Kuhn, Jens H. Riboviria: establishing a single taxon that comprises RNA viruses at the basal rank of virus taxonomy (англ.) (docx). International Committee on Taxonomy of Viruses (ICTV) (15 октября 2018). Дата обращения: 6 августа 2020. Архивировано 28 октября 2021 года.