Арсенат натрия
| Арсенат натрия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Арсенат натрия |
| Традиционные названия | Мышьяковокислый (орто) натрий |
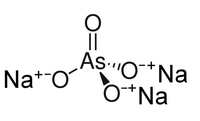
| Хим. формула | Na3AsO4 |
| Физические свойства | |
| Молярная масса | 207,89 г/моль |
| Плотность | 2,835 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | гидр. 86,3 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 19,115,5; 23,430 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13464-38-5 |
| PubChem | 47275 |
| Рег. номер EINECS | 236-682-3 |
| SMILES | |
| InChI | |
| RTECS | CG1100000 |
| ChEBI | 84070 |
| ChemSpider | 43027 |
| Безопасность | |
| Токсичность | ядовит |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Арсенат натрия — неорганическое соединение, соль щелочного металла натрия и мышьяковой кислоты с формулой Na3AsO4, бесцветные кристаллы, растворимые в воде, образуют кристаллогидрат; ядовит.
Получение
[править | править код]- Растворение мышьяка в растворе едкого натра в присутствии окислителей:
- Сплавление триоксида мышьяка с щёлочью и нитратом натрия:
- Растворение пентаоксида мышьяка в концентрированной щёлочи:
- Разложение метаарсенита натрия:
- или его окисление:
Физические свойства
[править | править код]Арсенат натрия образует бесцветные кристаллы.
Хорошо растворяется в воде с частичным гидролизом по аниону.
Образует кристаллогидрат Na3AsO4•12H2O, который плавится в собственной кристаллизационной воде при 86,3°С.
Химические свойства
[править | править код]- При нагревании кристаллогидрат теряет воду:
- В водных растворах поглощает углекислоту:
- С мышьяковой кислотой на холоде образует кристаллогидрат кислой соли:
- Вступает в обменные реакции:
- Является слабым окислителем:
- Применение
- Использовался в медицине как: общеукрепляющее и тонизирующее средство при упадке питания, неврозах, лёгких формах анемии, псориазе
Литература
[править | править код]- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.









