Морфеин
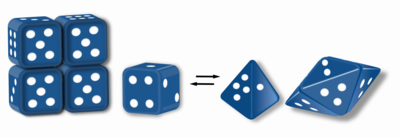
Морфеины - это белки, которые могут образовывать два или более различных гомо-олигомера (формы морфеина), но должны распадаться и изменять форму для преобразования между формами. Альтернативная форма может собираться в другой олигомер. Форма субъединицы определяет, какой олигомер образуется.[1][2] Каждый олигомер имеет конечное число субъединиц (стехиометрия). Морфеины могут взаимодействовать между формами в физиологических условиях и могут существовать в виде равновесия различных олигомеров. Эти олигомеры физиологически релевантны и не являются неправильно свернутым белком; это отличает морфеины от прионов и амилоида. Различные олигомеры обладают различной функциональностью. Взаимопревращение морфеиновых форм может быть структурной основой аллостерической регуляции.[3][4] Мутация, которая изменяет нормальное равновесие форм морфеина, может служить основой для конформационного заболевания.[5] Особенности морфеинов могут быть использованы для открытия лекарств.[6] Изображение кубика (рис.1) представляет собой равновесие морфеина, содержащее две различные мономерные формы, которые диктуют сборку тетрамера или пентамера. Единственным белком, который, как установлено, функционирует как морфеин, является порфобилиногенсинтаза,[7][8] хотя в литературе есть предположения, что другие белки могут функционировать как морфеины (для получения дополнительной информации см. "Таблицу предполагаемых морфеинов" ниже).
Конформационные различия между субъединицами разных олигомеров и связанные функциональные различия морфеина служат отправной точкой для открытия лекарств. Функция белка зависит от олигомерной формы; следовательно, функцию белка можно регулировать, сдвигая равновесие форм. Низкомолекулярное соединение может сдвигать равновесие, блокируя или способствуя образованию одного из олигомеров. Равновесие можно сдвинуть с помощью небольшой молекулы, которая имеет преимущественное сродство связывания только с одной из альтернативных форм морфеина. Задокументирован ингибитор порфобилиногенсинтазы с таким механизмом действия.[3]
Значение для аллостерической регуляции
[править | править код]Морфеиновая модель аллостерической регуляции имеет сходства и отличия от других моделей.[1][4][9] Согласованная модель (модель Monod, Wyman and Changeux (MWC)) аллостерической регуляции требует, чтобы все субъединицы находились в одной и той же конформации или состоянии внутри олигомера, такого как модель морфеина.[10][11] Однако ни эта модель, ни последовательная модель (модель Кошланда, Немети и Филмера) не учитывают, что белок может диссоциировать, чтобы взаимно преобразовываться между олигомерами.[10][11][12][13]
Значение для обучения взаимосвязям "структура-функция" белка
[править | править код]Обычно считается, что аминокислотная последовательность будет иметь только одну физиологически релевантную (нативную) четвертичную структуру; морфеины бросают вызов этой концепции. Модель морфеина не требует серьезных изменений в основной белковой укладке.[1] Конформационные различия, которые сопровождают превращение между олигомерами, могут быть подобны белковым движениям, необходимым для функционирования некоторых белков.[14] Модель морфеина подчеркивает важность конформационной гибкости для функциональности белков и предлагает возможное объяснение белков, демонстрирующих не- "Михаэлис-Ментен" кинетику, гистерезис и / или специфическую активность, зависящую от концентрации белка.[9]
Значение для понимания структурной основы болезни
[править | править код]Термин «конформационное заболевание» обычно включает мутации, которые приводят к неправильной укладке белков, которые агрегируют такие болезни, как болезни Альцгеймера и Крейтцфельдта – Якоба.[15] Однако в свете открытия морфеинов это определение может быть расширено, чтобы включить мутации, которые сдвигают равновесие альтернативных олигомерных форм белка. Примером такого конформационного заболевания является порфирия ALAD, которая возникает в результате мутации порфобилиногенсинтазы, которая вызывает сдвиг в ее морфеиновом равновесии.[5]
Таблица белков, опубликованное поведение которых согласуется с поведением морфеина[16]
[править | править код]Морфеины - это белки, которые могут образовывать два или более различных гомо-олигомера (формы морфеина), но должны распадаться и изменять форму для преобразования между формами. Альтернативная форма может собираться в другой олигомер. Форма субъединицы определяет, какой олигомер образуется.[1][2] Каждый олигомер имеет конечное число субъединиц (стехиометрия). Морфеины могут взаимодействовать между формами в физиологических условиях и могут существовать в виде равновесия различных олигомеров. Эти олигомеры физиологически релевантны и не являются неправильно свернутым белком; это отличает морфеины от прионов и амилоида. Различные олигомеры обладают различной функциональностью. Взаимопревращение морфеиновых форм может быть структурной основой аллостерической регуляции.[3][4] Мутация, которая изменяет нормальное равновесие форм морфеина, может служить основой для конформационного заболевания (Conformational Disease).[5] Особенности морфеинов могут быть использованы для открытия лекарств.[6] Изображение кубика (рис.1) представляет собой равновесие морфеина, содержащее две различные мономерные формы, которые диктуют сборку тетрамера или пентамера. Единственным белком, который, как установлено, функционирует как морфеин, является порфобилиногенсинтаза,[7][8] хотя в литературе есть предположения, что другие белки могут функционировать как морфеины (для получения дополнительной информации см. "Таблицу предполагаемых морфеинов" ниже).
| Белок | Исследуемый вид | Шифр КФ | Номер CAS | Альтернативные олигомеры | Эффект |
|---|---|---|---|---|---|
| Ацетил-КоА карбоксилаза-1 | Gallus domesticus | Шифр КФ 6.4.1.2 | 9023-93-2 | неактивный димер, активный димер, больше[17] | Эффекторные молекулы влияют на мультимеризацию,[18] множественные / совместные функции белков.[17] |
| α-ацетилгалактозаминидаза | Bos taurus | Шифр КФ 4.3.2.2 | 9027-81-0 | неактивный мономер, активный тетрамер[19] | Связывание / обмен субстрата влияет на мультимеризацию,[19] специфическую активность, зависящую от концентрации белка,[20] разные сборки имеют разные активности,[20] конформационно различные олигомерные формы.[19][20] |
| Аденилосукцинатлиаза | Bacillus subtilis | Шифр КФ 4.3.2.2 | 9027-81-0 | мономер, димер, тример, тетрамер[21] | Мутации сдвигают равновесие олигомеров,[22] олигомер-зависимые кинетические параметры,[22] зависимую от концентрации белка молекулярную массу[22] |
| Аристолохенсинтаза | Penicillium roqueforti | Шифр КФ 4.2.3.9 | 94185-89-4 | мономер высшего порядка[23] | Специфическая активность, зависящая от концентрации белка[24] |
| L-аспарагиназа | Leptosphaeria michotii | Шифр КФ 3.5.1.1 | 9015-68-3 | димер, тетрамер, неактивный октамер[25] | Связывание / оборот субстрата влияет на мультимеризацию[26] |
| Аспартокиназа | Escherichia coli | Шифр КФ 2.7.2.4 & Шифр КФ 1.1.1.3 | 9012-50-4 | мономер, димер, тетрамер[27][28] | Множественные / совместные белковые функции,[29]Конформационно отличные олигомерные формы[28] |
| АТФаза транспортера ABCA1 | Homo sapiens | димер, тетрамер[30] | Связывание / оборот субстрата влияет на мультимеризацию.[30] | ||
| Биотин - (ацетил-КоА-карбоксилаза) лигаза голофермент-синтетаза | Escherichia coli | Шифр КФ 6.3.4.15 | 37340-95-7 | мономер, димер[31] | Множественные / совместные белковые функции,[31] У разных сборок разные виды активности[32] |
| Хоризмат мутаза | Escherichia coli | Шифр КФ 5.4.99.5 | 9068-30-8 | димер, тример, гексамер | Конформационно отличные олигомерные формы[33] |
| Цитрат-синтаза | Escherichia coli | Шифр КФ 2.3.3.1 | 9027-96-7 | мономер, димер, тример, тетрамер, пентамер, гексамер, додекамер[34] | Связывание / оборот субстрата влияет на мультимеризацию,[34] характерное равновесие олигомеров,[34] на специфическую активность, зависящую от концентрации белка,[34] на pH-зависимое олигомерное равновесие[34] |
| Циановирин-N | Nostoc ellipsosporum | 918555-82-5 | мономер и димер со сменой доменов[35][36] | Характеризуется равновесием олигомеров,[37][38] конформационно различных олигомерных форм[37][38] | |
| 3-оксоацид КоА-трансфераза | Sus scrofa domestica | Шифр КФ 2.8.3.5 | 9027-43-4 | димер, тетрамер[39] | Хроматографически разделяемые олигомеры,[39] Субстрат может предпочтительно стабилизировать одну форму[39] |
| Цистатионин бета-синтаза | Homo sapiens | Шифр КФ 4.2.1.22 | 9023-99-8 | несколько форм в диапазоне от димера до 16-мера[40] | Эффекторные молекулы влияют на мультимеризацию,[41] Мутации сдвигают равновесие олигомеров,[42] Различные сборки обладают разной активностью,[41] вызывающие болезни-мутации в сайтах, удаленных от активного сайта.[43] |
| Оксидаза D-аминокислот | Шифр КФ 1.4.3.3 | 9000-88-8 | мономеры, димеры, олигомеры высшего порядка[44][45] | Олигомер-зависимые кинетические параметры.[44][45] | |
| Дигидролипоамид-дегидрогеназа | Sus scrofa domestica | Шифр КФ 1.8.1.4 | 9001-18-7 | мономер, две различные формы димера, тетрамер[46] | Множественные / совместные белковые функции,[46] Различные сборки имеют разные активности,[46] pH-зависимое олигомерное равновесие,[46] конформационно различные олигомерные формы.[47][48][49] |
| Дофамин бета-монооксигеназа | Bos taurus | Шифр КФ 1.14.17.1 | 9013-38-1 | димеры, тетрамеры[50][51][52] | Эффекторные молекулы влияют на мультимеризацию,[50][51][52] Характеризованное равновесие олигомеров,[50][51][52] Олигомер-зависимые кинетические параметры[50][51][52] |
| Геранилгеранилпирофосфатсинтаза / Фарнезилтрантрансфераза | Homo sapiens | Шифр КФ 2.5.1.29 | 9032-58-0 | гексамер, октамер[53][54][55] | Эффекторные молекулы влияют на мультимеризацию[54] |
| ГДФ-манноза 6-дегидрогеназа | Pseudomonas aeruginosa | Шифр КФ 1.1.1.132 | 37250-63-8 | тример, 2 тетрамера и гексамер[56][57] | Специфическая активность, зависящая от концентрации белка,[58] кинетический гистерезис[58] |
| Глутаматдегидрогеназа | Bos taurus | Шифр КФ 1.4.1.2 | 9001-46-1 | активные и неактивные гексамеры высшего порядка[59] | Эффекторные молекулы влияют на мультимеризацию,[60] характеризует равновесие олигомеров[59] |
| Глутамат рацемаза | Mycobacterium tuberculosis, Escherichia coli, Bacillus subtilis, Aquifex pyrophilus | Шифр КФ 5.1.1.3 | 9024-08-02 | мономер, 2 димера, тетрамер[61][62][63][64][65] | Множественные / совместные белковые функции,[66][67][68] Характеризованное равновесие олигомеров,[64][65] Конформационно различные олигомерные формы[61][62][63] |
| Глицеральдегид-3-фосфатдегидрогеназа | Oryctolagus cuniculas, Sus scrofa domestica | Шифр КФ 1.2.1.12 | 9001-50-7 | мономер, димер, тетрамер[69] Характеризуемое равновесие олигомеров,[70] У разных форм разные виды активности[71] | |
| Глицерин киназа | Escherichia coli | Шифр КФ 2.7.1.30 | 9030-66-4 | мономер и 2 тетрамера[72][73][74] | Характеризованное равновесие олигомеров,[72][73][74][75] Конформационно отличные олигомерные формы,[75][76] Эффекторные функции, предотвращающие движение домена[76] |
| ВИЧ-интеграза | Human immunodeficiency virus-1 | Шифр КФ 2.7.7.- | мономер, димер, тетрамер, высшего порядка.[77][78][79] | Эффекторные молекулы влияют на мультимеризацию,[80] Множественные / белковые функции совместных действий,[77][78][79] Различные сборки имеют разную активность[79][80] | |
| HPr-киназа / фосфатаза | Bacillus subtilis, Lactobacillus casei, Mycoplasma pneumoniae, Staphylococcus xylosus | Шифр КФ 2.7.1.-/Шифр КФ 3.1.3.- | 9026-43-1 | мономеры, димеры, тримеры, гексамеры[81][82][83][84][85][86] | Эффекторные молекулы влияют на мультимеризацию,[85] множественные / совместные белковые функции,[85] разные сборки имеют разную активность,[85] pH-зависимое олигомерное равновесие[85] |
| Лактатдегидрогеназа | Bacillus stearothermophilus | Шифр КФ 1.1.1.27 | 9001-60-9 | 2 димера, тетрамер[87][88] | Эффекторные молекулы влияют на мультимеризацию,[88] Характеризованное равновесие олигомеров,[88] Специфическую активность, зависящую от концентрации белка,[88] Мутации сдвигают равновесие олигомеров,[89] Олигомер-зависимые кинетические параметры,[88] Конформационно отличные олигомерные формы[90] |
| Lon протеаза | Escherichia coli, Mycobacterium smegmatis | Шифр КФ 3.4.21.53 | 79818-35-2 | мономер, димер, тример, тетрамер[91][92] | Эффекторные молекулы влияют на мультимеризацию,[91][92] связывание / оборот субстрата влияет на мультимеризацию,[91][92] специфическая активность, зависящая от концентрации белка,[93] кинетический гистерезис[93] |
| Митохондриальный НАД (Ф) + яблочный фермент / малатдегидрогеназа (оксалоацетат-декарбоксилирование) (НАДФ +) | Homo sapiens | Шифр КФ 1.1.1.40 | 9028-47-1 | мономер, 2 димера, тетрамер[94][95] | Эффекторные молекулы влияют на мультимеризацию,[94] Мутации сдвигают равновесие олигомеров,[96] Кинетический гистерезис,[95] |
| Пероксиредоксины | Salmonella Typhimurium | Шифр КФ 1.6.4.- & Шифр КФ 1.11.1.15 | 207137-51-7 | 2 димера, декамер | Конформационно различные олигомерные формы,[97] Различные сборки имеют разную активность[98] |
| Фенилаланингидроксилаза | Homo sapiens | Шифр КФ 1.14.16.1 | 9029-73-6 | тетрамер высокой активности, тетрамер низкой активности.[99] | Связывание / оборот субстрата влияет на мультимеризацию,[100][101] конформационно отличные олигомерные формы[102][103] |
| Фосфоенолпируваткарбоксилаза | Escherichia coli, Zea mays | Шифр КФ 4.1.1.31 | 9067-77-0 | неактивный димер, активный тетрамер[104] | Эффекторные молекулы влияют на мультимеризацию, характерное равновесие олигомеров,[104] кинетический гистерезис,[104] конформационно отличные олигомерные формы[105] |
| Фосфофруктокиназа | Bacillus stearothermophilus, Thermus thermophilus | Шифр КФ 2.7.1.11 | 9001-80-3 | неактивный димер, активный тетрамер[104][106] | Эффекторные молекулы влияют на мультимеризацию,[104][106] Характеризуется равновесием олигомеров[104][106] |
| Полифенолоксидаза | Agaricus bisporus, Malus domestica, Lactuca sativa L. | Шифр КФ 1.10.3.1 | 9002-10-2 | мономер, тример, тетрамер, октамер, додекамер[107][108] | Множественные / совместные белковые функции,[109] Связывание / оборот субстрата влияет на мультимеризацию,[110] Различные сборки имеют разную активность,[111] Кинетический гистерезис[110] |
| Порфобилиногенсинтаза | Drosophila melanogaster, Danio rerio | Шифр КФ 4.2.1.24 | 9036-37-7 | димер, гексамер, октамер[112][113] | PBGS - прототип морфеина.[112] |
| Пируваткиназа | Homo sapiens | Шифр КФ 2.7.1.40 | 9001-59-6 | активные и неактивные димеры, активный тетрамер, мономер, тример, пентамер[114][115] | Конформационно отличные олигомерные формы[114][115] |
| Рибонуклеаза А | Bos taurus | Шифр КФ 3.1.27.5 | 9901-99-4 | мономер, димер, тример, тетрамер, гексамер, пентамер высшего порядка[116][117][118][119][120] | Множественные / совместные функции белков,[121][122][123] Различные сборки имеют разные активности,[121][122][123] Конформационно различные олигомерные формы[117][119][120] |
| Рибонуклеотидредуктаза | Mus musculus | Шифр КФ 1.17.4.1 | 9047-64-7 | тетрамер, гексамер[124][125][126][127] | Эффекторные молекулы влияют на мультимеризацию.[127] |
| S-аденозил-L-гомоцистеин гидролаза | Dictyostelium discoideum | Шифр КФ 3.3.1.1 | 9025-54-1 | тетрамер и др.[128][129][130] | Эффекторные молекулы влияют на мультимеризацию.[128] |
| Биодегративная треониндегидратаза / треонинаммиак-лиаза | Escherichia coli | Шифр КФ 4.3.1.19 | 774231-81-1 | 2 мономера, 2 тетрамера[131][132][133] | Эффекторные молекулы влияют на мультимеризацию.,[133] Характерное равновесие олигомеров,[131][132] Различные сборки обладают разной активностью[131][132][133] |
| β-триптаза | Homo sapiens | Шифр КФ 3.4.21.59 | 97501-93-4 | активные и неактивные мономеры, активные и неактивные тетрамеры[134][135][136][137][138][139][140][141][142][143] | Удельная активность, зависящая от концентрации белка,[144] характеризует равновесие олигомеров[144] |
| Фактор некроза опухоли альфа | Homo sapiens | 94948-61-5 | мономер, димер, тример[145][146] | Различные сборки обладают разной активностью[147] | |
| Урацил фосфорибозилтрансфераза | Escherichia coli | Шифр КФ 2.4.2.9 | 9030-24-4 | тример, пентамер[148] | Эффекторные молекулы влияют на мультимеризацию,[148] Связывание / оборот субстрата влияет на мультимеризацию,[148] Различные сборки имеют разную активность[148] |
Примечания
[править | править код]- ↑ 1 2 3 4 Jaffe, Eileen K. (2005). "Morpheeins – a new structural paradigm for allosteric regulation". Trends in Biochemical Sciences. 30 (9): 490–7. doi:10.1016/j.tibs.2005.07.003. PMID 16023348.
- ↑ 1 2 Breinig, Sabine (2003). "Control of tetrapyrrole biosynthesis by alternate quaternary forms of porphobilinogen synthase". Nature Structural Biology. 10 (9): 757–63. doi:10.1038/nsb963. PMID 12897770.
- ↑ 1 2 3 Lawrence, Sarah H. (2008). "Shape Shifting Leads to Small-Molecule Allosteric Drug Discovery". Chemistry & Biology. 15 (6): 586–96. doi:10.1016/j.chembiol.2008.04.012. PMID 18559269.
- ↑ 1 2 3 Selwood, Trevor (2012). "Dynamic dissociating homo-oligomers and the control of protein function". Archives of Biochemistry and Biophysics. 519 (2): 131–43. doi:10.1016/j.abb.2011.11.020. PMID 22182754.
- ↑ 1 2 3 Jaffe, Eileen K. (2007). "ALAD Porphyria is a Conformational Disease". The American Journal of Human Genetics. 80 (2): 329–37. doi:10.1086/511444. PMID 17236137.
- ↑ 1 2 Jaffe, Eileen K. (2010). "Morpheeins – A New Pathway For Allosteric Drug Discovery". The Open Conference Proceedings Journal. 1: 1–6. doi:10.2174/2210289201001010001. PMID 21643557.
- ↑ 1 2 Tang, L. (2005). "Substrate-induced Interconversion of Protein Quaternary Structure Isoforms". Journal of Biological Chemistry. 280 (16): 15786–93. doi:10.1074/jbc.M500218200. PMID 15710608.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 Jaffe, Eileen K. (2012). "Allostery and the dynamic oligomerization of porphobilinogen synthase". Archives of Biochemistry and Biophysics. 519 (2): 144–53. doi:10.1016/j.abb.2011.10.010. PMID 22037356.
- ↑ 1 2 Lawrence, Sarah H. (2008). "Expanding the concepts in protein structure-function relationships and enzyme kinetics: Teaching using morpheeins". Biochemistry and Molecular Biology Education. 36 (4): 274–283. doi:10.1002/bmb.20211. PMID 19578473.
- ↑ 1 2 Monod, Jacques (1963). "Allosteric proteins and cellular control systems". Journal of Molecular Biology. 6 (4): 306–29. doi:10.1016/S0022-2836(63)80091-1. PMID 13936070.
- ↑ 1 2 Monod, Jacque (1965). "On the nature of allosteric transitions: A plausible model". Journal of Molecular Biology. 12: 88–118. doi:10.1016/S0022-2836(65)80285-6. PMID 14343300.
- ↑ D.E. Koshland. 7 The Molecular Basis for Enzyme Regulation (англ.) // The Enzymes. — Elsevier, 1970. — Vol. 1. — P. 341–396. — ISBN 978-0-12-122701-2. — doi:10.1016/s1874-6047(08)60170-5. Архивировано 19 апреля 2022 года.
- ↑ Koshland, D. E. (1966). "Comparison of Experimental Binding Data and Theoretical Models in Proteins Containing Subunits". Biochemistry. 5 (1): 365–85. doi:10.1021/bi00865a047. PMID 5938952.
- ↑ Gerstein, Mark (2004). "Exploring the range of protein flexibility, from a structural proteomics perspective". Current Opinion in Chemical Biology. 8 (1): 14–9. doi:10.1016/j.cbpa.2003.12.006. PMID 15036151.
- ↑ Carrell, Robin W (1997). "Conformational disease". The Lancet. 350 (9071): 134–8. doi:10.1016/S0140-6736(97)02073-4. PMID 9228977.
- ↑ Selwood, Trevor; Jaffe, Eileen K. (2012). "Dynamic dissociating homo-oligomers and the control of protein function". Archives of Biochemistry and Biophysics. 519 (2): 131–43. doi:10.1016/j.abb.2011.11.020. PMC 3298769. PMID 22182754.
- ↑ 1 2 Boone, A.N.; Brownsey, R.W.; Elliott, J.E.; Kulpa, J.E.; Lee, W.M. (2006). "Regulation of acetyl-CoA carboxylase". Biochemical Society Transactions. 34 (2): 223–7. doi:10.1042/BST20060223. PMID 16545081.
- ↑ Shen, Yang; Volrath, Sandra L.; Weatherly, Stephanie C.; Elich, Tedd D.; Tong, Liang (2004). "A Mechanism for the Potent Inhibition of Eukaryotic Acetyl-Coenzyme a Carboxylase by Soraphen A, a Macrocyclic Polyketide Natural Product". Molecular Cell. 16 (6): 881–91. doi:10.1016/j.molcel.2004.11.034. PMID 15610732.
- ↑ 1 2 3 Weissmann, Bernard; Wang, Ching-Te (1971). "Association-dissociation and abnormal kinetics of bovine .alpha.-acetylgalactosaminidase". Biochemistry. 10 (6): 1067–72. doi:10.1021/bi00782a021. PMID 5550813.
- ↑ 1 2 3 Weissmann, Bernard; Hinrichsen, Dorotea F. (1969). "Mammalian α-acetylgalactosaminidase. Occurrence, partial purification, and action on linkages in submaxillary mucins". Biochemistry. 8 (5): 2034–43. doi:10.1021/bi00833a038. PMID 5785223.
- ↑ De Zoysa Ariyananda, Lushanti; Colman, Roberta F. (2008). "Evaluation of Types of Interactions in Subunit Association in Bacillus subtilis Adenylosuccinate Lyase". Biochemistry. 47 (9): 2923–34. doi:10.1021/bi701400c. PMID 18237141.
- ↑ 1 2 3 Palenchar, Jennifer Brosius; Colman, Roberta F. (2003). "Characterization of a Mutant Bacillus subtilis Adenylosuccinate Lyase Equivalent to a Mutant Enzyme Found in Human Adenylosuccinate Lyase Deficiency: Asparagine 276 Plays an Important Structural Role". Biochemistry. 42 (7): 1831–41. doi:10.1021/bi020640+. PMID 12590570.
- ↑ Hohn, Thomas M.; Plattner, Ronald D. (1989). "Purification and characterization of the sesquiterpene cyclase aristolochene synthase from Penicillium roqueforti". Archives of Biochemistry and Biophysics. 272 (1): 137–43. doi:10.1016/0003-9861(89)90204-X. PMID 2544140.
- ↑ Caruthers, J. M.; Kang, I; Rynkiewicz, MJ; Cane, DE; Christianson, DW (2000). "Crystal Structure Determination of Aristolochene Synthase from the Blue Cheese Mold, Penicillium roqueforti". Journal of Biological Chemistry. 275 (33): 25533–9. doi:10.1074/jbc.M000433200. PMID 10825154.
- ↑ Jerebzoff-Quintin, Simonne; Jerebzoff, Stephan (1985). "L-Asparaginase activity in Leptosphaeria michotii. Isolation and properties of two forms of the enzyme". Physiologia Plantarum. 64: 74–80. doi:10.1111/j.1399-3054.1985.tb01215.x.
- ↑ Yun, Mi-Kyung; Nourse, Amanda; White, Stephen W.; Rock, Charles O.; Heath, Richard J. (2007). "Crystal Structure and Allosteric Regulation of the Cytoplasmic Escherichia coli l-Asparaginase I". Journal of Molecular Biology. 369 (3): 794–811. doi:10.1016/j.jmb.2007.03.061. PMC 1991333. PMID 17451745.
- ↑ Garel, J.-R. (1980). "Sequential Folding of a Bifunctional Allosteric Protein". Proceedings of the National Academy of Sciences. 77 (6): 3379–3383. Bibcode:1980PNAS...77.3379G. doi:10.1073/pnas.77.6.3379. JSTOR 8892. PMC 349619. PMID 6774337.
- ↑ 1 2 Kotaka, M.; Ren, J.; Lockyer, M.; Hawkins, A. R.; Stammers, D. K. (2006). "Structures of R- and T-state Escherichia coli Aspartokinase III: MECHANISMS OF THE ALLOSTERIC TRANSITION AND INHIBITION BY LYSINE". Journal of Biological Chemistry. 281 (42): 31544–52. doi:10.1074/jbc.M605886200. PMID 16905770.
- ↑ Ogilvie, JW; Vickers, LP; Clark, RB; Jones, MM (1975). "Aspartokinase I-homoserine dehydrogenase I of Escherichia coli K12 (lambda). Activation by monovalent cations and an analysis of the effect of the adenosine triphosphate-magnesium ion complex on this activation process". The Journal of Biological Chemistry. 250 (4): 1242–50. PMID 163250.
- ↑ 1 2 Trompier, D.; Alibert, M; Davanture, S; Hamon, Y; Pierres, M; Chimini, G (2006). "Transition from Dimers to Higher Oligomeric Forms Occurs during the ATPase Cycle of the ABCA1 Transporter". Journal of Biological Chemistry. 281 (29): 20283–90. doi:10.1074/jbc.M601072200. PMID 16709568.
- ↑ 1 2 Eisenstein, Edward; Beckett, Dorothy (1999). "Dimerization of theEscherichiacoliBiotin Repressor: Corepressor Function in Protein Assembly". Biochemistry. 38 (40): 13077–84. doi:10.1021/bi991241q. PMID 10529178.
- ↑ Streaker, Emily D.; Beckett, Dorothy (1998). "Coupling of Site-Specific DNA Binding to Protein Dimerization in Assembly of the Biotin Repressor−Biotin Operator Complex". Biochemistry. 37 (9): 3210–9. doi:10.1021/bi9715019. PMID 9485476.
- ↑ Vamvaca, Katherina; Butz, Maren; Walter, Kai U.; Taylor, Sean V.; Hilvert, Donald (2005). "Simultaneous optimization of enzyme activity and quaternary structure by directed evolution". Protein Science. 14 (8): 2103–14. doi:10.1110/ps.051431605. PMC 2279322. PMID 15987889.
- ↑ 1 2 3 4 5 Tong, E. K.; Duckworth, Harry W. (1975). "Quaternary structure of citrate synthase from Escherichia coli K 12". Biochemistry. 14 (2): 235–41. doi:10.1021/bi00673a007. PMID 1091285.
- ↑ Bewley, Carole A.; Gustafson, Kirk R.; Boyd, Michael R.; Covell, David G.; Bax, Ad; Clore, G. Marius; Gronenborn, Angela M. (1998). "Solution structure of cyanovirin-N, a potent HIV-inactivating protein". Nature Structural Biology. 5 (7): 571–8. doi:10.1038/828. PMID 9665171.
- ↑ Yang, Fan; Bewley, Carole A; Louis, John M; Gustafson, Kirk R; Boyd, Michael R; Gronenborn, Angela M; Clore, G.Marius; Wlodawer, Alexander (1999). "Crystal structure of cyanovirin-N, a potent HIV-inactivating protein, shows unexpected domain swapping". Journal of Molecular Biology. 288 (3): 403–12. doi:10.1006/jmbi.1999.2693. PMID 10329150.
- ↑ 1 2 Barrientos, LG; Gronenborn, AM (2005). "The highly specific carbohydrate-binding protein cyanovirin-N: Structure, anti-HIV/Ebola activity and possibilities for therapy". Mini Reviews in Medicinal Chemistry. 5 (1): 21–31. doi:10.2174/1389557053402783. PMID 15638789.
- ↑ 1 2 Barrientos, LG; Louis, JM; Botos, I; Mori, T; Han, Z; O'Keefe, BR; Boyd, MR; Wlodawer, A; et al. (2002). "The domain-swapped dimer of cyanovirin-N is in a metastable folded state: Reconciliation of X-ray and NMR structures". Structure. 10 (5): 673–86. doi:10.1016/S0969-2126(02)00758-X. PMID 12015150.
- ↑ 1 2 3 Rochet, Jean-Christophe; Brownie, Edward R.; Oikawa, Kim; Hicks, Leslie D.; Fraser, Marie E.; James, Michael N. G.; Kay, Cyril M.; Bridger, William A.; et al. (2000). "Pig Heart CoA Transferase Exists as Two Oligomeric Forms Separated by a Large Kinetic Barrier". Biochemistry. 39 (37): 11291–302. doi:10.1021/bi0003184. PMID 10985774.
- ↑ Frank, Nina; Kery, Vladimir; MacLean, Kenneth N.; Kraus, Jan P. (2006). "Solvent-Accessible Cysteines in Human Cystathionine β-Synthase: Crucial Role of Cysteine 431 inS-Adenosyl-l-methionine Binding". Biochemistry. 45 (36): 11021–9. doi:10.1021/bi060737m. PMID 16953589.
- ↑ 1 2 Sen, Suvajit; Banerjee, Ruma (2007). "A Pathogenic Linked Mutation in the Catalytic Core of Human Cystathionine β-Synthase Disrupts Allosteric Regulation and Allows Kinetic Characterization of a Full-Length Dimer". Biochemistry. 46 (13): 4110–6. doi:10.1021/bi602617f. PMC 3204387. PMID 17352495.
- ↑ Kery, Vladimir; Poneleit, Loelle; Kraus, Jan P. (1998). "Trypsin Cleavage of Human Cystathionine β-Synthase into an Evolutionarily Conserved Active Core: Structural and Functional Consequences". Archives of Biochemistry and Biophysics. 355 (2): 222–32. doi:10.1006/abbi.1998.0723. PMID 9675031.
- ↑ Shan, Xiaoyin; Kruger, Warren D. (1998). "Correction of disease-causing CBS mutations in yeast". Nature Genetics. 19 (1): 91–3. doi:10.1038/ng0598-91. PMID 9590298.
- ↑ 1 2 Antonini, E; Brunori, M; Bruzzesi, R; Chiancone, E; Massey, V (1966). "Association-dissociation phenomena of D-amino acid oxidase". The Journal of Biological Chemistry. 241 (10): 2358–66. PMID 4380380.
- ↑ 1 2 Massey, V; Curti, B; Ganther, H (1966). "A temperature-dependent conformational change in D-amino acid oxidase and its effect on catalysis". The Journal of Biological Chemistry. 241 (10): 2347–57. PMID 5911617.
- ↑ 1 2 3 4 Babady, N. E.; Pang, Y.-P.; Elpeleg, O.; Isaya, G. (2007). "Cryptic proteolytic activity of dihydrolipoamide dehydrogenase". Proceedings of the National Academy of Sciences. 104 (15): 6158–63. Bibcode:2007PNAS..104.6158B. doi:10.1073/pnas.0610618104. PMC 1851069. PMID 17404228.
- ↑ Muiswinkel-Voetberg, H.; Visser, Jaap; Veeger, Cornelis (1973). "Conformational Studies on Lipoamide Dehydrogenase from Pig Heart. 1. Interconversion of Dissociable and Non-Dissociable Forms". European Journal of Biochemistry. 33 (2): 265–70. doi:10.1111/j.1432-1033.1973.tb02679.x. PMID 4348439.
- ↑ Klyachko, N. L.; Shchedrina, VA; Efimov, AV; Kazakov, SV; Gazaryan, IG; Kristal, BS; Brown, AM (2005). "PH-dependent Substrate Preference of Pig Heart Lipoamide Dehydrogenase Varies with Oligomeric State: RESPONSE TO MITOCHONDRIAL MATRIX ACIDIFICATION". Journal of Biological Chemistry. 280 (16): 16106–14. doi:10.1074/jbc.M414285200. PMID 15710613.
- ↑ Muiswinkel-Voetberg, H.; Veeger, Cornelis (1973). "Conformational Studies on Lipoamide Dehydrogenase from Pig Heart. 2. Spectroscopic Studies on the Apoenzyme and the Monomeric and Dimeric Forms". European Journal of Biochemistry. 33 (2): 271–8. doi:10.1111/j.1432-1033.1973.tb02680.x. PMID 4348440.
- ↑ 1 2 3 4 Saxena, Ashima; Hensley, Preston; Osborne, James C.; Fleming, Patrick J. (1985). "The pH-dependent Subunit Dissociation and Catalytic Activity of Bovine Dopamine β-Hydroxylase". Journal of Biological Chemistry. 260 (6): 3386–92. PMID 3972830.
- ↑ 1 2 3 4 Dhawan, S; Hensley, P; Osborne Jr, JC; Fleming, PJ (1986). "Adenosine 5'-diphosphate-dependent subunit dissociation of bovine dopamine beta-hydroxylase". The Journal of Biological Chemistry. 261 (17): 7680–4. PMID 3711102.
- ↑ 1 2 3 4 Stewart, L C; Klinman, J P (1988). "Dopamine Beta-Hydroxylase of Adrenal Chromaffin Granules: Structure and Function". Annual Review of Biochemistry. 57: 551–92. doi:10.1146/annurev.bi.57.070188.003003. PMID 3052283.
- ↑ Kuzuguchi, T.; Morita, Y; Sagami, I; Sagami, H; Ogura, K (1999). "Human Geranylgeranyl Diphosphate Synthase. CDNA CLONING AND EXPRESSION". Journal of Biological Chemistry. 274 (9): 5888–94. doi:10.1074/jbc.274.9.5888. PMID 10026212.
- ↑ 1 2 Kavanagh, K. L.; Dunford, JE; Bunkoczi, G; Russell, RG; Oppermann, U (2006). "The Crystal Structure of Human Geranylgeranyl Pyrophosphate Synthase Reveals a Novel Hexameric Arrangement and Inhibitory Product Binding". Journal of Biological Chemistry. 281 (31): 22004–12. doi:10.1074/jbc.M602603200. PMID 16698791.
- ↑ Miyagi, Y.; Matsumura, Y.; Sagami, H. (2007). "Human Geranylgeranyl Diphosphate Synthase is an Octamer in Solution". Journal of Biochemistry. 142 (3): 377–81. doi:10.1093/jb/mvm144. PMID 17646172.
- ↑ Snook, Christopher F.; Tipton, Peter A.; Beamer, Lesa J. (2003). "Crystal Structure of GDP-Mannose Dehydrogenase: A Key Enzyme of Alginate Biosynthesis inP. Aeruginosa". Biochemistry. 42 (16): 4658–68. doi:10.1021/bi027328k. PMID 12705829.
- ↑ Roychoudhury, S; May, TB; Gill, JF; Singh, SK; Feingold, DS; Chakrabarty, AM (1989). "Purification and characterization of guanosine diphospho-D-mannose dehydrogenase. A key enzyme in the biosynthesis of alginate by Pseudomonas aeruginosa". The Journal of Biological Chemistry. 264 (16): 9380–5. PMID 2470755.
- ↑ 1 2 Naught, Laura E.; Gilbert, Sunny; Imhoff, Rebecca; Snook, Christopher; Beamer, Lesa; Tipton, Peter (2002). "Allosterism and Cooperativity inPseudomonas aeruginosaGDP-Mannose Dehydrogenase". Biochemistry. 41 (30): 9637–45. doi:10.1021/bi025862m. PMID 12135385.
- ↑ 1 2 Fisher, Harvey F. Glutamate Dehydrogenase—ligand Complexes and Their Relationship to the Mechanism of the Reaction // Advances in Enzymology and Related Areas of Molecular Biology. — 2006. — Vol. 39. — P. 369–417. — ISBN 978-0-470-12284-6. — doi:10.1002/9780470122846.ch6.
- ↑ Huang, CY; Frieden, C (1972). "The mechanism of ligand-induced structural changes in glutamate dehydrogenase. Studies of the rate of depolymerization and isomerization effected by coenzymes and guanine nucleotides". The Journal of Biological Chemistry. 247 (11): 3638–46. PMID 4402280.
- ↑ 1 2 Kim, Sang Suk; Choi, I.-G.; Kim, Sung-Hou; Yu, Y. G. (1999). "Molecular cloning, expression, and characterization of a thermostable glutamate racemase from a hyperthermophilic bacterium, Aquifex pyrophilus". Extremophiles. 3 (3): 175–83. doi:10.1007/s007920050114. PMID 10484173.
- ↑ 1 2 Lundqvist, Tomas; Fisher, Stewart L.; Kern, Gunther; Folmer, Rutger H. A.; Xue, Yafeng; Newton, D. Trevor; Keating, Thomas A.; Alm, Richard A.; et al. (2007). "Exploitation of structural and regulatory diversity in glutamate racemases". Nature. 447 (7146): 817–22. Bibcode:2007Natur.447..817L. doi:10.1038/nature05689. PMID 17568739.
- ↑ 1 2 May, Melissa; Mehboob, Shahila; Mulhearn, Debbie C.; Wang, Zhiqiang; Yu, Huidong; Thatcher, Gregory R.J.; Santarsiero, Bernard D.; Johnson, Michael E.; et al. (2007). "Structural and Functional Analysis of Two Glutamate Racemase Isozymes from Bacillus anthracis and Implications for Inhibitor Design". Journal of Molecular Biology. 371 (5): 1219–37. doi:10.1016/j.jmb.2007.05.093. PMC 2736553. PMID 17610893.
- ↑ 1 2 Taal, Makie A.; Sedelnikova, Svetlana E.; Ruzheinikov, Sergey N.; Baker, Patrick J.; Rice, David W. (2004). "Expression, purification and preliminary X-ray analysis of crystals ofBacillus subtilisglutamate racemase". Acta Crystallographica Section D. 60 (11): 2031–4. doi:10.1107/S0907444904021134. PMID 15502318.
- ↑ 1 2 Kim, Kook-Han; Bong, Young-Jong; Park, Joon Kyu; Shin, Key-Jung; Hwang, Kwang Yeon; Kim, Eunice Eunkyeong (2007). "Structural Basis for Glutamate Racemase Inhibition". Journal of Molecular Biology. 372 (2): 434–43. doi:10.1016/j.jmb.2007.05.003. PMID 17658548.
- ↑ Ashiuchi, M.; Kuwana, E; Yamamoto, T; Komatsu, K; Soda, K; Misono, H (2002). "Glutamate Racemase is an Endogenous DNA Gyrase Inhibitor". Journal of Biological Chemistry. 277 (42): 39070–3. doi:10.1074/jbc.C200253200. PMID 12213801.
- ↑ Ashiuchi, M.; Tani, K.; Soda, K.; Misono, H. (1998). "Properties of Glutamate Racemase from Bacillus subtilis IFO 3336 Producing Poly- -Glutamate". Journal of Biochemistry. 123 (6): 1156–63. doi:10.1093/oxfordjournals.jbchem.a022055. PMID 9604005.
- ↑ Sengupta, S.; Ghosh, S.; Nagaraja, V. (2008). "Moonlighting function of glutamate racemase from Mycobacterium tuberculosis: Racemization and DNA gyrase inhibition are two independent activities of the enzyme". Microbiology. 154 (9): 2796–803. doi:10.1099/mic.0.2008/020933-0. PMID 18757813.
- ↑ Sirover, Michael A (1999). "New insights into an old protein: The functional diversity of mammalian glyceraldehyde-3-phosphate dehydrogenase". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1432 (2): 159–84. doi:10.1016/S0167-4838(99)00119-3. PMID 10407139.
- ↑ Constantinides, SM; Deal Jr, WC (1969). "Reversible dissociation of tetrameric rabbit muscle glyceraldehyde 3-phosphate dehydrogenase into dimers or monomers by adenosine triphosphate". The Journal of Biological Chemistry. 244 (20): 5695–702. PMID 4312250.
- ↑ Kumagai, H; Sakai, H (1983). "A porcine brain protein (35 K protein) which bundles microtubules and its identification as glyceraldehyde 3-phosphate dehydrogenase". Journal of Biochemistry. 93 (5): 1259–69. doi:10.1093/oxfordjournals.jbchem.a134260. PMID 6885722.
- ↑ 1 2 De Riel, Jon K.; Paulus, Henry (1978). "Subunit dissociation in the allosteric regulation of glycerol kinase from Escherichia coli. 2. Physical evidence". Biochemistry. 17 (24): 5141–6. doi:10.1021/bi00617a011. PMID 215195.
- ↑ 1 2 De Riel, Jon K.; Paulus, Henry (1978). "Subunit dissociation in the allosteric regulation of glycerol kinase from Escherichia coli. 1. Kinetic evidence". Biochemistry. 17 (24): 5134–40. doi:10.1021/bi00617a010. PMID 215194.
- ↑ 1 2 De Riel, Jon K.; Paulus, Henry (1978). "Subunit dissociation in the allosteric regulation of glycerol kinase from Escherichia coli. 3. Role in desensitization". Biochemistry. 17 (24): 5146–50. doi:10.1021/bi00617a012. PMID 31903.
- ↑ 1 2 Feese, Michael D; Faber, H Rick; Bystrom, Cory E; Pettigrew, Donald W; Remington, S James (1998). "Glycerol kinase from Escherichia coli and an Ala65→Thr mutant: The crystal structures reveal conformational changes with implications for allosteric regulation". Structure. 6 (11): 1407–18. doi:10.1016/S0969-2126(98)00140-3. PMID 9817843.
- ↑ 1 2 Bystrom, Cory E.; Pettigrew, Donald W.; Branchaud, Bruce P.; O'Brien, Patrick; Remington, S. James (1999). "Crystal Structures ofEscherichia coliGlycerol Kinase Variant S58→W in Complex with Nonhydrolyzable ATP Analogues Reveal a Putative Active Conformation of the Enzyme as a Result of Domain Motion". Biochemistry. 38 (12): 3508–18. doi:10.1021/bi982460z. PMID 10090737.
- ↑ 1 2 Deprez, Eric; Tauc, Patrick; Leh, Hervé; Mouscadet, Jean-François; Auclair, Christian; Brochon, Jean-Claude (2000). "Oligomeric States of the HIV-1 Integrase As Measured by Time-Resolved Fluorescence Anisotropy". Biochemistry. 39 (31): 9275–84. doi:10.1021/bi000397j. PMID 10924120.
- ↑ 1 2 Deprez, E.; Tauc, P.; Leh, H.; Mouscadet, J.-F.; Auclair, C.; Hawkins, M. E.; Brochon, J.-C. (2001). "DNA binding induces dissociation of the multimeric form of HIV-1 integrase: A time-resolved fluorescence anisotropy study". Proceedings of the National Academy of Sciences. 98 (18): 10090–5. Bibcode:2001PNAS...9810090D. doi:10.1073/pnas.181024498. PMC 56920. PMID 11504911.
- ↑ 1 2 3 Faure, A. l.; Calmels, C; Desjobert, C; Castroviejo, M; Caumont-Sarcos, A; Tarrago-Litvak, L; Litvak, S; Parissi, V (2005). "HIV-1 integrase crosslinked oligomers are active in vitro". Nucleic Acids Research. 33 (3): 977–86. doi:10.1093/nar/gki241. PMC 549407. PMID 15718297.
- ↑ 1 2 Guiot, E.; Carayon, K; Delelis, O; Simon, F; Tauc, P; Zubin, E; Gottikh, M; Mouscadet, JF; et al. (2006). "Relationship between the Oligomeric Status of HIV-1 Integrase on DNA and Enzymatic Activity". Journal of Biological Chemistry. 281 (32): 22707–19. doi:10.1074/jbc.M602198200. PMID 16774912.
- ↑ Fieulaine, S.; Morera, S; Poncet, S; Monedero, V; Gueguen-Chaignon, V; Galinier, A; Janin, J; Deutscher, J; et al. (2001). "X-ray structure of HPr kinase: A bacterial protein kinase with a P-loop nucleotide-binding domain". The EMBO Journal. 20 (15): 3917–27. doi:10.1093/emboj/20.15.3917. PMC 149164. PMID 11483495.
- ↑ Márquez, José Antonio; Hasenbein, Sonja; Koch, Brigitte; Fieulaine, Sonia; Nessler, Sylvie; Russell, Robert B.; Hengstenberg, Wolfgang; Scheffzek, Klaus (2002). "Structure of the full-length HPr kinase/phosphatase from Staphylococcus xylosus at 1.95 Å resolution: Mimicking the product/substrate of the phospho transfer reactions". Proceedings of the National Academy of Sciences. 99 (6): 3458–63. Bibcode:2002PNAS...99.3458M. doi:10.1073/pnas.052461499. JSTOR 3058148. PMC 122545. PMID 11904409.
- ↑ Allen, Gregory S.; Steinhauer, Katrin; Hillen, Wolfgang; Stülke, Jörg; Brennan, Richard G. (2003). "Crystal Structure of HPr Kinase/Phosphatase from Mycoplasma pneumoniae". Journal of Molecular Biology. 326 (4): 1203–17. doi:10.1016/S0022-2836(02)01378-5. PMID 12589763.
- ↑ Poncet, Sandrine; Mijakovic, Ivan; Nessler, Sylvie; Gueguen-Chaignon, Virginie; Chaptal, Vincent; Galinier, Anne; Boël, Grégory; Mazé, Alain; et al. (2004). "HPr kinase/phosphorylase, a Walker motif A-containing bifunctional sensor enzyme controlling catabolite repression in Gram-positive bacteria". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1697 (1–2): 123–35. doi:10.1016/j.bbapap.2003.11.018. PMID 15023355.
- ↑ 1 2 3 4 5 Ramstrom, H.; Sanglier, S; Leize-Wagner, E; Philippe, C; Van Dorsselaer, A; Haiech, J (2002). "Properties and Regulation of the Bifunctional Enzyme HPr Kinase/Phosphatase in Bacillus subtilis". Journal of Biological Chemistry. 278 (2): 1174–85. doi:10.1074/jbc.M209052200. PMID 12411438.
- ↑ Jault, J.-M.; Fieulaine, S; Nessler, S; Gonzalo, P; Di Pietro, A; Deutscher, J; Galinier, A (2000). "The HPr Kinase from Bacillus subtilis is a Homo-oligomeric Enzyme Which Exhibits Strong Positive Cooperativity for Nucleotide and Fructose 1,6-Bisphosphate Binding". Journal of Biological Chemistry. 275 (3): 1773–80. doi:10.1074/jbc.275.3.1773. PMID 10636874.
- ↑ Clarke, Anthony R.; Waldman, Adam D.B.; Munro, Ian; Holbrook, J.John (1985). "Changes in the state of subunit association of lactate dehydrogenase from Bacillus stearothermophilus". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 828 (3): 375–9. doi:10.1016/0167-4838(85)90319-X. PMID 3986214.
- ↑ 1 2 3 4 5 Clarke, Anthony R.; Waldman, Adam D.B.; Hart, Keith W.; John Holbrook, J. (1985). "The rates of defined changes in protein structure during the catalytic cycle of lactate dehydrogenase". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 829 (3): 397–407. doi:10.1016/0167-4838(85)90250-X. PMID 4005269.
- ↑ Clarke, Anthony R.; Wigley, Dale B.; Barstow, David A.; Chia, William N.; Atkinson, Tony; Holbrook, J.John (1987). "A single amino acid substitution deregulates a bacterial lactate dehydrogenase and stabilizes its tetrameric structure". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 913 (1): 72–80. doi:10.1016/0167-4838(87)90234-2. PMID 3580377.
- ↑ Cameron, Alexander D.; Roper, David I.; Moreton, Kathleen M.; Muirhead, Hilary; Holbrook, J.John; Wigley, Dale B. (1994). "Allosteric Activation in Bacillus stearothermophilus Lactate Dehydrogenase Investigated by an X-ray Crystallographic Analysis of a Mutant Designed to Prevent Tetramerization of the Enzyme". Journal of Molecular Biology. 238 (4): 615–25. doi:10.1006/jmbi.1994.1318. PMID 8176749.
- ↑ 1 2 3 Roudiak, Stanislav G.; Shrader, Thomas E. (1998). "Functional Role of the N-Terminal Region of the Lon Protease fromMycobacterium smegmatis". Biochemistry. 37 (32): 11255–63. doi:10.1021/bi980945h. PMID 9698372.
- ↑ 1 2 3 Rudyak, Stanislav G.; Brenowitz, Michael; Shrader, Thomas E. (2001). "Mg2+-Linked Oligomerization Modulates the Catalytic Activity of the Lon (La) Protease from Mycobacterium smegmatis". Biochemistry. 40 (31): 9317–23. doi:10.1021/bi0102508. PMID 11478899.
- ↑ 1 2 Vineyard, Diana; Patterson-Ward, Jessica; Lee, Irene (2006). "Single-Turnover Kinetic Experiments Confirm the Existence of High- and Low-Affinity ATPase Sites inEscherichia coliLon Protease". Biochemistry. 45 (14): 4602–10. doi:10.1021/bi052377t. PMC 2515378. PMID 16584195.
- ↑ 1 2 Yang, Zhiru; Lanks, Charles W.; Tong, Liang (2002). "Molecular Mechanism for the Regulation of Human Mitochondrial NAD(P)+-Dependent Malic Enzyme by ATP and Fumarate". Structure. 10 (7): 951–60. doi:10.1016/S0969-2126(02)00788-8. PMID 12121650.
- ↑ 1 2 Gerald e, Edwards; Carlos s, Andreo (1992). "NADP-malic enzyme from plants". Phytochemistry. 31 (6): 1845–57. doi:10.1016/0031-9422(92)80322-6. PMID 1368216.
- ↑ Hsieh, J.-Y.; Chen, S.-H.; Hung, H.-C. (2009). "Functional Roles of the Tetramer Organization of Malic Enzyme". Journal of Biological Chemistry. 284 (27): 18096–105. doi:10.1074/jbc.M109.005082. PMC 2709377. PMID 19416979.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Poole, Leslie B. (2005). "Bacterial defenses against oxidants: Mechanistic features of cysteine-based peroxidases and their flavoprotein reductases". Archives of Biochemistry and Biophysics. 433 (1): 240–54. doi:10.1016/j.abb.2004.09.006. PMID 15581580.
- ↑ Aran, Martin; Ferrero, Diego S.; Pagano, Eduardo; Wolosiuk, Ricardo A. (2009). "Typical 2-Cys peroxiredoxins - modulation by covalent transformations and noncovalent interactions". FEBS Journal. 276 (9): 2478–93. doi:10.1111/j.1742-4658.2009.06984.x. PMID 19476489.
- ↑ Bjørgo, Elisa; De Carvalho, Raquel Margarida Negrão; Flatmark, Torgeir (2001). "A comparison of kinetic and regulatory properties of the tetrameric and dimeric forms of wild-type and Thr427→Pro mutant human phenylalanine hydroxylase". European Journal of Biochemistry. 268 (4): 997–1005. doi:10.1046/j.1432-1327.2001.01958.x. PMID 11179966.
- ↑ Martinez, Aurora; Knappskog, Per M.; Olafsdottir, Sigridur; Døskeland, Anne P.; Eiken, Hans Geir; Svebak, Randi Myrseth; Bozzini, MeriLisa; Apold, Jaran; et al. (1995). "Expression of recombinant human phenylalanine hydroxylase as fusion protein in Escherichia coli circumvents proteolytic degradation by host cell proteases. Isolation and characterization of the wild-type enzyme". The Biochemical Journal. 306 (2): 589–97. doi:10.1042/bj3060589. PMC 1136558. PMID 7887915.
- ↑ Knappskog, Per M.; Flatmark, Torgeir; Aarden, Johanna M.; Haavik, Jan; Martinez, Aurora (1996). "Structure/Function Relationships in Human Phenylalanine Hydroxylase. Effect of Terminal Deletions on the Oligomerization, Activation and Cooperativity of Substrate Binding to the Enzyme". European Journal of Biochemistry. 242 (3): 813–21. doi:10.1111/j.1432-1033.1996.0813r.x. PMID 9022714.
- ↑ Phillips, Robert S.; Parniak, Michael A.; Kaufman, Seymour (1984). "Spectroscopic investigation of ligand interaction with hepatic phenylalanine hydroxylase: Evidence for a conformational change associated with activation". Biochemistry. 23 (17): 3836–42. doi:10.1021/bi00312a007. PMID 6487579.
- ↑ Fusetti, F.; Erlandsen, H; Flatmark, T; Stevens, RC (1998). "Structure of Tetrameric Human Phenylalanine Hydroxylase and Its Implications for Phenylketonuria". Journal of Biological Chemistry. 273 (27): 16962–7. doi:10.1074/jbc.273.27.16962. PMID 9642259.
- ↑ 1 2 3 4 5 6 Wohl, RC; Markus, G (1972). "Phosphoenolpyruvate carboxylase of Escherichia coli. Purification and some properties". The Journal of Biological Chemistry. 247 (18): 5785–92. PMID 4560418.
- ↑ Kai, Yasushi; Matsumura, Hiroyoshi; Izui, Katsura (2003). "Phosphoenolpyruvate carboxylase: Three-dimensional structure and molecular mechanisms". Archives of Biochemistry and Biophysics. 414 (2): 170–9. doi:10.1016/S0003-9861(03)00170-X. PMID 12781768.
- ↑ 1 2 3 Xu, Jing; Oshima, Tairo; Yoshida, Masasuke (1990). "Tetramer-dimer conversion of phosphofructokinase from Thermus thermophilus induced by its allosteric effectors". Journal of Molecular Biology. 215 (4): 597–606. doi:10.1016/S0022-2836(05)80171-8. PMID 2146397.
- ↑ Jolley Jr, RL; Mason, HS (1965). "The Multiple Forms of Mushroom Tyrosinase. Interconversion". The Journal of Biological Chemistry. 240: PC1489—91. PMID 14284774.
- ↑ Jolley Jr, RL; Robb, DA; Mason, HS (1969). "The multiple forms of mushroom tyrosinase. Association-dissociation phenomena". The Journal of Biological Chemistry. 244 (6): 1593–9. PMID 4975157.
- ↑ Mallette, MF; Dawson, CR (1949). "On the nature of highly purified mushroom tyrosinase preparations". Archives of Biochemistry. 23 (1): 29–44. PMID 18135760.
- ↑ 1 2 Chazarra, Soledad; García-Carmona, Francisco; Cabanes, Juana (2001). "Hysteresis and Positive Cooperativity of Iceberg Lettuce Polyphenol Oxidase". Biochemical and Biophysical Research Communications. 289 (3): 769–75. doi:10.1006/bbrc.2001.6014. PMID 11726215.
- ↑ Harel, E.; Mayer, A.M. (1968). "Interconversion of sub-units of catechol oxidase from apple chloroplasts". Phytochemistry. 7 (2): 199–204. doi:10.1016/S0031-9422(00)86315-3.
- ↑ 1 2 Jaffe EK, Lawrence SH (March 2012). "Allostery and the dynamic oligomerization of porphobilinogen synthase". Arch. Biochem. Biophys. 519 (2): 144–53. doi:10.1016/j.abb.2011.10.010. PMC 3291741. PMID 22037356.
- ↑ Breinig S, Kervinen J, Stith L, Wasson AS, Fairman R, Wlodawer A, Zdanov A, Jaffe EK (September 2003). "Control of tetrapyrrole biosynthesis by alternate quaternary forms of porphobilinogen synthase". Nat. Struct. Biol. 10 (9): 757–63. doi:10.1038/nsb963. PMID 12897770.
- ↑ 1 2 Schulz, Ju¨Rgen; Sparmann, Gisela; Hofmann, Eberhard (1975). "Alanine-mediated reversible inactivation of tumour pyruvate kinase caused by a tetramer-dimer transition". FEBS Letters. 50 (3): 346–50. doi:10.1016/0014-5793(75)90064-2. PMID 1116605.
- ↑ 1 2 Ibsen, KH; Schiller, KW; Haas, TA (1971). "Interconvertible kinetic and physical forms of human erythrocyte pyruvate kinase". The Journal of Biological Chemistry. 246 (5): 1233–40. PMID 5545066.
- ↑ Liu, Yanshun; Gotte, Giovanni; Libonati, Massimo; Eisenberg, David (2009). "Structures of the two 3D domain-swapped RNase a trimers". Protein Science. 11 (2): 371–80. doi:10.1110/ps.36602. PMC 2373430. PMID 11790847.
- ↑ 1 2 Gotte, Giovanni; Bertoldi, Mariarita; Libonati, Massimo (1999). "Structural versatility of bovine ribonuclease A. Distinct conformers of trimeric and tetrameric aggregates of the enzyme". European Journal of Biochemistry. 265 (2): 680–7. doi:10.1046/j.1432-1327.1999.00761.x. PMID 10504400.
- ↑ Gotte, Giovanni; Laurents, Douglas V.; Libonati, Massimo (2006). "Three-dimensional domain-swapped oligomers of ribonuclease A: Identification of a fifth tetramer, pentamers and hexamers, and detection of trace heptameric, octameric and nonameric species". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1764 (1): 44–54. doi:10.1016/j.bbapap.2005.10.011. PMID 16310422.
- ↑ 1 2 Gotte, Giovanni; Libonati, Massimo (1998). "Two different forms of aggregated dimers of ribonuclease A". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1386 (1): 106–112. doi:10.1016/S0167-4838(98)00087-9. PMID 9675255.
- ↑ 1 2 Libonati, Massimo; Gotte, Giovanni (2004). "Oligomerization of bovine ribonuclease A: Structural and functional features of its multimers". Biochemical Journal. 380 (2): 311–27. doi:10.1042/BJ20031922. PMC 1224197. PMID 15104538.
- ↑ 1 2 Libonati, M. (2004). "Biological actions of the oligomers of ribonuclease A". Cellular and Molecular Life Sciences. 61 (19–20): 2431–6. doi:10.1007/s00018-004-4302-x. PMID 15526151.
- ↑ 1 2 Libonati, M; Bertoldi, M; Sorrentino, S (1996). "The activity on double-stranded RNA of aggregates of ribonuclease a higher than dimers increases as a function of the size of the aggregates". The Biochemical Journal. 318 (1): 287–90. doi:10.1042/bj3180287. PMC 1217620. PMID 8761484.
- ↑ 1 2 Libonati, M.; Gotte, G.; Vottariello, F. (2008). "A Novel Biological Actions Acquired by Ribonuclease Through Oligomerization". Current Pharmaceutical Biotechnology. 9 (3): 200–9. doi:10.2174/138920108784567308. PMID 18673285.
- ↑ Kashlan, Ossama B.; Cooperman, Barry S. (2003). "Comprehensive Model for Allosteric Regulation of Mammalian Ribonucleotide Reductase: Refinements and Consequences†". Biochemistry. 42 (6): 1696–706. doi:10.1021/bi020634d. PMID 12578384.
- ↑ Kashlan, Ossama B.; Scott, Charles P.; Lear, James D.; Cooperman, Barry S. (2002). "A Comprehensive Model for the Allosteric Regulation of Mammalian Ribonucleotide Reductase. Functional Consequences of ATP- and dATP-Induced Oligomerization of the Large Subunit†". Biochemistry. 41 (2): 462–74. doi:10.1021/bi011653a. PMID 11781084.
- ↑ Eriksson, Mathias; Uhlin, Ulla; Ramaswamy, S; Ekberg, Monica; Regnström, Karin; Sjöberg, Britt-Marie; Eklund, Hans (1997). "Binding of allosteric effectors to ribonucleotide reductase protein R1: Reduction of active-site cysteines promotes substrate binding". Structure. 5 (8): 1077–92. doi:10.1016/S0969-2126(97)00259-1. PMID 9309223.
- ↑ 1 2 Fairman, James Wesley; Wijerathna, Sanath Ranjan; Ahmad, Md Faiz; Xu, Hai; Nakano, Ryo; Jha, Shalini; Prendergast, Jay; Welin, R Martin; et al. (2011). "Structural basis for allosteric regulation of human ribonucleotide reductase by nucleotide-induced oligomerization". Nature Structural & Molecular Biology. 18 (3): 316–22. doi:10.1038/nsmb.2007. PMC 3101628. PMID 21336276.
- ↑ 1 2 Hohman, R.J.; Guitton, M.C.; Véron, M. (1984). "Purification of S-adenosyl-l-homocysteine hydrolase from Dictyostelium discoideum: Reversible inactivation by cAMP and 2′-deoxyadenosine". Archives of Biochemistry and Biophysics. 233 (2): 785–95. doi:10.1016/0003-9861(84)90507-1. PMID 6091559.
- ↑ Guranowski, Andrzej; Pawelkiewicz, Jerzy (1977). "Adenosylhomocysteinase from Yellow Lupin Seeds. Purification and Properties". European Journal of Biochemistry. 80 (2): 517–23. doi:10.1111/j.1432-1033.1977.tb11907.x. PMID 923592.
- ↑ Kajander, EO; Raina, AM (1981). "Affinity-chromatographic purification of S-adenosyl-L-homocysteine hydrolase. Some properties of the enzyme from rat liver". The Biochemical Journal. 193 (2): 503–12. doi:10.1042/bj1930503. PMC 1162632. PMID 7305945.
- ↑ 1 2 3 Saeki, Y; Ito, S; Shizuta, Y; Hayaishi, O; Kagamiyama, H; Wada, H (1977). "Subunit structure of biodegradative threonine deaminase". The Journal of Biological Chemistry. 252 (7): 2206–8. PMID 321452.
- ↑ 1 2 3 Phillips, A.T.; Wood, W.A. (1964). "Basis for AMP activation of "Biodegradative" threonine dehydrase from". Biochemical and Biophysical Research Communications. 15 (6): 530–535. doi:10.1016/0006-291X(64)90499-1.
- ↑ 1 2 3 Gerlt, JA; Rabinowitz, KW; Dunne, CP; Wood, WA (1973). "The mechanism of action of 5'-adenylic acid-activated threonine dehydrase. V. Relation between ligand-induced allosteric activation and the protomeroligomer interconversion". The Journal of Biological Chemistry. 248 (23): 8200–6. PMID 4584826.
- ↑ Addington, Adele K.; Johnson, David A. (1996). "Inactivation of Human Lung Tryptase: Evidence for a Re-Activatable Tetrameric Intermediate and Active Monomers". Biochemistry. 35 (42): 13511–8. doi:10.1021/bi960042t. PMID 8885830.
- ↑ Fajardo, Ignacio; Pejler, Gunnar (2003). "Formation of active monomers from tetrameric human β-tryptase". Biochemical Journal. 369 (3): 603–10. doi:10.1042/BJ20021418. PMC 1223112. PMID 12387726.
- ↑ Fukuoka, Yoshihiro; Schwartz, Lawrence B. (2004). "Human β-Tryptase: Detection and Characterization of the Active Monomer and Prevention of Tetramer Reconstitution by Protease Inhibitors". Biochemistry. 43 (33): 10757–64. doi:10.1021/bi049486c. PMID 15311937.
- ↑ Fukuoka, Y; Schwartz, LB (2006). "The B12 anti-tryptase monoclonal antibody disrupts the tetrameric structure of heparin-stabilized beta-tryptase to form monomers that are inactive at neutral pH and active at acidic pH". Journal of Immunology. 176 (5): 3165–72. doi:10.4049/jimmunol.176.5.3165. PMC 1810230. PMID 16493076.
- ↑ Fukuoka, Yoshihiro; Schwartz, Lawrence B. (2007). "Active monomers of human β-tryptase have expanded substrate specificities". International Immunopharmacology. 7 (14): 1900–8. doi:10.1016/j.intimp.2007.07.007. PMC 2278033. PMID 18039527.
- ↑ Hallgren, J.; Spillmann, D; Pejler, G (2001). "Structural Requirements and Mechanism for Heparin-induced Activation of a Recombinant Mouse Mast Cell Tryptase, Mouse Mast Cell Protease-6. FORMATION OF ACTIVE TRYPTASE MONOMERS IN THE PRESENCE OF LOW MOLECULAR WEIGHT HEPARIN". Journal of Biological Chemistry. 276 (46): 42774–81. doi:10.1074/jbc.M105531200. PMID 11533057.
- ↑ Schechter, Norman M.; Choi, Eun-Jung; Selwood, Trevor; McCaslin, Darrell R. (2007). "Characterization of Three Distinct Catalytic Forms of Human Tryptase-β: Their Interrelationships and Relevance". Biochemistry. 46 (33): 9615–29. doi:10.1021/bi7004625. PMID 17655281.
- ↑ Schechter, Norman M.; Eng, Grace Y.; Selwood, Trevor; McCaslin, Darrell R. (1995). "Structural Changes Associated with the Spontaneous Inactivation of the Serine Proteinase Human Tryptase". Biochemistry. 34 (33): 10628–38. doi:10.1021/bi00033a038. PMID 7654717.
- ↑ Schwartz, Lawrence B. [6] Tryptase: A mast cell serine protease // Proteolytic Enzymes: Serine and Cysteine Peptidases. — 1994. — Vol. 244. — P. 88–100. — ISBN 978-0-12-182145-6. — doi:10.1016/0076-6879(94)44008-5.
- ↑ Strik, Merel C. M.; Wolbink, Angela; Wouters, Dorine; Bladergroen, Bellinda A.; Verlaan, Angelique R.; van Houdt, Inge S.; Hijlkema, Sanne; Hack, C. Erik; et al. (2004). "Intracellular serpin SERPINB6 (PI6) is abundantly expressed by human mast cells and forms complexes with β-tryptase monomers". Blood. 103 (7): 2710–7. doi:10.1182/blood-2003-08-2981. PMID 14670919.
- ↑ 1 2 Kozik, Andrzej; Potempa, Jan; Travis, James (1998). "Spontaneous inactivation of human lung tryptase as probed by size-exclusion chromatography and chemical cross-linking: Dissociation of active tetrameric enzyme into inactive monomers is the primary event of the entire process". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1385 (1): 139–48. doi:10.1016/S0167-4838(98)00053-3. PMID 9630576.
- ↑ Alzani, R.; Cozzi, E.; Corti, A.; Temponi, M.; Trizio, D.; Gigli, M.; Rizzo, V. (1995). "Mechanism of suramin-induced deoligomerization of tumor necrosis factor .alpha". Biochemistry. 34 (19): 6344–50. doi:10.1021/bi00019a012. PMID 7756262.
- ↑ Corti, A; Fassina, G; Marcucci, F; Barbanti, E; Cassani, G (1992). "Oligomeric tumour necrosis factor alpha slowly converts into inactive forms at bioactive levels". The Biochemical Journal. 284 (3): 905–10. doi:10.1042/bj2840905. PMC 1132625. PMID 1622406.
- ↑ Hlodan, Roman; Pain, Roger H. (1995). "The Folding and Assembly Pathway of Tumour Necrosis Factor TNFalpha, a Globular Trimeric Protein". European Journal of Biochemistry. 231 (2): 381–7. doi:10.1111/j.1432-1033.1995.tb20710.x. PMID 7635149.
- ↑ 1 2 3 4 Jensen, Kaj Frank; Mygind, Bente (1996). "Different Oligomeric States are Involved in the Allosteric Behavior of Uracil Phosphoribosyltransferase from Escherichia Coli". European Journal of Biochemistry. 240 (3): 637–45. doi:10.1111/j.1432-1033.1996.0637h.x. PMID 8856065.