குளோரின் பெர்குளோரேட்டு
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
குளோரிம் பெர்குளோரேட்டு
| |||
| முறையான ஐயூபிஏசி பெயர்
குளோரோ ஒஎர்குளோரேட்டு[1] | |||
| வேறு பெயர்கள்
குளோரின்(I,VII)ஆக்சைடு
இருகுளோரின்நான்காக்சைடு | |||
| இனங்காட்டிகள் | |||
| 27218-16-2 | |||
| ChemSpider | 147540 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 168667 | ||
| |||
| பண்புகள் | |||
| Cl2O4 | |||
| வாய்ப்பாட்டு எடை | 134.90 g·mol−1 | ||
| தோற்றம் | வெளிர் பச்சை திரவம் | ||
| அடர்த்தி | 1.81 கி செ.மீ−3 | ||
| உருகுநிலை | −117 °C (−179 °F; 156 K) | ||
| கொதிநிலை | 20 °C (68 °F; 293 K) (சிதைவடையும்) | ||
| வினைபுரியும் | |||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிசனேற்றி | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
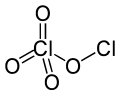
குளோரின் பெர்குளோரேட்டு (Chlorine perchlorate) என்பது Cl2O4. என்ற மூலக்கூற்று வாய்ப்பாடுடன் கூடிய ஒரு வேதிச் சேர்மம்|வேதிச் சேர்மமாகும்]]. குளோரினின் இந்த ஆக்சைடு ஒரு சமச்சீரற்ற ஆக்சைடு ஆகும். ஏனெனில் இதிலுள்ள குளோரின் அணுக்களில் ஒன்று +1 ஆக்சிசனேற்ற நிலையிலும் மற்றோரு குளோரின் அணு +7 ஆக்சிசனேற்ற நிலையிலும் உள்ளன. இதனுடைய சரியான மூலக்கூறை எழுத வேண்டுமெனில் ClOClO3. என்று எழுதலாம்.அறை வெப்பநிலையில் குளோரின் ஈராக்சைடு| ஈராக்சைடை 436 நா.மீ புறஊதா ஒளியில் ஒளிச்சிதைவுக்கு உட்படுத்தினால் குளோரின் பெர்குளோரேட்டு உண்டாகிறது:[2][3]
- 2 ClO2 → ClOClO3
−45 °செ வெப்பநிலையில் பின்வரும் முறையிலும் பெர்குளோரேட்டைத் தயாரிக்க முடியும்.
- CsClO4 + ClOSO2F → Cs(SO3)F + ClOClO3
வெளிர் பச்சைநிறத் திரவமான குளோரின் பெர்குளோரேட்டு அறை வெப்பநிலையில் சிதைவடைகிறது.
பண்புகள்
[தொகு]குளோரின் ஈராக்சைடைக் காட்டிலும் இது நிலைப்புத் தன்மை மிக்கது ஆகும். மற்றுமிது அறைவெப்ப நிலையில் ஆக்சிசன், குளோரின் மற்றும் இருகுளோரின் அறுவாக்சைடுகளாகச் சிதைவடைகிறது.
உலோக குளோரைடுகளுடன் குளோரின் பெர்குளோரேட்டு வினைபுரிந்து நீரற்ற பெர்குளோரேட்டுகளாக மாறுகிறது.
- CrO2Cl2 + 2 ClOClO3 → 2 Cl2 + CrO2(ClO4)2
- TiCl4 + 4 ClOClO3 → 4 Cl2 + Ti(ClO4)4
மேற்கோள்கள்
[தொகு]- ↑ "Chloro Perchlorate - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ↑ A. J. Schell-Sorokin, D. S. Bethune, J. R. Lankard, M. M. T. Loy, P. P. Sorokin (1982). "Chlorine perchlorate a major photolysis product of chlorine dioxide". J. Phys. Chem. 86 (24): 4653–4655. doi:10.1021/j100221a001.
- ↑ M. I. Lopez, J. E. Sicre (1988). "Ultraviolet spectrum of chlorine perchlorate". J. Phys. Chem. 92 (2): 563–564. doi:10.1021/j100313a062.