டஃப் வினை
கரிம வேதியியலில் டஃப் வினை (Duff reaction) அல்லது எக்சாஅமீன் அரோமாட்டிக் பார்மைலேற்றம் (hexamine aromatic formylation) என்னும் பார்மைலேற்ற வினை பொதுவாக எக்சா அமீனை பார்மைல் கார்பன் அளிக்கும் மூலமாகக் கொண்டு தொகுப்பு முறையில் பென்சால்டிகைடுகள் தயாரிக்கப் பயன்படுத்துகிறார்கள்.[1][2][3][4][5][6] பர்மிங்காம் நகரிலுள்ள தொழில் நுட்பக் கல்லூரியில் 1920 – 1950 காலகட்டத்தில் வேதியியலாளாராக இருந்த சேம்சு கூப்பர் டஃப் இதைக் கண்டறிந்ததால், ட்ஃப் வினையென்று அவர் பெயரால் இவ்வினை அழைக்கப்படுகிறது.
இலத்திரன்கவர் அரோமாட்டிக் பதிலீட்டு வினையான இவ்வினையில் இமீனியம் அயனி (CH2+NR2) இலத்திரன்கவர் சிறப்பினமாகச் செயல்படுகிறது. இவ்வினையின் முதல் படியில் இமீனியம் வினைவிளை பொருளாக உருவாகிறது. அடுத்தநிலையில் இது நீராற்பகுப்பு அடைந்து ஆல்டிகைடாக மாறுகிறது. வினைவழிமுறை கீழே தரப்பட்டுள்ளது. பீனால் போன்ற பதிலீடு செய்யப்பட்ட வலுவான இலத்திரன் வழங்கிகள் அரோமாட்டிக் வளையத்தில் இருக்கவேண்டும் என்பதே இவ்வினைக்கான முக்கியமான தேவையாகும். இலத்திரன் வழங்கும் பதிலியின் ஆர்த்தோ நிலையில் பார்மைலேற்றம் பெரும்பாலும் நிகழ்கிறது. இல்லையெனில் ஆர்த்தோ நிலை மூடப்பட்டு பாரா நிலையில் பார்மைலேற்றம் நிகழ்கிறது.[7]
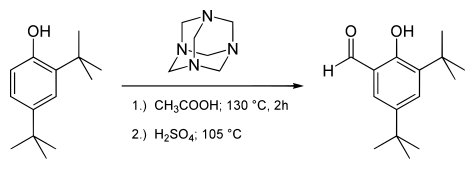
3,5 டை-டெர்ட்-பியூட்டைல் சாலிசிலால்டிகைடு தயாரிக்கப்படும் தொகுப்புவினை இதற்குரிய எடுத்துக்காட்டாகும்:[8].
மற்றும் தொகுப்புமுறையில் சிரிங்கால்டிகைடு தயாரித்தல் :[9]

எக்சாமீன் , வினையின் முதல் படியாக அரோமாட்டிக் அடி மூலக்கூறுக்கு தொடர்ச்சியான சமநிலை வினைகள் வழியாக மீத்தைன் தொகுதியை வழங்குகிறது. இதன் விளைவாக இமினியம் இடைநிலைச் சேர்மம் தோன்றுகிறது. ஆரம்பநிலையில், பென்சைலமின் சேர்மத்தின் ஆக்சிசனேற்ற நிலையில் அரோமாட்டிக் வளையம் மேலும் கூடுவதால் இடைநிலைச் சேர்மம் உருவாகிறது. மூலக்கூறிடை ஒடுக்க ஏற்ற வினையின் விளைவாக ஆல்டிகைடின் ஆக்சிசனேற்ற நிலையில் பென்சைல் வகை கார்பன் உயர்கிறது. இறுதிநிலையில் தண்ணீரின் அமில நீராற்பகுப்பு வழியாக இவ்வினைக்குத் தேவையான ஆக்சிசன் வழங்கப்படுகிறது.

மேற்கோள்கள்
[தொகு]- ↑ Duff, J. C.; Bills, E. J. (1932). "273. Reactions between hexamethylenetetramine and phenolic compounds. Part I. A new method for the preparation of 3- and 5-aldehydosalicylic acids". J. Chem. Soc.: 1987. doi:10.1039/jr9320001987.
- ↑ Duff, J. C.; Bills, E. J. (1934). "282. Reactions between hexamethylenetetramine and phenolic compounds. Part II. Formation of phenolic aldehydes. Distinctive behaviour of p-nitrophenol". J. Chem. Soc.: 1305. doi:10.1039/jr9340001305.
- ↑ Duff, J. C.; Bills, E. J. (1941). "96. A new general method for the preparation of o-hydroxyaldehydes from phenols and hexamethylenetetramine". J. Chem. Soc.: 547. doi:10.1039/jr9410000547.
- ↑ Duff, J. C.; Bills, E. J. (1945). "71. A new method for the preparation of p-dialkylaminobenzaldehydes". J. Chem. Soc.: 276. doi:10.1039/jr9450000276.
- ↑ Ferguson, L. N. (1946). "The Synthesis of Aromatic Aldehydes". Chem. Rev. 38 (2): 227–254. doi:10.1021/cr60120a002. பப்மெட்:21024865.
- ↑ Ogata, Y.; Sugiura, F. (1968). "Kinetics and mechanism of the Duff reaction". Tetrahedron 24 (14): 5001. doi:10.1016/S0040-4020(01)88408-8.
- ↑ Mundy, Bradford P.; Ellerd, Michael G.; Favaloro, Frank G. (2005). Name Reactions and Reagents in Organic Synthesis, 2nd Edition, John Wiley & Sons, பக். 222 – 223.
- ↑ 3,5-Di-tert-butylsalicylaldehyde in Organic Syntheses Coll. Vol. 10, p. 96; Vol. 75, p. 1 (Article)
- ↑ C. F. H. Allen and Gerhard W. Leubner (1963). "Syringic aldehyde". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv4p0866.; Collective Volume, vol. 4, p. 866
- ↑ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7