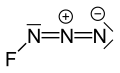புளோரின் அசைடு
| |||
| பெயர்கள் | |||
|---|---|---|---|
| வேறு பெயர்கள்
டிரையசாடையீனைல் புளோரைடு
| |||
| இனங்காட்டிகள் | |||
| 14986-60-8 | |||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 23235952 | ||
| |||
| பண்புகள் | |||
| FN3 | |||
| வாய்ப்பாட்டு எடை | 61.019 கி/மோல் | ||
| தோற்றம் | மஞ்சள் பச்சை வாயு | ||
| உருகுநிலை | −139 °C (−218 °F; 134 K) | ||
| கொதிநிலை | −30 °C (−22 °F; 243 K) | ||
| Explosive data | |||
| Shock sensitivity | அதிகம் | ||
| Friction sensitivity | அதிகம் | ||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | அதிக வெடிப்பு | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய நேர் மின்அயனிகள் | ஐதரசோயிக் அமிலம் குளோரின் அசைடு புரோமின் அசைடு அயோடின் அசைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
புளோரின் அசைடு (Fluorine azide) என்பது FN3 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிமச் சேர்மமாகும்.[1] டிரையசாடையீனைல் புளோரைடு என்ற பெயராலும் இது அழைக்கப்படுகிறது. நைட்ரசனும் புளோரினும் சேர்ந்து இச்சேர்மம் உருவாகிறது. ClN3, BrN3, மற்றும் IN3 போன்ற சேர்மங்களின் பண்புகளை புளோரின் அசைடும் வெளிப்படுத்துகிறது.[2] புளோரின் அணுவிற்கும் நைட்ரசனுக்கும் இடையிலான பிணைப்பு மிகவும் பலவீனமாக இருக்கிறது. இதனால் இந்த சேர்மம் மிகவும் நிலையற்றதாகவும் வெடிப்புக்கு ஆளாகக்கூடியதாகவும் உள்ளது.[3] கணக்கீடுகள் F-N-N கோணமானது 3 நைட்ரசன் அணுக்களின் நேர்கோட்டுடன் 102° ஆக இருப்பதைக் காட்டுகிறது.[4]
புளோரின் அசைடு –30° செல்சியசு வெப்பநிலையில் கொதிக்கத் தொடங்கும். –139° செல்சியசு வெப்பநிலையில் உருகத் தொடங்கும்.[5]
முதன் முதலில் ஜான் எஃப். ஆலர் என்பவரால் புளோரின் அசைடு உருவாக்கப்பட்டது.[6]
தயாரிப்பு
[தொகு]புளோரின் வாயுவுடன் ஐதரசோயிக் அமிலம் அல்லது சோடியம் அசைடைச் சேர்த்து வினைபுரியச் செய்தால் புளோரின் அசைடை உருவாக்கலாம்.[5][7]
- HN3 + F2 → N3F + HF
- NaN3 + F2 → N3F + NaF
வேதிப் பண்புகள்
[தொகு]புளோரின் அசைடு சாதாரண வெப்பநிலையில் வெடிக்காமல் சிதைந்து இருநைட்ரசன் இருபுளோரைடை உருவாக்குகிறது.
- 2FN3 → N2F2 + 2 N2.[1]
1000 பாகை செல்சியசு போன்ற அதிக வெப்பநிலையில் புளோரின் அசைடு, நைட்ரசன் மோனோபுளோரைடு இயங்குறுப்பாக உடைகிறது.:[7]
- FN3 → NF + N2
FN தானே குளிர்ச்சியடைந்து இருபடி சேர்மமாகிறது.
- 2 NF → N2F2
திண்ம அல்லது நீர்ம FN3 வெடித்து, அதிக அளவு ஆற்றலை வெளியிடும். ஒரு மெல்லிய படலம் 1.6 கிமீ/வி வேகத்தில் எரிகிறது. [8]வெடிப்பு அபாயம் காரணமாக, இந்த பொருளின் மிகக் குறைந்த அளவு மட்டுமே ஒரு நேரத்தில் கையாளப்பட வேண்டும்.[9]
போரான் முப்புளோரைடு (BF3) மற்றும் ஆர்சனிக் பெண்டாபுளோரைடு (AsF5) போன்ற இலூயிசு அமிலங்களுடன் -196 °செல்சியசு வெப்பநிலையில் FN3 கூட்டுசேர் பொருள்கள் உருவாகின்றன. இந்த மூலக்கூறுகள் Nα அணுவுடன் பிணைக்கப்படுகின்றன.[10]
இயற்பியல் பண்புகள்
[தொகு]- நிறமாலையியல்
| அளவுருக்கள் | மதிப்பு[9] | அலகு |
| A | 48131.448 | மெகா எர்ட்சு |
| B | 5713.266 | மெகா எர்ட்சு |
| C | 5095.276 | மெகா எர்ட்சு |
| μa | 1.1 | |
| μb | 0.7 |
- வடிவம்
அணுக்களுக்கு இடையிலான தூரம் F-N 0.1444 நானோமீட்டர், FN=NN 0.1253 நானோமீட்டர் மற்றும் FNN=N 0.1132 நானோமீட்டர் ஆகும்.[9]
- இயற்பியல்
புளோரின் அசைடு சேர்மத்தின் அடர்த்தி 1.3 கி/செ.மீ.[11] பொட்டாசியம் புளோரைடின் திண்மப் பரப்புகளில் புளோரின் அசைடு உறிஞ்சுகிறது, ஆனால் இலித்தியம் புளோரைடு அல்லது சோடியம் புளோரைடு பரப்புகளின் மீது உறிஞ்சப்படுவதில்லை. திண்ம உந்துசக்திகளின் ஆற்றலை அதிகரிக்க புளோரின் அசைடின் இந்த பண்பு ஆய்வு செய்யப்படுகிறது.[11]
புற ஊதா ஒளிமின்னழுத்த நிறமாலை அயனியாக்கம் உச்சநிலையை 11.01, 13,72, 15.6, 15.9, 16.67, 18.2 மற்றும் 19.7 எலக்ட்ரான் வோல்ட்டு எனக் காட்டுகிறது. முறையே இவை π, nN அல்லது nF, nF, πF, nN அல்லது σ, π மற்றும் σ. என சுற்றுப்பாதைகளுக்கு ஒதுக்கப்படுகின்றன:[3]
மேற்கோள்கள்
[தொகு]- ↑ 1.0 1.1 Gipstein, Edward; John F. Haller (1966). "Absorption Spectrum of Fluorine Azide". Applied Spectroscopy 20 (6): 417–418. doi:10.1366/000370266774386470. பன்னாட்டுத் தர தொடர் எண்:0003-7028. Bibcode: 1966ApSpe..20..417G.
- ↑ Saxena, P. B. (2007-01-01). Chemistry of Interhalogen Compounds. Discovery Publishing House. p. 96. பன்னாட்டுத் தரப்புத்தக எண் 9788183562430. பார்க்கப்பட்ட நாள் 16 June 2014.
- ↑ 3.0 3.1 Rademacher, Paul; Andreas J. Bittner; Gabriele Schatte; Helge Willner (1988). "Photoelectron Spectrum and Electronic Structure of Triazadienyl Fluoride, N3F". Chemische Berichte 121 (3): 555–557. doi:10.1002/cber.19881210325. பன்னாட்டுத் தர தொடர் எண்:0009-2940.
- ↑ Peters, Nancy J. S.; Leland C. Allen; Raymond A. Firestone (1988). "Fluorine azide and fluorine nitrate: structure and bonding". Inorganic Chemistry 27 (4): 755–758. doi:10.1021/ic00277a035. பன்னாட்டுத் தர தொடர் எண்:0020-1669.
- ↑ 5.0 5.1 Gholivand, Khodayar; Gabriele Schatte; Helge Willner (1987). "Properties of triazadienyl fluoride, N3F". Inorganic Chemistry 26 (13): 2137–2140. doi:10.1021/ic00260a025. பன்னாட்டுத் தர தொடர் எண்:0020-1669.
- ↑ Lowe, Derek (21 October 2008). "Things I Won't Work With: Triazadienyl Fluoride". In the Pipeline. பார்க்கப்பட்ட நாள் 15 June 2014.
- ↑ 7.0 7.1 Benard, D. J.; B. K. Winker; T. A. Seder; R. H. Cohn (1989). "Production of nitrogen monofluoride (a1Δ) by dissociation of fluorine azide". The Journal of Physical Chemistry 93 (12): 4790–4796. doi:10.1021/j100349a022. பன்னாட்டுத் தர தொடர் எண்:0022-3654.
- ↑ Seder, T.A.; D.J. Benard (1991). "The decomposition of condensed phase fluorine azide". Combustion and Flame 85 (3–4): 353–362. doi:10.1016/0010-2180(91)90139-3. பன்னாட்டுத் தர தொடர் எண்:0010-2180.
- ↑ 9.0 9.1 9.2 Christen, Dines.; H. G. Mack; G. Schatte; H. Willner (1988). "Structure of triazadienyl fluoride, FN3, by microwave, infrared, and ab initio methods". Journal of the American Chemical Society 110 (3): 707–712. doi:10.1021/ja00211a007. பன்னாட்டுத் தர தொடர் எண்:0002-7863.
- ↑ Schatte, G.; H. Willner (1991). "Die Wechselwirkung von N3F mit Lewis-Säuren und HF. N3F als möglicher Vorläufer für die Synthese von N3+-Salzen = The interaction of N3F with Lewis acids and HF•N3F as possible precursor for the synthesis of N3+ salts" (in de). Zeitschrift für Naturforschung B 46 (4): 483–489. doi:10.1515/znb-1991-0410. பன்னாட்டுத் தர தொடர் எண்:0932-0776.
- ↑ 11.0 11.1 Brener, Nathan E.; Kestner, Neil R.; Callaway, Joseph (December 1990). Theoretical Studies of Highly Energetic CBES Materials: Final Report for the Period 2 March 1987 to 31 May 1987 (PDF). Louisiana State University, Department of Physics and Astronomy. pp. 21–27. Archived (PDF) from the original on March 3, 2016. பார்க்கப்பட்ட நாள் 25 June 2014.
வெளி இணைப்புகள்
[தொகு] பொதுவகத்தில் புளோரின் அசைடு தொடர்பாக ஊடகக் கோப்புகள் உள்ளன.
பொதுவகத்தில் புளோரின் அசைடு தொடர்பாக ஊடகக் கோப்புகள் உள்ளன.