หน่วยรับรส
| หน่วยรับรส (Taste receptor) | |
|---|---|
 | |
| ตัวระบุ | |
| FMA | 84662 |
| อภิธานศัพท์กายวิภาคศาสตร์ | |
หน่วยรับรส (อังกฤษ: taste receptor) เป็นหน่วยรับความรู้สึกประเภทหนึ่ง อยู่ที่เยื่อหุ้มเซลล์รับรส และอำนวยให้รู้รส เมื่ออาหารหรือสารอื่น ๆ เข้ามาในปาก โมเลกุลของอาหารที่ละลายอยู่ในน้ำลายจะจับกับหน่วยรับรสในช่องปากและในที่อื่น ๆ ซึ่งก่อปฏิกิริยาภายในเซลล์ และในที่สุดทำให้เซลล์หลั่งสารสื่อประสาท อำนวยให้เกิดกระแสประสาทส่งไปยังสมอง แล้วทำให้รู้รส[1]
ระบบรับรสมีหน้าที่หลักเกี่ยวกับสารอาหาร มนุษย์และสัตว์เลี้ยงลูกด้วยนมสามารถรับรู้รสหลัก ๆ ได้ 5 อย่างคือ รสเค็ม เปรี้ยว หวาน ขม และอุมะมิ[2] หน่วยรับรสสามารถแบ่งออกเป็นแบบทั่ว ๆ ไปสองหมู่คือ[3]
- การรับรู้รสเค็มและเปรี้ยว น่าจะเกี่ยวข้องกับช่องไอออนโดยเฉพาะ ๆ[3]
- การรับรู้รสหวาน ขม และอุมะมิ เกิดจากโปรตีนเยื่อหุ้มเซลล์ที่เรียกว่า G protein-coupled receptor [3]ซึ่งปัจจุบันได้แบ่งออกเป็น 2 ชนิดคือ
อย่างไรก็ดี การเห็น การได้กลิ่น การลิ้มรส การถูกต้องสัมผัส คือ ร้อนเย็น แข็งอ่อนเป็นต้น ล้วนมีผลต่อรสชาติ ในบรรดาความรู้สึกเหล่านั้นหน่วยรับความรู้สึกแบบ vanilloid คือ TRPV1 เป็นตัวที่ทำให้รู้สึกร้อน/เผ็ดเนื่องจากโมเลกุลของแคปเซอิซิน (ในพริก) เป็นต้น และหน่วยรับความรู้สึก TRPM8 ทำให้รู้สึกเย็นเนื่องจากโมเลกุลของเมนทอล ยูคาลิปทอล และ icilin เป็นต้น[1]
โครงสร้างต่าง ๆ
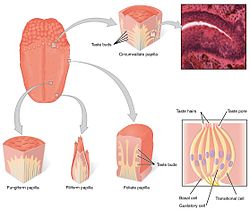
[แก้]ระบบรู้รส (gustatory system) นอกระบบประสาทกลางประกอบด้วยเซลล์รับรสในตุ่มรับรส (taste bud) ซึ่งก็อยู่ในปุ่มลิ้น (lingual papillae) โดยปุ่มลิ้น 3 ประเภทใน 4 ประเภทจะมีบทบาทในการรู้รส รวมทั้ง ปุ่มรูปเห็ด (fungiform papilla) ปุ่มรูปใบไม้ (foliate papilla) และปุ่มเซอร์คัมแวลเลต (circumvallate papilla) ส่วนปุ่มแบบที่สี่ คือ ปุ่มรูปเส้นด้าย (filiform papillae) ไม่มีตุ่มรับรส นอกจากในปุ่มเหล่านี้ หน่วยรับรสยังมีอยู่ที่เพดานปากและส่วนต้น ๆ ของทางเดินอาหาร เช่น กล่องเสียงและหลอดอาหารส่วนบน มีเส้นประสาทสมอง 3 เส้นซึ่งส่งข้อมูลรสและวิ่งไปจากเซลล์รับรสในโครงสร้างต่าง ๆ คือ เส้นประสาทเวกัส (vagus nerve, X) เส้นประสาทลิ้นคอหอย (glossopharyngeal nerve, IX) และเส้นประสาทเฟเชียล (facial nerve, VII)
ในปี 2010 นักวิจัยได้พบหน่วยรับรสขมที่เนื้อเยื่อปอด ซึ่งคลายทางเดินอากาศเมื่อประสบกับสารรสขม นักวิจัยเชื่อว่า กลไกนี้เป็นการปรับตัวทางวิวัฒนาการเพราะช่วยกำจัดเชื้อจากปอด แต่ก็สามารถถือเอาประโยชน์เพื่อรักษาโรคหืดและโรคปอดอุดกั้นเรื้อรัง[6]
หน้าที่
[แก้]การรู้รสช่วยให้สามารถกำหนดสารพิษและทานอาหารให้ถูกโภชนาการได้ มีรสหลัก ๆ 5 อย่างที่นักวิชาการยอมรับ คือ เค็ม หวาน ขม เปรี้ยว และอุมะมิ รสเค็มและเปรี้ยวจะตรวจจับผ่านช่องไอออน รสหวาน ขม และอุมะมิ จะตรวจจับด้วยหน่วยรับรสสกุล G protein-coupled receptor[7] นอกจากนั้น ยั้งมีสารต่าง ๆ ที่สามารถเปลี่ยนปรุงแต่งรสชาติได้ เช่น miraculin และ curculin ที่ให้รสหวาน และ sterubin ที่สามารถกลบรสขมได้
กลไกการทำงาน
[แก้]G protein-coupled receptor
[แก้]หน่วยรับรสขม หวาน และอุมะมิเป็น G protein-coupled receptor (GPCR) ที่มีโดเมนข้ามเยื่อหุ้มเซลล์ 7 โดเมน เมื่อลิแกนด์จับกับหน่วยรับรส ก็จะเกิดลำดับการทำงานโดยอาศัยจีโปรตีนและโมเลกุลส่งสัญญาณที่สอง เพื่อทำให้เซลล์ลดขั้ว หน่วยรับรสขม TAS2R สัมพันธ์กับจีโปรตีน gustducin ซึ่งเป็น homologue ของ transducin ที่เป็นจีโปรตีนเกี่ยวกับการเห็น[8] อย่างไรก็ดี บทบาทของ gustducin เทียบกับจีโปรตีนของหน่วยรับรสหวานและหน่วยรับรสอุมะมิก็ยังไม่ชัดเจน[9]
อนึ่ง หน่วยรับรสแบบ GPCR เช่นนี้ จะมีลำดับการทำงานเหมือนกัน คือ จะเริ่มการทำงานของ isoform ของ phospholipase C คือ PLCβ2 ซึ่งทำให้ inositol triphosphate (IP3) เข้มข้นขึ้น ทำให้หน่วยเก็บในเซลล์ปล่อย Ca2+ แล้วเปิดช่อง TRPM5 (calcium-activated non-selective cation channel) ซึ่งทำให้เซลล์ลดขั้วอาศัยไอออน Na+ ที่ไหลเข้าช่อง แล้วนำไปสู่การหลั่งสารสื่อประสาทที่ฐานของเซลล์ในที่สุด[10][9]
TRPM5
[แก้]TRPM5 เป็นช่องแคตไอออนแบบไม่เลือกที่เปิดปิดโดยแคลเซียม (calcium-activated non-selective cation channel) ที่ทำให้เซลล์ลดขั้วเมื่อระดับแคลเซียมในเซลล์สูงขึ้น มันเป็นตัวอำนวยการส่งสัญญาณในเซลล์รับความรู้สึกจากสารเคมี ช่องจะเริ่มทำงานอาศัยการเพิ่มระดับแคลเซียมภายในเซลล์ โดยช่องจะปล่อยให้แคตไอออนเวเลนซ์เดี่ยว เช่น K+ และ Na+ ให้ไหลผ่าน TRPM5 เป็นองค์ประกอบสำคัญในการถ่ายโอนรสเป็นกระแสประสาทในรสขม หวาน และอุมะมิ เนื่องจากการมีระดับแคลเซียมในเซลล์ที่สูงขึ้น มันยังคาดว่า มีบทบาทในการส่งข้อมูลรสไขมัน[11][12] การเปิดช่องอาศัยแคลเซียมของ TRPM5 จะทำให้เกิดศักย์การลดขั้วซึ่งนำไปสู่การสร้างศักยะงาน[13]
รสอุมะมิ (TAS1R1/TAS1R3)
[แก้]หน่วยรับรสแบบโปรตีนคู่ (heterodimer) คือ TAS1R1/TAS1R3 จะทำงานเป็นหน่วยรับรสอุมะมิ โดยตอบสนองต่อ L-amino acid โดยเฉพาะ L-glutamate[4] รสอุมะมิบ่อยครั้งสัมพันธ์กับสารเติมแต่งอาหารโมโนโซเดียมกลูตาเมต (ผงชูรส) และสามารถเพิ่มรสด้วยการจับกับโมเลกุล inosine monophosphate (IMP) และ guanosine monophosphate (GMP)[14][15] เซลล์ที่แสดงออกยีน TAS1R1/TAS1R3 โดยมากพบในปุ่มรูปเห็ดตรงปลายและขอบของลิ้น และที่เซลล์รับรสบนเพดานปาก[4] เป็นเซลล์ที่มีไซแนปส์กับเส้นประสาทคือ chorda tympani เพื่อส่งสัญญาณไปยังสมอง แม้ก็พบการส่งสัญญาณผ่านเส้นประสาทลิ้นคอหอยด้วย[14][16]
รสหวาน (TAS1R2/TAS1R3)
[แก้]หน่วยรับรสแบบโปรตีนคู่ (heterodimer) คือ TAS1R2/TAS1R3 จะทำงานเป็นหน่วยรับรสหวานโดยจับกับน้ำตาลและน้ำตาลเทียมหลายรูปแบบ[4][17] เซลล์รับรสที่แสดงออกยีน TAS1R2/TAS1R3 จะพบที่ปุ่มเซอร์คัมแวลเลตและปุ่มรูปใบไม้ของลิ้นด้านหลัง และที่เซลล์รับรสบนเพดานปาก[4] เซลล์เหล่านี้มีไซแนปส์ที่เส้นประสาท chorda tympani และเส้นประสาทลิ้นคอหอย เพื่อส่งสัญญาณไปยังสมอง[7][16] หน่วยรับรสแบบ homodimer คือ TAS1R3 ยังทำงานเป็นหน่วยรับรสหวานได้คล้ายกับ TAS1R2/TAS1R3 แต่จะไวน้อยกว่า และรับรู้น้ำตาลธรรมชาติได้ดีกว่าน้ำตาลเทียม ซึ่งอาจอธิบายว่า ทำไมน้ำตาลธรรมชาติและน้ำตาลเทียมจึงมีรสต่างกัน[18]
รสขม (TAS2R)
[แก้]โปรตีน TAS2R ทำหน้าที่เป็นหน่วยรับรสขม[19] มนุษย์มียีนกลุ่ม TAS2R 43 ชนิด แต่ละชนิด (โดยยกเว้นยีนเทียม 5 ชนิด) ไม่มี intron และเข้ารหัสโปรตีน GPCR[7] โปรตีนเหล่านี้ ซึ่งต่างจากโปรตีนกลุ่ม TAS1R จะมีโดเมนนอกเซลล์สั้น ๆ และอยู่ที่ปุ่มเซอร์คัมแวลเลต ที่ปุ่มรูปใบไม้ ที่เพดานปาก และที่ฝากล่องเสียง แต่มีการแสดงออกที่ปุ่มรูปเห็ดน้อย[5][7] แม้จะแน่นอนว่า มีการแสดงออกของยีน TAS2R หลายชนิดในเซลล์รับรสหนึ่ง ๆ แต่ก็ยังเป็นเรื่องไม่ยุติว่า สัตว์เลี้ยงลูกด้วยนมสามารถแยกแยะระหว่างรสขมของลิแกนด์ต่าง ๆ ได้หรือไม่[5]
อนึ่ง หน่วยรับรสขมหนึ่ง ๆ จะต้องรับลิแกนด์หลายชนิด เพราะมีสารประกอบรสขมมากกว่าจำนวนยีน TAS2R[7] มีสารประกอบรสขม 670 อย่างที่ได้ระบุแล้วในฐานข้อมูล BitterDB โดยมีกว่า 200 ชนิดที่ได้เจาะจงหน่วยรับกลิ่นหนึ่งชนิดหรือมากกว่านั้นที่รับรู้ได้[20] ลิแกนด์รสขมที่สามัญรวมทั้ง cycloheximide, denatonium, PROP (6-n-propyl-2-thiouracil), PTC (phenylthiocarbamide), และ β-glucopyranosides[7]
การถ่ายโอนสัญญาณของสิ่งเร้ารสขม จะเกิดผ่านหน่วยย่อย α ของจีโปรตีนคือ gustducin โดยเฉพาะก็คือหน่วยย่อยของโปรตีน จะเริ่มการทำงานของเอนไซม์ phosphodiesterase ซึ่งลดระดับ cyclic nucleotide (cNMP) และหน่วยย่อย βγ ของ gustducin จะเริ่มการทำงานของ IP3 (inositol triphosphate) และ DAG (diglyceride) โดย IP3 จะทำให้หน่วยเก็บภายในเซลล์ปล่อยไอออนแคลเซียม เช่นที่พบในการถ่ายโอนสัญญาณของรสหวานและรสอุมะมิ[21]
แม้หน่วยรับรส TAS2R ทั้งหมดจะอยู่แต่ในเซลล์ที่มี gustducin แต่การกำจัด gustducin (ผ่านการ knockout) ก็ไม่ได้กำจัดความไวต่อสารประกอบรสขมทั้งหมด ซึ่งแสดงว่า ยังมีกลไกรับรู้รสขมอื่น ๆ ซึ่งไม่น่าแปลกใจเพราะรสขมโดยทั่วไปเป็นตัวแสดงว่ามีสารพิษ[10] กลไกของการรับรสขมนอกเหนือจาก gustducin ที่เสนออย่างหนึ่งก็คือโดยผ่านปฏิสัมพันธ์ของช่องไอออนกับลิแกนด์รสขมโดยเฉพาะ ๆ เหมือนกับปฏิสัมพันธ์ระหว่างช่องไอออนกับรสเปรี้ยวและรสเค็ม[7]
โปรตีนจากกลุ่ม TAS2R ที่วิจัยดีที่สุดก็คือ TAS2R38 ซึ่งมีบทบาทในการรับรสขมของทั้ง PROP และ PTC และยังเป็นหน่วยรับรสเดียวที่ภาวะพหุสัณฐานของมันได้แสดงแล้วว่า มีผลต่อการรับรู้รสต่าง ๆ กัน งานศึกษาปัจจุบันมุ่งระบุภาวะพหุสัณฐานที่กำหนดฟีโนไทป์ของการรู้รสต่าง ๆ[7]
รสเปรี้ยว
[แก้]รสเปรี้ยวจะตรวจจับโดยเซลล์รับรสส่วนน้อยที่กระจายไปทั่วตุ่มรับรสที่ลิ้นซึ่งกำหนดโดยการแสดงออกของยีน PKD และเหมือนกับเกลือ การรู้รสอาจเกิดขึ้นโดยอาศัยช่องไอออน[22] คือแคตไอออน H+ จากกรด เช่น กรดน้ำส้ม จะไหลผ่านช่องไอออนซึ่งน่าจะเป็นแบบ H+-permeant, non-selective cation channel (ช่องแคตไอออนแบบไม่เลือกที่ให้ H+ ซึมเข้าได้) ในตระกูล TRP ซึ่งบางครั้งเรียกว่า PKD (เพราะสัมพันธ์กับช่องไอออนที่กลายพันธุ์ในโรค polycystic kidney disease)[9] รวมทั้งช่อง PKD2L1[23] โดยโปรตอน (H+) ที่เข้ามาจะทำให้เซลล์ลดขั้วโดยตรง และเปิดช่อง Na+ ซึ่งเปิดปิดด้วยศักย์ไฟฟ้าและอยู่ที่ข้างเซลล์ส่วนฐาน โดยมีผลลดขั้วเซลล์เพิ่มขึ้น และเปิดช่อง Ca2+ ซึ่งเปิดปิดด้วยศักย์ไฟฟ้า แล้วในที่สุดทำให้เซลล์หลั่งสารสื่อประสาท[9]
ถึงกระนั้น โปรตีน PKD2L1 โดยตนเองอาจไม่จำเป็นสำหรับการรู้รสเปรี้ยว เพราะมีหลักฐานว่า โปรตอนที่มีอยู่อย่างสมบูรณ์ในสารเปรี้ยว สามารถเข้าไปในเซลล์รับรสเปรี้ยวที่แสดงออกยีน PKD2L1 โดยตรงผ่านช่องไอออนที่ส่วนยอดซึ่งไม่เกี่ยวกับคอมเพล็กซ์โปรตีนคือ PKD2L1/PKD1L3 คือการย้ายประจุบวกผ่านช่องไอออนอื่น (ที่ยังกำหนดไม่ได้) เข้าไปในเซลล์รับรสเปรี้ยวก็เพียงพอจุดชนวนการตอบสนองทางไฟฟ้าได้แล้ว[24]
มีการเสนอด้วยว่า กรดอ่อน ๆ เช่น กรดน้ำส้ม ซึ่งไม่ได้แตกตัวที่ค่าพีเอชในร่างกายและละลายในไขมันได้ ก็ยังสามารถเข้าไปในเซลล์รับรสผ่านการแพร่แบบแพสซิฟแล้วก่อให้ตอบสนองทางไฟฟ้า ตามกลไกนี้ เมื่อกรดอ่อน ๆ เข้ามาในเซลล์แล้ว ก็จะแตกตัวเพิ่มความเป็นกรดในเซลล์[25] ยับยั้งช่องโพแทสเซียม (ซึ่งปกติมีหน้าที่เพิ่มขั้วเซลล์และทำให้เซลล์ลดขั้วได้ยากขึ้น) แล้วทำให้เซลล์ลดขั้ว[26] สำหรับกรดแบบแรง การรับไฮโดรเจนเข้าโดยตรง และการยับยั้งการทำงานของช่องไอออนที่เพิ่มขั้วเซลล์ จะมีผลให้เซลล์รับรสลดขั้ว ปล่อยสารสื่อประสาท และทำให้รู้รสเปรี้ยว[26]
อย่างไรก็ดี ก็ยังไม่มีการระบุโปรตีนที่เป็นตัวถ่ายโอนรสเปรี้ยวให้เป็นกระแสไฟฟ้า และกลไกการถ่ายโอนสัญญาณก็ยังไม่ชัดเจน[27] แต่ก็ปรากฏแล้วว่า มีวิถีการถ่ายโอนสัญญาณหลายวิถี[25]
รสเค็ม
[แก้]ความเค็มเป็นรสที่เกิดโดยหลักเนื่องจากมีไอออนโซเดียม แม้ไอออนของโลหะแอลคาไลอื่น ๆ ก็มีรสเค็มเช่นกัน ไอออนที่ทำให้รู้รสเค็มรวมทั้ง Na+, K+, และ Li+[22] ที่อาจตรวจจับได้เมื่อแคตไอออนไหลเข้าเซลล์รับรส เช่นโดยผ่านช่องไอออนแคลเซียมที่ไวต่ออะมิโลไรด์ แล้วทำให้เซลล์ลดขั้วโดยตรง และเปิดช่อง Na+ ซึ่งเปิดปิดด้วยศักย์ไฟฟ้าและอยู่ที่ข้างเซลล์ส่วนฐาน โดยมีผลลดขั้วเซลล์เพิ่มขึ้น และเปิดช่อง Ca2+ ซึ่งเปิดปิดด้วยศักย์ไฟฟ้า แล้วในที่สุดทำให้เซลล์หลั่งสารสื่อประสาท[9]
ช่องโซเดียมที่ว่านี้เรียกว่าช่องโซเดียมที่เนื้อเยื่อบุผิว (epithelial sodium channel, ENaC) ซึ่งมีหน่วยย่อย ๆ 3 หน่วย ในสัตว์เลี้ยงลูกด้วยนมหลายอย่างโดยเฉพาะหนู ENaC สามารถระงับการทำงานได้ด้วยยาอะมิโลไรด์ แต่ความไวของการรู้รสเค็มเนื่องกับยาอะมิโลไรด์ในมนุษย์จะชัดเจนน้อยกว่า จึงทำให้คาดว่า อาจมีโปรตีนหน่วยรับรสอื่น ๆ อีกนอกเหนือจาก ENaC ที่ยังค้นไม่พบ เช่น Na+ อาจสามารถแพร่เข้าช่อง Na+ อาศัยความต่างทางเคมีไฟฟ้าของภายในและภายนอกเซลล์[28]
น้ำอัดลม
[แก้]นักวิจัยได้พบว่า มีการรู้รสน้ำอัดลม/น้ำโซดาที่เริ่มจากเอนไซม์ที่สัมพันธ์กับหน่วยรับรสเปรี้ยว คือเอนไซม์ carbonic anhydrase 4 ซึ่งมีปฏิกิริยากับคาร์บอนไดออกไซด์ในน้ำ แล้วเริ่มการทำงานของเซลล์รับรสเปรี้ยวในตุ่มรับรส มีผลให้เซลล์ส่งกระแสประสาทไปยังสมอง[29]
ไขมัน
[แก้]มีการระบุหน่วยรับรสไขมันที่เป็นไปได้อย่างหนึ่ง คือ CD36[30] ซึ่งอยู่ในตุ่มรับรสที่ปุ่มเซอร์คัมแวลเลตและปุ่มรูปใบไม้[31] และงานวิจัยได้แสดงว่า CD36 จะจับกับกรดไขมันแบบลูกโซ่ยาว[32] ความแตกต่างของการแสดงออก CD36 ในผู้ร่วมการทดลองที่เป็นมนุษย์ สัมพันธ์กับสมรรถภาพในการรู้รสไขมัน[33] ซึ่งให้หลักฐานสำหรับความสัมพันธ์ระหว่างหน่วยรับรสกับการรู้รสไขมัน งานวิจัยเพิ่มเติมเกี่ยวกับหน่วยรับรส CD36 อีก จะช่วยแสดงว่ามีหน่วยรับรสไขมันจริง ๆ หรือไม่
โปรตีน GPR120 และ GPR40 ได้แสดงว่า ตอบสนองต่อไขมันในปาก[34] และการไม่มีพวกมัน ทำให้ชอบใจไขมันลดลง และมีการตอบสนองทางประสาทลดลงต่อกรดไขมันในปาก[35]
มีการแสดงว่า หน่วยรับ TRPM5 มีบทบาทในการตอบสนองต่อไขมันในปาก และได้ระบุว่าอาจเป็นหน่วยรับไขมัน แต่หลักฐานต่อ ๆ มาได้แสดงว่า มันมีบทบาทต่อการรับรู้ไขมันในลำดับการทำงานหลัง ๆ (downstream)[36][37]
ประเภทของ GPCR
[แก้]หน่วยรับรสขม หวาน และอุมะมิเป็น G protein-coupled receptor (GPCR) หน่วยรับรสขมของมนุษย์ตั้งชื่อเริ่มตั้งแต่ TAS2R1 จนถึง TAS2R64 โดยมีช่องในระหว่าง ๆ มากมายเพราะไม่มียีน เป็นยีนเทียม (pseudogene) หรือเป็นยีนที่เสนอแต่ยังไม่ผ่านกระบวนการ DNA annotation ซึ่งเป็นการกำหนดตำแหน่งยีน กำหนดเขตเข้ารหัสภายในจีโนม และกำหนดว่ายีนมีหน้าที่อะไรในมนุษย์ ยีนหน่วยรับรสขมจำนวนมากยังมีชื่อพ้องที่ทำให้สับสน เพราะมีหลายชื่อแต่หมายเอายีนเดียวกัน
| Class | ยีน | Synonyms | Aliases | โลคัส | รายละเอียด |
|---|---|---|---|---|---|
| type 1 (หวาน/อุมะมิ) |
TAS1R1 | GPR70 | 1p36.23 | ||
| TAS1R2 | GPR71 | 1p36.23 | |||
| TAS1R3 | 1p36 | ||||
| type 2 (ขม) |
TAS2R1 | 5p15 | |||
| TAS2R2 | 7p21.3 | ยีนเทียม | |||
| TAS2R3 | 7q31.3-q32 | ||||
| TAS2R4 | 7q31.3-q32 | ||||
| TAS2R5 | 7q31.3-q32 | ||||
| TAS2R6 | 7 | ยังไม่ผ่าน DNA annotation | |||
| TAS2R7 | 12p13 | ||||
| TAS2R8 | 12p13 | ||||
| TAS2R9 | 12p13 | ||||
| TAS2R10 | 12p13 | ||||
| TAS2R11 | ไม่มีในมนุษย์ | ||||
| TAS2R12 | TAS2R26 | 12p13.2 | ยีนเทียม | ||
| TAS2R13 | 12p13 | ||||
| TAS2R14 | 12p13 | ||||
| TAS2R15 | 12p13.2 | ยีนเทียม | |||
| TAS2R16 | 7q31.1-q31.3 | ||||
| TAS2R17 | ไม่มีในมนุษย์ | ||||
| TAS2R18 | 12p13.2 | ยีนเทียม | |||
| TAS2R19 | TAS2R23, TAS2R48 | 12p13.2 | |||
| TAS2R20 | TAS2R49 | 12p13.2 | |||
| TAS2R21 | ไม่มีในมนุษย์ | ||||
| TAS2R22 | 12 | ยังไม่ผ่าน DNA annotation | |||
| TAS2R24 | ไม่มีในมนุษย์ | ||||
| TAS2R25 | ไม่มีในมนุษย์ | ||||
| TAS2R27 | ไม่มีในมนุษย์ | ||||
| TAS2R28 | ไม่มีในมนุษย์ | ||||
| TAS2R29 | ไม่มีในมนุษย์ | ||||
| TAS2R30 | TAS2R47 | 12p13.2 | |||
| TAS2R31 | TAS2R44 | 12p13.2 | |||
| TAS2R32 | ไม่มีในมนุษย์ | ||||
| TAS2R33 | 12 | ยังไม่ผ่าน DNA annotation | |||
| TAS2R34 | ไม่มีในมนุษย์ | ||||
| TAS2R35 | ไม่มีในมนุษย์ | ||||
| TAS2R36 | 12 | ยังไม่ผ่าน DNA annotation | |||
| TAS2R37 | 12 | ยังไม่ผ่าน DNA annotation | |||
| TAS2R38 | 7q34 | ||||
| TAS2R39 | 7q34 | ||||
| TAS2R40 | GPR60 | 7q34 | |||
| TAS2R41 | 7q34 | ||||
| TAS2R42 | 12p13 | ||||
| TAS2R43 | 12p13.2 | ||||
| TAS2R45 | GPR59 | 12 | |||
| TAS2R46 | 12p13.2 | ||||
| TAS2R50 | TAS2R51 | 12p13.2 | |||
| TAS2R52 | ไม่มีในมนุษย์ | ||||
| TAS2R53 | ไม่มีในมนุษย์ | ||||
| TAS2R54 | ไม่มีในมนุษย์ | ||||
| TAS2R55 | ไม่มีในมนุษย์ | ||||
| TAS2R56 | ไม่มีในมนุษย์ | ||||
| TAS2R57 | ไม่มีในมนุษย์ | ||||
| TAS2R58 | ไม่มีในมนุษย์ | ||||
| TAS2R59 | ไม่มีในมนุษย์ | ||||
| TAS2R60 | 7 | ||||
| TAS2R62P | 7q34 | ยีนเทียม | |||
| TAS2R63P | 12p13.2 | ยีนเทียม | |||
| TAS2R64P | 12p13.2 | ยีนเทียม |
เชิงอรรถและอ้างอิง
[แก้]- ↑ 1.0 1.1 This, Hervé (2012). "The Science of the Oven - Excerpt from Chapter 1". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2014-05-02. สืบค้นเมื่อ 30 Apr 2014.
- ↑ Buck & Bargmann 2013a, Taste Has Five Submodalities or Qualities, pp. 726-727
- ↑ 3.0 3.1 3.2 Buck & Bargmann 2013a, Each Taste Is Detected by a Distinct Sensory Transduction Mechanism and Distinct Population of Taste Cells, pp. 728-732
- ↑ 4.0 4.1 4.2 4.3 4.4 Nelson G, Hoon MA, Chandrashekar J, และคณะ (August 2001). "Mammalian sweet taste receptors". Cell. 106 (3): 381–90. doi:10.1016/S0092-8674(01)00451-2. PMID 11509186. S2CID 11886074.
- ↑ 5.0 5.1 5.2 Adler E, Hoon MA, Mueller KL, และคณะ (March 2000). "A novel family of mammalian taste receptors". Cell. 100 (6): 693–702. doi:10.1016/S0092-8674(00)80705-9. PMID 10761934. S2CID 14604586.
- ↑ Deshpande DA, Wang WC, McIlmoyle EL, และคณะ (November 2010). "Bitter taste receptors on airway smooth muscle bronchodilate by localized calcium signaling and reverse obstruction". Nature Medicine. 16 (11): 1299–304. doi:10.1038/nm.2237. PMC 3066567. PMID 20972434.
- ↑ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 Bachmanov, AA; Beauchamp, GK (2007). "Taste receptor genes". Annual Review of Nutrition. 27: 389–414. doi:10.1146/annurev.nutr.26.061505.111329. PMC 2721271. PMID 17444812.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Sainz E, Cavenagh MM, LopezJimenez ND, และคณะ (June 2007). "The G-protein coupling properties of the human sweet and amino acid taste receptors". Developmental Neurobiology. 67 (7): 948–59. doi:10.1002/dneu.20403. PMID 17506496. S2CID 29736077.
- ↑ 9.0 9.1 9.2 9.3 9.4 Purves et al 2008a, Taste Buds Taste Cells, Receptor Proteins, and Transduction, pp. 387-389
- ↑ 10.0 10.1 Zhang Y, Hoon MA, Chandrashekar J, และคณะ (February 2003). "Coding of sweet, bitter, and umami tastes: different receptor cells sharing similar signaling pathways". Cell. 112 (3): 293–301. doi:10.1016/S0092-8674(03)00071-0. PMID 12581520. S2CID 718601.
- ↑ PMID 21557960 (PMID 21557960)
Citation will be completed automatically in a few minutes. Jump the queue or expand by hand - ↑ PMID 21653867 (PMID 21653867)
Citation will be completed automatically in a few minutes. Jump the queue or expand by hand - ↑ Chaudhari, N; Roper, SD (2010). "The cell biology of taste". J. Cell Biol. 190 (3): 285-96. doi:10.1083/jcb.201003144. PMC 2922655.

- ↑ 14.0 14.1 Nelson G, Chandrashekar J, Hoon MA, และคณะ (March 2002). "An amino-acid taste receptor". Nature. 416 (6877): 199–202. Bibcode:2002Natur.416..199N. doi:10.1038/nature726. PMID 11894099. S2CID 1730089.
- ↑ Delay ER, Beaver AJ, Wagner KA, และคณะ (October 2000). "Taste preference synergy between glutamate receptor agonists and inosine monophosphate in rats". Chemical Senses. 25 (5): 507–15. doi:10.1093/chemse/25.5.507. PMID 11015322.
- ↑ 16.0 16.1 Danilova V, Hellekant G (March 2003). "Comparison of the responses of the chorda tympani and glossopharyngeal nerves to taste stimuli in C57BL/6J mice". BMC Neuroscience. 4: 5. doi:10.1186/1471-2202-4-5. PMC 153500. PMID 12617752.
- ↑ Li X, Staszewski L, Xu H, และคณะ (April 2002). "Human receptors for sweet and umami taste". Proceedings of the National Academy of Sciences of the United States of America. 99 (7): 4692–6. Bibcode:2002PNAS...99.4692L. doi:10.1073/pnas.072090199. PMC 123709. PMID 11917125.
- ↑ Zhao GQ, Zhang Y, Hoon MA, และคณะ (October 2003). "The receptors for mammalian sweet and umami taste". Cell. 115 (3): 255–66. doi:10.1016/S0092-8674(03)00844-4. PMID 14636554. S2CID 11773362.
- ↑ Chandrashekar J, Mueller KL, Hoon MA, และคณะ (March 2000). "T2Rs function as bitter taste receptors". Cell. 100 (6): 703–11. doi:10.1016/S0092-8674(00)80706-0. PMID 10761935. S2CID 7293493.
- ↑ Wiener (2012). "BitterDB: a database of bitter compounds". Nucleic Acids Res. 40 (Database issue): D413-9. doi:10.1093/nar/gkr755. PMC 3245057. PMID 21940398.
- ↑ Kinnamon & Margolskee 2008, Figure 4 Transduction of bitter, sweet, and umami taste stimuli, p. 228
- ↑ 22.0 22.1 Frings, Stephan; Bradley, Jonathan (2004). Transduction channels in sensory cells. Wiley-VCH. p. 155.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ "Biologists Discover How We Detect Sour Taste", Science Daily, 2006-08-24, สืบค้นเมื่อ 2010-09-12
- ↑ Chang, Rui; Waters, Hang; Liman, Emily (2010). "A proton current drives action potentials in genetically identified sour taste cells". Proc Natl Acad Sci U S A. 107 (51): 22320–22325. doi:10.1073/pnas.1013664107. PMC 3009759. PMID 21098668.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) Full Article PDF (1.05 MB) - ↑ 25.0 25.1 DuBois, DeSimone & Lyall 2008, 4.02.5.1 Biochemistry of Sour Taste, pp. 59-62
- ↑ 26.0 26.1 Ye, W; Chang, RB; Bushman, JD; Tu, YH; Mulhall, EM; Wilson, CE; Cooper, AJ; Chick, WS; Hill-Eubanks, DC; Nelson, MT; Kinnamon, SC; Liman, ER (2016). "The K+ channel KIR2.1 functions in tandem with proton influx to mediate sour taste transduction". Proc Natl Acad Sci U S A. 113: E229-238. doi:10.1073/pnas.1514282112. PMC 4720319. PMID 26627720.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) Full Article PDF (3.88 MB) - ↑ Buck & Bargmann 2013a, Sour Taste, p. 732
- ↑ Buck & Bargmann 2013a, Salty Taste, pp. 730-731
- ↑ "Scientists Discover Protein Receptor for Carbonation Taste, October 15, 2009 News Release - National Institutes of Health (NIH)". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2015-07-03. สืบค้นเมื่อ 2014-10-06.
- ↑ Laugerette F, Passilly-Degrace P, Patris B, และคณะ (November 2005). "CD36 involvement in orosensory detection of dietary lipids, spontaneous fat preference, and digestive secretions". The Journal of Clinical Investigation. 115 (11): 3177–84. doi:10.1172/JCI25299. PMC 1265871. PMID 16276419.
- ↑ Simons PJ, Kummer JA, Luiken JJ, Boon L (December 2011). "Apical CD36 immunolocalization in human and porcine taste buds from circumvallate and foliate papillae". Acta Histochemica. 113 (8): 839–43. doi:10.1016/j.acthis.2010.08.006. PMID 20950842.
- ↑ Baillie AG, Coburn CT, Abumrad NA (September 1996). "Reversible binding of long-chain fatty acids to purified FAT, the adipose CD36 homolog". The Journal of Membrane Biology. 153 (1): 75–81. doi:10.1007/s002329900111. PMID 8694909. S2CID 5911289.
- ↑ Pepino MY, Love-Gregory L, Klein S, Abumrad NA (March 2012). "The fatty acid translocase gene CD36 and lingual lipase influence oral sensitivity to fat in obese subjects". Journal of Lipid Research. 53 (3): 561–6. doi:10.1194/jlr.M021873. PMC 3276480. PMID 22210925.
- ↑ DiPatrizio NV (September 2014). "Is fat taste ready for primetime?". Physiology & Behavior. 136: 145–54. doi:10.1016/j.physbeh.2014.03.002. PMC 4162865. PMID 24631296.
- ↑ Cartoni C, Yasumatsu K, Ohkuri T, และคณะ (June 2010). "Taste preference for fatty acids is mediated by GPR40 and GPR120". The Journal of Neuroscience. 30 (25): 8376–82. doi:10.1523/JNEUROSCI.0496-10.2010. PMC 6634626. PMID 20573884.
- ↑ Mattes RD (September 2011). "Accumulating evidence supports a taste component for free fatty acids in humans". Physiology & Behavior. 104 (4): 624–31. doi:10.1016/j.physbeh.2011.05.002. PMC 3139746. PMID 21557960.
- ↑ Liu P, Shah BP, Croasdell S, Gilbertson TA (June 2011). "Transient receptor potential channel type M5 is essential for fat taste". The Journal of Neuroscience. 31 (23): 8634–42. doi:10.1523/JNEUROSCI.6273-10.2011. PMC 3125678. PMID 21653867.
แหล่งข้อมูลอื่น
[แก้]- Adler E, Hoon MA, Mueller KL, และคณะ (2000). "A Novel Family of Mammalian Taste Receptors - An Investigative Review". Davidson College Biology Department. สืบค้นเมื่อ 2008-08-11.
- taste receptors, type 1 ในหอสมุดแพทยศาสตร์แห่งชาติอเมริกัน สำหรับหัวข้อเนื้อหาทางการแพทย์ (MeSH)
- taste receptors, type 2 ในหอสมุดแพทยศาสตร์แห่งชาติอเมริกัน สำหรับหัวข้อเนื้อหาทางการแพทย์ (MeSH)