分子擴散
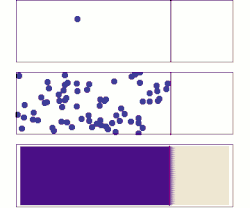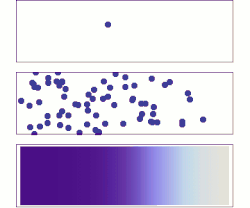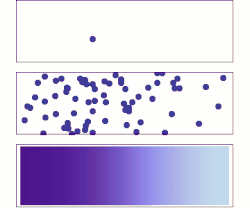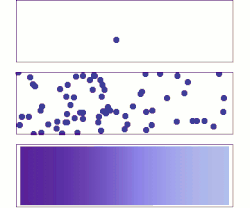
分子擴散(英語:molecular diffusion),通常簡稱擴散,是任何粒子(氣體或液體)於絕對零度以上之環境下的熱力學運動。本行為的速率是溫度、流體黏度以及粒子大小(質量)的函數。擴散解釋高濃度與低濃度之間存在分子淨通量的原因。一旦濃度相等,分子雖持續運動,但由於濃度梯度已不復存在,分子遂停止擴散,改由自擴散主導分子的隨機運動。擴散的結局是材料逐漸混合,使分子分佈達成均勻。由於分子依然持續運動,但平衡也已經建立,因此分子擴散的最終狀態被稱為「動態平衡」。在具有均勻溫度的相態中,因不受外部淨力影響,擴散過程最終將達到完全混合。
今考慮兩個等溫且有能力交換粒子的系統,S1與S2。如果系統位能有發生交換;例如μ1>μ2(μ為化學勢),則系統S1至系統S2將有能量流產生,因為自然傾向降低能量並使熵值極大化。
分子擴散一般都以菲克定律作為其數學描述。
應用
[编辑]擴散是許多物理、化學及生物學科重要的基礎。一些應用擴散的例子如下:
重要性
[编辑]
生物學
[编辑]於細胞生物學中,擴散是細胞間傳送必要物質(如胺基酸)的主要方式。[1]溶劑(如水)在半透膜上的擴散行為則被稱為滲透。
氣體分子擴散
[编辑]物質於靜止流體或跨越穩流流體之流線的輸送方式為分子擴散。兩相鄰容器以隔牆隔開,並各自裝有兩假想之氣體A與B,於容器中隨意運動著。倘若隔牆被移除,部分氣體A將移往原來被氣體B佔據的區域。相反地,B分子也將移往原來被純A分子佔據的區域。最終,兩種分子達成完全混合。在此之前,A、B之濃度皆隨著擴散軸向(X)逐漸變化,可以數學表示為-dCA/dx,其中CA是A的濃度。數學式前方的負號代表A濃度隨著距離x的增加而減少。同樣地,B濃度的變化則為-dCB/dx。分子A的擴散速率NA與濃度梯度和分子A於x方向上的平均速率相關,而這個關係得以菲克定律描述:
- (僅可用於無整體流動的情形下)
等莫耳逆向擴散
[编辑]相關條目
[编辑]參考資料
[编辑]- ^ Maton, Anthea; Jean Hopkins; Susan Johnson; David LaHart; Maryanna Quon Warner; Jill D. Wright. Cells Building Blocks of Life. Upper Saddle River, New Jersey: Prentice Hall. 1997: 66–67.
