Butan-1-ol
| n-Butanol | |||
|---|---|---|---|
| |||
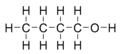 Công thức xương của n-butanol với tất cả hydrogen rõ ràng được thêm vào
| |||
| Tên hệ thống |
Butan-1-ol[1] | ||
| Tên khác |
Butalcohol Butanol 1-Butanol Butyl alcohol Butyl hydrate Butylic alcohol Butyralcohol Butyric alcohol Butyryl alcohol n-Butyl alcohol 1-Hydroxybutane n-Propylcarbinol | ||
| Nhận dạng | |||
| Số CAS |
| ||
| PubChem |
| ||
| Số EINECS |
| ||
| Ngân hàng dược phẩm | |||
| KEGG |
| ||
| MeSH |
| ||
| ChEBI |
| ||
| Số RTECS |
EO1400000 | ||
| Ảnh Jmol-3D | |||
| SMILES |
List
| ||
| InChI |
1/C4H10O/c1-2-3-4-5/h5H,2-4H2,1H3 | ||
| Tham chiếu Beilstein |
969148 | ||
| Tham chiếu Gmelin |
25753 | ||
| 3DMet |
| ||
| Thuộc tính | |||
| Bề ngoài |
Colourless, refractive liquid | ||
| Mùi | |||
| Khối lượng riêng |
0.81 g cm−3 | ||
| Điểm nóng chảy |
−89,8 °C (183,3 K; −129,6 °F)[Chuyển đổi: Số không hợp lệ] | ||
| Điểm sôi |
117,7 °C (390,8 K; 243,9 °F)[Chuyển đổi: Số không hợp lệ] | ||
| Độ hòa tan trong nước |
73 g L−1 at 25 °C | ||
| Độ hòa tan |
Hòa tan tốt trong acetone | ||
| log P |
0.839 | ||
| Áp suất hơi |
6 mmHg (20 °C)[3] | ||
| Độ axit (pKa) |
16.10 | ||
| MagSus |
-56.536·10−6 cm³/mol | ||
| Chiết suất (nD) |
1.3993 (20 °C) | ||
| Độ nhớt |
2.573 mPa×s (at 25 °C) [4] | ||
| Mômen lưỡng cực |
1.66 D | ||
| Nhiệt hóa học | |||
| Entanpi hình thành ΔfH |
−328(4) kJ mol−1 | ||
| DeltaHc |
−2670(20) kJ mol−1 | ||
| Entropy mol tiêu chuẩn S |
225.7 J K−1 mol−1 | ||
| Các nguy hiểm | |||
| Phân loại của EU | |||
| NFPA 704 |
| ||
| Chỉ dẫn R | |||
| Chỉ dẫn S |
Bản mẫu:S2, S7/9, Bản mẫu:S13, S26, Bản mẫu:S37/39, Bản mẫu:S46 | ||
| Giới hạn nổ |
1.45–11.25% | ||
| PEL |
TWA 100 ppm (300 mg/m³)[3] | ||
| LD50 |
790 mg/kg (đường miệng, chuột) | ||
| Các hợp chất liên quan | |||
n-butanol hoặc rượu n-butyl hoặc butanol thông thường là rượu cơ bản với cấu trúc 4-carbon và công thức hóa học là C4H9OH. Các đồng phân của nó bao gồm isobutanol, 2-butanol, và tert-butanol. Butanol là một trong những nhóm "rượu fusel" (từ tiếng Đức "rượu xấu"), có nhiều hơn hai nguyên tử cacbon và có độ hòa tan đáng kể trong nước.
n-butanol xảy ra tự nhiên như là một sản phẩm nhỏ của sự lên men của đường và các carbohydrate khác.[5] Nó còn có mặt trong nhiều thực phẩm và đồ uống[6][7]. Nó cũng là một hương liệu nhân tạo được cho phép dùng ở Hoa Kỳ[8], được sử dụng trong bơ, kem, trái cây, rum, whisky, kem và băng, bánh kẹo, các sản phẩm nướng.[9] Nó cũng được sử dụng trong một loạt các sản phẩm tiêu dùng.
Việc sử dụng n-butanol lớn nhất là một chất trung gian trong công nghiệp, đặc biệt là để sản xuất butyl acetat (tự nó là một chất tạo hương nhân tạo và dung môi công nghiệp). Nó là một hóa dầu, được sản xuất từ propylen và thường được sử dụng gần với điểm sản xuất. Số liệu ước tính sản lượng năm 1997 là: 784.000 tấn của Hoa Kỳ; Tây Âu 575.000 tấn; Nhật Bản 225.000 tấn.
Sản xuất
[sửa | sửa mã nguồn]n-butanol được sản xuất công nghiệp từ nguyên liệu hóa dầu propylen. Propylene được hydroformyl hóa thành butyraldehyde (quá trình oxo) với sự có mặt của chất xúc tác đồng nhất rhodium tương tự như chất xúc tác của Wilkinson. Butyraldehyde sau đó được hydro hóa để sản xuất n-butanol.
Ứng dụng công nghiệp
[sửa | sửa mã nguồn]n-butanol là một chất trung gian trong việc sản xuất butyl acrylate, butyl acetat, dibutyl phthalate, dibutyl sebacate, và các este butyl, ethe butyl khác[10][11] như ethylen monobutyl etylen glycol, ete monobutyl etylen và eteilen triethylene, và các butyl etyl acetates tương ứng. Các ứng dụng công nghiệp khác bao gồm sản xuất dược phẩm, polyme, nhựa pyroxylin, este thuốc diệt cỏ, in ấn (ví dụ 2,4-D, 2,4,5-T) [12] và butyl xanthate. Nó cũng được sử dụng như là một chất pha loãng / phản ứng trong sản xuất urê formaldehyde và nhựa melamine-formaldehyde.
Các ứng dụng khác
[sửa | sửa mã nguồn]n-butanol được sử dụng như một thành phần trong nước hoa và là một dung môi để chiết xuất tinh dầu. n-Butanol cũng được sử dụng như một chất chiết xuất trong sản xuất kháng sinh, hormon và vitamin; dung môi cho sơn, chất phủ, nhựa tự nhiên, lợi, nhựa tổng hợp, thuốc nhuộm, alkaloid và camphor. Các ứng dụng nhỏ khác của n-butanol như chất sưng trong hàng dệt, như là một thành phần của chất lỏng phanh thủy lực, các công thức làm sạch, chất làm sạch và chất chống thấm; và như là một thành phần của các chất quặng float, và các hệ thống xử lý gỗ.[13]
n-Butanol đã được đề xuất như một chất thay thế cho nhiên liệu diesel và xăng. Nó được sản xuất với số lượng nhỏ trong hầu hết các quá trình lên men, nhưng các loại Clostridium sản sinh butanol rất cao và nghiên cứu hiện đang được tiến hành để tăng sản lượng biobutanol cuối cùng từ sinh khối.
Trong một số trường hợp, việc sản xuất hoặc việc sử dụng các chất sau đây có thể tạo ra n-butanol: da nhân tạo, este butyl, xi măng cao su, thuốc nhuộm, tinh dầu hoa quả, nhựa, rayon, kính an toàn, sơn lót vỏ sò, và vải chống thấm.
Sự xuất hiện trong tự nhiên
[sửa | sửa mã nguồn]Mật ong sử dụng n-butanol làm Pheromone báo thức.
Sự xuất hiện trong thực phẩm
[sửa | sửa mã nguồn]n-Butanol xảy ra tự nhiên do quá trình lên men carbohydrate trong một số đồ uống có cồn, bao gồm bia[14], rượu vang nho[15], rượu vang[16] và rượu whiskey[17]. Nó đã được phát hiện trong [18] trái cây, xử lý nhiệt sữa[19][20], dưa hấu[21], pho mát[22], hạt đậu phía nam,[23] và cơm nấu.[24] n-Butanol cũng được hình thành trong suốt quá trình chiên dầu ngô, dầu hạt bông, trilinolein, và triolein.[25]
n-Butanol được sử dụng như là một thành phần của hương liệu nhân tạo và chế biến, và để chiết xuất các protein không chứa lipid từ lòng đỏ trứng,[26] các chất liệu hương liệu tự nhiên và dầu thực vật, sản xuất chiết xuất hop để làm bánh và như một dung môi trong việc loại bỏ các sắc tố từ chất đạm ướt đậm đặc.[27]
Trao đổi chất và độc tính
[sửa | sửa mã nguồn]n-butanol dễ dàng hấp thụ qua đường ruột và phổi, và cũng có thể qua da.[28] Nó được chuyển hóa hoàn toàn trong động vật có xương sống theo cách tương tự như ethanol: rượu dehydrogenase chuyển n-butanol thành butyraldehyde; sau đó chuyển sang acid butyric bởi aldehyde dehydrogenase. Axit butyric có thể được chuyển hoá hoàn toàn vào carbon dioxide và nước theo đường đi quá trình oxy hóa β. Ở chuột, chỉ 0,03% liều uống 2,000 mg / kg được bài tiết qua nước tiểu.[29]
Độc tính cấp tính của n-butanol tương đối thấp, với giá trị LD50 trong miệng là 790-4,360 mg / kg (chuột, các giá trị tương đương đối với ethanol là 7.000-15.000 mg / kg).[30] Không có báo cáo về tử vong ở nồng độ hít phải 8.000 ppm (tiếp xúc 4 giờ, chuột). Với nồng độ thấp, n-butanol hoạt động như một chất làm suy yếu hệ thống thần kinh trung ương, tương tự như ethanol: một nghiên cứu trên chuột cho thấy hiệu lực gây say xỉn của n-butanol gấp 6 lần so vớiethanol, có thể do chuyển đổi chậm bằng rượu dehydrogenase.[31]
n-butanol là thành phần tự nhiên của nhiều đồ uống có cồn, mặc dù nồng độ thấp (nhưng có biến đổi)[32][33].[34] Một liều không rõ n-butanol đã được tiêu thụ bởi một người đàn ông 47 tuổi mà không có tiền sử bệnh tật trước đó, dẫn đến một loạt các tác động xấu đến sức khoẻ.[35]
Các mối nguy hiểm khác
[sửa | sửa mã nguồn]N-butanol lỏng, như phổ biến với hầu hết các dung môi hữu cơ, là cực kỳ khó chịu cho mắt; tiếp xúc lặp lại với da cũng có thể gây kích ứng. Điều này được cho là một hiệu ứng chung của việc "làm thoái hóa". Không có hiện tượng nhạy cảm với da. Kích thích đường hô hấp chỉ xảy ra ở nồng độ rất cao (> 2.400 ppm).[36]
Với nồng độ 35 °C, n-butanol có nguy cơ gây hỏa hoạn vừa phải: hơi dễ cháy hơn dầu lửa hoặc dầu diesel nhưng ít dễ cháy hơn nhiều dung môi hữu cơ thông thường khác. Tác động trầm cảm lên hệ thần kinh trung ương (tương tự như nhiễm độc ethanol) là một nguy cơ tiềm ẩn khi làm việc với n-butanol trong các không gian kín, mặc dù ngưỡng mùi (0,2-30 ppm) thấp hơn nhiều so với nồng độ có thể có bất kỳ tác dụng thần kinh.[37]
n-butanol có độ độc thấp đối với động vật có xương sống và động vật không xương sống dưới nước. Nó được phân hủy nhanh chóng trong nước, mặc dù ước tính khoảng 83% phân vùng không khí khi nó bị phân hủy bởi các gốc tự do hydroxyl với chu kỳ bán rải là 1,2-2,3 ngày. Nó có khả năng tích tụ sinh học thấp. Một nguy cơ tiềm ẩn thải ra các nguồn nước lớn là sự gia tăng nhu cầu oxy hóa học (C.O.D.) liên quan đến sự phân hủy sinh học của nó.
Liên kết ngoài
[sửa | sửa mã nguồn]- Thẻ an toàn hóa chất quốc tế 0111
- “NIOSH Pocket Guide to Chemical Hazards #0076”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- Bản mẫu:SIDS
- IPCSBản mẫu:EHCEnvironmental Health CriteriaBản mẫu:EHC
- IPCSBản mẫu:HSGHealth and Safety GuideBản mẫu:HSG
Tham khảo
[sửa | sửa mã nguồn]- ^ "1-Butanol - Compound Summary". The PubChem Project. USA: National Center of Biotechnology Information.
- ^ [n-Butanol Product Information, The Dow Chemical Company, Form No. 327-00014-1001, page 1]
- ^ a b "NIOSH Pocket Guide to Chemical Hazards #0076". National Institute for Occupational Safety and Health (NIOSH).
- ^ Dubey, Gyan (2008). "Study of densities, viscosities, and speeds of sound of binary liquid mixtures of butan-1-ol with n-alkanes (C6, C8, and C10) at T = (298.15, 303.15, and 308.15) K". The Journal of Chemical Thermodynamics. 40 (2): 309–320. doi:10.1016/j.jct.2007.05.016.
- ^ The Ehrlich pathway for fusel alcohol production: a century of research on Saccharomyces cerevisiae metabolism, 2008.
- ^ Bản mẫu:EHC-ref.
- ^ Bản mẫu:SIDS-ref.
- ^ 21 C.F.R. § 172.515; 42 FR 14491, Mar. 15, 1977, as amended.
- ^ Recent progress in the consideration of flavouring ingredients under the food additives amendment. III. Gras substances, 1965, cited in Bản mẫu:EHC-ref.
- ^ Industrial Solvents, 1950, cited in Bản mẫu:EHC-ref.
- ^ The Technology of Solvents and Plasticizers, 1954, cited in Bản mẫu:EHC-ref.
- ^ Alcohols: Their Chemistry, Properties, and Manufacture, 1968, cited in Bản mẫu:EHC-ref.
- ^ Amundsen, J.; R. J. Goodwin & W. H. Wetzel, "Water-soluble pentachlorophenol and tetrachlorophenol wood-treating systems", ZA 7801031, published 28 Feb. 1979.
- ^ Congener substances in German and foreign beers, 1979, cited in Bản mẫu:EHC-ref.
- ^ Composition of neutral volatile constituents in grape brandies, 1979.
- ^ Congener content of wine and similar beverages, 1978, cited in Bản mẫu:EHC-ref.
- ^ Gas chromatographic characterization of whiskey. III. Irish whiskey, 1978, cited in Bản mẫu:EHC-ref.
- ^ Studies of the volatile composition of hops during storage, 1978.
- ^ Volatile constituents of jack fruit (Arthocarpus heterophyllus), 1978.
- ^ Chemical analysis of flavor volatiles in heat-treated milks, 1978.
- ^ Production of volatile compounds by Muskmelon, Cucumis melo, 1978.
- ^ Occurrence of sesquiterpones in mountain cheese volatiles, 1978.
- ^ Volatile constituents of southernpea seed [Vigna unguiculata (L.) Walp.], 1979.
- ^ Volatile flavor components of cooked rice, 1978.
- ^ Chemical reactions involved in the deep-fat frying of foods, 1978, cited in Bản mẫu:EHC-ref.
- ^ Preparation of lipid-free protein extracts of egg yolk, 1978.
- ^ Solvent fractionation of leaf juice to prepare green and white protein products, 1978.
- ^ Studies on Liver Alcohol Dehydrogenase I. Equilibria and Initial Reaction Velocities, 1951. A Note of the Substrate Specificity of Horse Liver Alcohol Dehydrogenase, 1958. Reversible Oxidation of Cyclic Secondary Alcohols by Liver Alcohol Dehydrogenase, 1959. Human Liver Alcohol Dehydrogenase: Kinetic and Physiochemical Properties, 1964.
- ^ Métabilisation de différents alcools présents dans les biossons alcooliques chez le rat, 1965, cited in Bản mẫu:EHC-ref.
- ^ Bản mẫu:SIDS-ref.
- ^ Physico-chemical correlates of alcohol intoxication, 1978.
- ^ Determination of low molecular weight alcohols including fusel oil in various samples by diethyl ether extraction and capillary gas chromatography, 2005.
- ^ Defining maximum levels of higher alcohols in alcoholic beverages and surrogate alcohol products, 2008.
- ^ Effects of fusel oil on animal hangover models, 2003.
- ^ Butanol ingestion in an airport hangar, 2006.
- ^ Odor and Irritation Thresholds for 1-Butanol in Humans, 1996, cited in Bản mẫu:SIDS-ref.
- ^ Trigeminal and Olfactory Sensitivity: Comparison of Modalities and Methods of Measurement, 1998.
 GIẢM
24%
GIẢM
24%
 GIẢM
19%
GIẢM
19%
 GIẢM
42%
GIẢM
42%
 GIẢM
47%
GIẢM
47%
 GIẢM
37%
GIẢM
37%






![Một số thông tin về Đại quỷ tộc [Ogre] (Quỷ lớn) Tensura](https://1.bp.blogspot.com/-35QVuGjxuqo/XojJflBytoI/AAAAAAAAAP8/XtXaH2bNZ5Q5p5cSyW4bZRidK6ku386UgCLcBGAsYHQ/w700-h408-p-k-no-nu/tensuraova.jpg)
