Phản ứng tổng hợp chuỗi polymerase thời gian thực


Phản ứng tổng hợp chuỗi polymerase thời gian thực (tiếng Anh: Real-time PCR, còn được gọi là phản ứng chuỗi polymerase định lượng (qPCR), là một kỹ thuật thí nghiệm sinh học phân tử dựa trên phản ứng chuỗi polymerase (PCR). Nó theo dõi sự khuếch đại của một phân tử DNA được nhắm mục tiêu trong quá trình PCR (nghĩa là trong thời gian thực), chứ không phải ở phần cuối của nó như trong PCR thông thường. PCR thời gian thực có thể được sử dụng định lượng (PCR thời gian thực định lượng) và bán định lượng (nghĩa là trên/dưới một lượng phân tử DNA nhất định) (PCR thời gian thực bán định lượng).
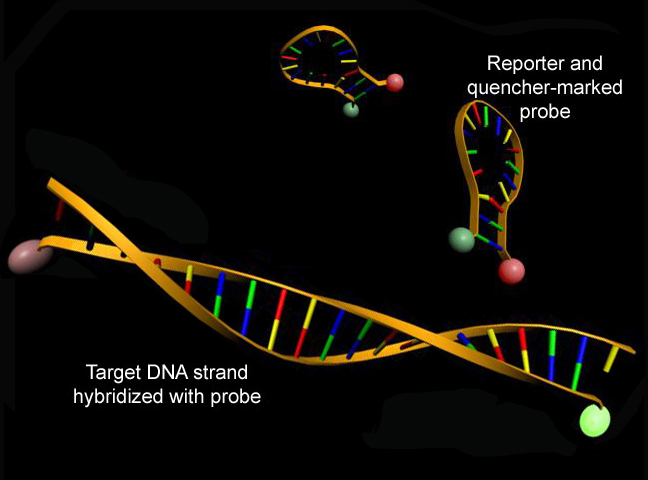
Hai phương pháp phổ biến để phát hiện các sản phẩm PCR trong PCR thời gian thực là (1) thuốc nhuộm huỳnh quang không đặc hiệu xen kẽ với bất kỳ DNA sợi kép và (2) đầu dò DNA đặc hiệu gồm oligonucleotide được dán nhãn bằng máy phóng huỳnh quang, cho phép phát hiện chỉ sau khi lai axit nucleic của đầu dò với trình tự bổ sung của nó.
MIQE đề xuất rằng qPCR viết tắt được sử dụng cho PCR thời gian thực định lượng và RT-qPCR được sử dụng để sao chép ngược qPCR.[1] Từ viết tắt "RT-PCR" thường biểu thị cho phản ứng tổng hợp chuỗi polymerase sao chép ngược, không phải dùng cho là PCR thời gian thực, nhưng không phải tất cả các tác giả đều tuân thủ quy ước này.[2]

Tham khảo
[sửa | sửa mã nguồn]- ^ Bustin SA, Benes V, Garson JA, Hellemans J, Huggett J, Kubista M, Mueller R, Nolan T, Pfaffl MW, Shipley GL, Vandesompele J, Wittwer CT (2009). "The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments". Clinical Chemistry. Quyển 55 số 4. tr. 611–622. doi:10.1373/clinchem.2008.112797. PMID 19246619.
- ^ Logan, Julie; Edwards, Kirstin & Saunders, Nick, biên tập (2009). Real-Time PCR: Current Technology and Applications. Caister Academic Press. ISBN 978-1-904455-39-4.
Thư mục
[sửa | sửa mã nguồn]- Elyse; Houde, Alain (2002). "La PCR en temps réel: principes et applications" (PDF). Reviews in Biology and Biotechnology. Quyển 2 số 2. tr. 2–11. Bản gốc (PDF) lưu trữ ngày 12 tháng 6 năm 2009.
- Bustin, SA (2000). "Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays". J Mol Endocrinol. Quyển 25 số 2. tr. 169–193. doi:10.1677/jme.0.0250169. PMID 11013345.
- Higuchi, R.; Dollinger, G.; Walsh, P.S.; Griffith, R. (1992). "Simultaneous amplification and detection of specific DNA-sequences". Bio-Technology. Quyển 10 số 4. tr. 413–417. doi:10.1038/nbt0492-413. PMID 1368485.
- Holland, P.M.; Abramson, R.D.; Watson, R.; Gelfand, D.H. (1991). "Detection of specific polymerase chain reaction product by utilizing the 50 !30 exonuclease activity of Thermus aquaticus DNA polymerase". Proc. Natl. Acad. Sci. USA. Quyển 88 số 16. tr. 7276–7280. doi:10.1073/pnas.88.16.7276. JSTOR 2357665. PMC 52277. PMID 1871133.
- Kubista, M; Andrade, JM; Bengtsson, M; Forootan, A; Jonak, J; Lind, K; Sindelka, R; Sjoback, R; Sjogreen, B (2006). "The real-time polymerase chain reaction". Mol. Aspects Med. Quyển 27 số 2–3. tr. 95–125. doi:10.1016/j.mam.2005.12.007. PMID 16460794.
- Higuchi, R.; Fockler, C.; Dollinger, G.; Watson, R. (1993). "Kinetic PCR: Real time monitoring of DNA amplification reactions". Biotechnology. Quyển 11 số 9. tr. 1026–1030. doi:10.1038/nbt0993-1026. PMID 7764001.
- Filion, M. (2012). Quantitative Real-time PCR in Applied Microbiology. Caister Academic Press. ISBN 978-1-908230-01-0.
- Wawrik, B; Paul, JH; Tabita, FR (2002). "Real-time PCR quantification of rbcL (ribulose-1,5-bisphosphate carboxylase/oxygenase) mRNA in diatoms and pelagophytes". Appl. Environ. Microbiol. Quyển 68 số 8. tr. 3771–3779. doi:10.1128/aem.68.8.3771-3779.2002. PMC 123995. PMID 12147471.
- Logan J; Edwards K; Saunders N, biên tập (2009). Real-Time PCR: Current Technology and Applications. Caister Academic Press. ISBN 978-1-904455-39-4.
 GIẢM
32%
GIẢM
32%
 GIẢM
43%
GIẢM
43%
 GIẢM
12%
GIẢM
12%
 GIẢM
40%
GIẢM
40%
 GIẢM
24%
GIẢM
24%




