Sinh học phân tử
| Đây là một trong loạt bài về |
| Hóa sinh |
|---|
 |
| Các nét quan trọng |
| Lịch sử và chủ đề |
| Thuật ngữ |
| Lĩnh vực: Sinh học, Sinh học phân tử, tế bào |


Sinh học phân tử là một phân ngành sinh học nhằm nghiên cứu cơ sở phân tử của các hoạt động sinh học bên trong và giữa các tế bào, bao gồm quá trình tổng hợp, biến đổi, cơ chế, và tương tác phân tử.[2][3][4] Nghiên cứu cấu trúc hóa học và vật lý của các đại phân tử được gọi là sinh học phân tử.[5]
Sinh học phân tử lần đầu tiên được mô tả là một phương pháp tiếp cận tập trung vào nền tảng của các hiện tượng sinh học, nhằm khám phá cấu trúc và các tương tác của những phân tử sinh học, và cách những tương tác này giải thích các hiện tượng của sinh học.[6]

Năm 1945, thuật ngữ "sinh học phân tử" được sử dụng bởi nhà vật lý William Astbury. Sự phát triển trong lĩnh vực sinh học phân tử xảy ra khá muộn do cơ thể sinh vật là một hệ thống phức tạp, và cách tiếp cận đơn giản và thuận tiện nhất là sử dụng các vi khuẩn và thể thực khuẩn chỉ có thể đưa ra thông tin về quá trình sinh học cơ bản. Vào năm 1953, hai nhà khoa học trẻ lúc bấy giờ tên Francis Crick và James Watson làm việc tại đơn vị Hội đồng Nghiên cứu Y khoa, phòng thí nghiệm Cavendish, Cambridge (nay là Phòng thí nghiệm Sinh học Phân tử MRC), đã tạo ra một mô hình mạch xoắn kép của DNA. Mô hình mới này đã thay đổi toàn bộ cấu trúc DNA mà họ đã đề xuất trước đó dựa trên các nghiên cứu được thực hiện bởi Rosalind Franklin và Maurice Wilkins. Sau mô hình cấu trúc DNA, các nghiên cứu của hai nhà khoa học tập trung chủ yếu vào mục tiêu tìm ra DNA bên trong các vi sinh vật, thực vật, và động vật khác.[5]
Sinh học phân tử không chỉ đơn giản là nghiên cứu các phân tử và sự tương tác của chúng. Nói chính xác hơn, sinh học phân tử là tập hợp các kỹ thuật được phát triển kể từ khi lĩnh vực này mới bắt đầu, cho phép các nhà khoa học tìm hiểu về các quá trình phân tử.[7] Một kỹ thuật đáng chú ý đã cách mạng hóa lĩnh vực này là phản ứng chuỗi polymerase (tiếng Anh: Polymerase Chain Reaction hay PCR), được phát triển vào năm 1983.[7] PCR là một phản ứng khuếch đại một lượng nhỏ DNA, và được sử dụng trong nhiều trong các ngành khoa học.[8][9]

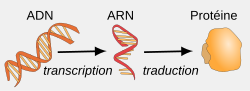
Luận thuyết trung tâm của sinh học phân tử cho rằng dòng thông tin chạy theo một chiều từ DNA đến mRNA rồi đến protein. Quá trình phiên mã, dịch mã và sao chép DNA tuân theo quy luật này. Một ngoại lệ phát hiện thấy ở một số virus mang RNA, có quá trình gọi là phiên mã ngược, tạo ra một bản sao DNA từ RNA hệ gen của chúng.[3][10][11][12][13][14]
Sinh học phân tử đóng một vai trò quan trọng trong sự hiểu biết về cấu trúc, chức năng, và quá trình kiểm soát nội môi bên trong các tế bào. Tất cả những tri thức trên đều có thể được sử dụng để phát triển các loại thuốc và phuơng pháp chẩn đoán bệnh mới, và hiểu rõ hơn về các quá trình sinh lý của tế bào.[15] Một số nghiên cứu lâm sàng và liệu pháp y tế phát triển từ sinh học phân tử được sử dụng trong liệu pháp gen. Trong khi đó, việc sử dụng sinh học phân tử hoặc sinh học tế bào phân tử trong y học hiện nay được gọi là y học phân tử.
Lịch sử
[sửa | sửa mã nguồn]

Sinh học phân tử là sự giao thoa giữa ngành di truyền học và hóa sinh. Ở thế kỷ 20 khi di truyền học và hóa sinh vừa hình thành và bắt đầu phát triển, cả hai lĩnh vực rõ ràng đều nỗ lực tìm cách xác định các cơ chế phân tử giúp tạo nên nền tảng cho các chức năng quan trọng của tế bào.[16] Những tiến bộ trong sinh học phân tử có liên quan chặt chẽ đến sự phát triển của các công nghệ mới và sự tối ưu hóa trong cả hai lĩnh vực di truyền học và hóa sinh.[17] Sinh học phân tử đã được làm sáng tỏ bởi công trình nghiên cứu của nhiều nhà di truyền học và hóa sinh, và do đó lịch sử của phân ngành này phụ thuộc vào sự hiểu biết của các nhà khoa học này và những thí nghiệm của họ.[cần dẫn nguồn]

Có thể nói, tất cả kiến thức hiện tại của sinh học phân tử đều bắt đầu từ hiện tượng biến nạp ở vi khuẩn. Năm 1928, Frederick Griffith, đã quan sát thấy hiện tượng biến đổi từ vi khuẩn này sang vi khuẩn khác mà ngày nay được gọi là biến nạp, và ở thời điểm đó, ông không thể tìm ra lý do để giải thích sự việc này.[18] Do đó, người ta còn gọi ông là nhà vi sinh vật học. Mãi cho đến năm 1944, ba nhà khoa học Oswald Avery, Colin Macleod và Maclyn McCarty, đã chứng minh toàn bộ hiện tượng biến nạp ở vi khuẩn. Vào năm 1930, hai năm sau thí nghiệm của Griffith, sinh học phân tử được thành lập như một phân ngành khoa học chính thức. Tuy nhiên, thuật ngữ “sinh học phân tử” vẫn chưa tồn tại cho đến năm 1938 khi nhà khoa học Warren Weaver, người đang làm việc với tư cách là giám đốc lĩnh vực Khoa học Tự nhiên tại Quỹ Rockefeller, đặt tên phân ngành này là sinh học phân tử.
Sau một loạt các thí nghiệm được trải dài sang nhiều năm, những nhà nghiên cứu sinh học phân tử mới kết luận được rằng DNA là vật chất di truyền cơ bản gây ra các biến đổi di truyền. Thành phần cơ bản của DNA chứa bốn nucleobase là - Adenin (A), Guanin (G), Thymine (T), và Cytosine (C). Dựa trên thành phần hóa học và thông tin từ tinh thể học tia X được thực hiện bởi Maurice Wilkins và Rosalind Franklin, cấu trúc ADN đã được đề xuất bởi James Watson và Francis Crick. Tuy nhiên, trước khi Watson và Crick đề xuất cấu trúc DNA, vào năm 1950, nhà khoa học người Áo Erwin Chargaff, đã đề xuất một lý thuyết hay quy luật mà ngày nay được gọi là quy luật Chargaff. Quy luật nêu rằng tỷ lệ của Adenin với Thymine và Guanin với Cytosine là bằng nhau.
- Quy luật Chargaff:
Nguyên văn:
"Chargaff's rule stated that DNA from any species of any organism should have a 1:1 stoichiometric ratio of purine and pyrimidines (i.e., A+G=T+C) and, more specifically, that the amount of guanine should be equal to cytosine and the amount of adenine should be equal to thymine. This pattern is found in both strands of the DNA".
Tạm dịch:
"Quy luật Chargaff nêu rằng DNA từ bất kỳ loài sinh vật nào đều phải có tỷ lệ phân cực là 1:1 giữa purine và pyrimidine (tức là A + G = T + C) và đặc biệt hơn, số lượng guanine phải bằng cytosine, và số lượng adenine phải bằng thymine. Mô típ này được tìm thấy ở cả hai mạch của DNA".
Lĩnh vực di truyền học ra đời như một nỗ lực nhằm tìm hiểu các cơ chế phân tử của di truyền gen và cấu trúc của một gen. Gregor Mendel đã đi tiên phong trong công việc này vào năm 1866 khi ông lần đầu tiên viết các quy luật di truyền dựa trên các nghiên cứu của mình về phép lai giao phối ở cây đậu.[19] Một trong những quy luật di truyền là quy luật phân li. Quy luật này phát biểu rằng các cá thể lưỡng bội có hai alen cho một gen cụ thể sẽ truyền một trong các alen này cho con cái của chúng.[20] Do có vai trò quan trọng trong lĩnh vực di truyền học, các nghiên cứu về di truyền gen thường được gọi là di truyền Mendel.[21]
Một cột mốc quan trọng trong phân ngành sinh học phân tử là việc tìm ra cấu trúc của DNA. Công việc này bắt đầu vào năm 1869 bởi Friedrich Miescher, một nhà hóa sinh người Thụy Sĩ, người đầu tiên đề xuất một cấu trúc gọi là nuclein, mà ngày nay chúng ta biết là deoxyribonucleic acid, hay DNA.[22] Ông đã phát hiện ra chất hóa học này bằng cách nghiên cứu các thành phần có trong mủ dính trên băng dán cá nhân, và ghi nhận các đặc tính độc đáo của "chất chứa phosphorus".[23] Một người đóng góp quan trọng khác cho mô hình DNA là Phoebus Levene, người đã đề xuất "mô hình polynucleotide" của DNA vào năm 1919 dựa trên kết quả của các thí nghiệm sinh hóa của ông trên nấm men.[24] Vào năm 1950, Erwin Chargaff đã mở rộng nghiên cứu của Levene và làm sáng tỏ một số đặc tính quan trọng của nucleic acid. Thứ nhất, trình tự của nucleic acid trên các loài khác nhau.[25] Thứ hai, tổng nồng độ của purine (A và G) luôn bằng tổng nồng độ của pyrimidine (C và T) và điều này bây giờ được gọi là quy luật Chargaff.[22] Năm 1953, James Watson và Francis Crick công bố cấu trúc xoắn kép của DNA[26] dựa trên công trình tinh thể học tia X do Rosalind Franklin và Maurice Wilkins thực hiện. Watson và Crick mô tả cấu trúc của DNA và phỏng đoán về ảnh hưởng của cấu trúc độc đáo này đối với cơ chế nhân bản DNA. Sau cùng, J. D. Watson và F. H. C. Crick đã được trao giải Nobel năm 1962, cùng với Maurice Wilkins, vì đã đề xuất một mô hình về cấu trúc của ADN.[26]
Thời gian trôi qua, vào năm 1964, Kjeld Marker và Frederick Sanger đã phát hiện ra một RNA vận chuyển amioacyl đặc biệt ở E.coli, được gọi là RNA vận chuyển N-formyl-methionyl và giải thích rằng phân tử này đóng một vai trò trong cơ chế đặc biệt của quá trình kéo dài mạch khi tế bào dịch mã. Ông đã được trao giải Nobel thứ hai vì đã tìm ra trình tự hoàn chỉnh bao gồm 5400 nucleotide trên mạch đơn DNA của thể thực khuẩn Phi X174.
Vào năm 1961, các nhà khoa học đã chứng minh được rằng khi một gen mã hóa thành protein, ba base liên tiếp của DNA của gen sẽ chỉ định từng amini acid kế tiếp của protein.[27] Do đó, mã di truyền là mã bộ ba, trong đó mỗi bộ ba (được gọi là codon) chỉ định một amino acid cụ thể. Hơn nữa, các nghiên cứu chỉ ra rằng các codon không chồng chéo với nhau trong trình tự DNA và mỗi trình tự được đọc từ một điểm bắt đầu cố định.
Trong giai đoạn 1962–1964, thông qua việc sử dụng các thể thực khuẩn mang đột biến gây tự chết có điều kiện,[28] các nhà sinh học phân tử đã đạt được những tiến bộ cơ bản trong việc hiểu biết về các chức năng và tương tác của các protein được sử dụng trong quá trình sao chép, sửa chữa, và tái tổ hợp DNA, và trong việc hình thành các cấu trúc phân tử.
Thí nghiệm Griffith
[sửa | sửa mã nguồn]
Năm 1928, Frederick Griffith, đã phát hiện độc tính của phế cầu khuẩn khi loại vi trùng này khiến chuột trong phòng thí nghiệm tử vong. Dựa trên di truyền Mendel, tử tưởng được dùng phổ biến vào lúc bấy giờ, việc chuyển gen chỉ có thể xảy ra từ tế bào mẹ sang tế bào con. Griffith đưa ra một lý thuyết khác với lý luận rằng sự chuyển gen cũng có thể xảy ra giữa các thành viên của cùng một thế hệ, và quá trình này được gọi là chuyển gen ngang (tiếng Anh: Horizontal Gene Transfer hay HGT). Ngày nay, hiện tượng này được gọi là biến nạp.
Trong thí nghiệm của mình, Griffith đã đề cập đến loài phế cầu khuẩn Streptococcus pneumoniae. Loài vi khuẩn này có hai chủng khác nhau: một loại có độc tính và bờ nhẵn smooth (S), và một loại trung tính không độc và nhám rough (R). Nhìn bằng mắt thường, dòng S có vẻ ngoài lấp lánh do sự hiện diện của một loại polysaccharide đặc trưng ở vỏ bọc tạo thành bởi polymer của glucuronic acid và glucose. Nhờ sự hiện diện của lớp polysaccharide, hệ thống miễn dịch của vật chủ không thể phát hiện vi khuẩn, và điều này giúp sinh vật này có thể phát độc và giết chết vật chủ. Trong khi đó, loài trung tính không độc R còn lại, do thiếu vỏ bọc chứa lớp polysaccharide, nên loài này có vẻ ngoài sần sùi và xỉn màu.
Sự hiện diện của vỏ bọc ở phế cầu khuẩn có thể được xác định thông qua di truyền học. Chủng S và R có thể tồn tại ở nhiều dạng khác nhau như S-I, S-II, S-III,... và tương ứng là R-I, R-II, R-III, v.v. Tất cả các phân nhóm của chủng S và R nêu trên được phân loại dựa vào loại kháng nguyên khác nhau mà chúng tạo ra.[5]
Thí nghiệm Hershey-Chase
[sửa | sửa mã nguồn]
Thí nghiệm của Alfred Hershey và Martha Chase đã xác nhận DNA là vật chất di truyền khiến chuột của trong thí nghiệm Griffith bị nhiễm độc của phế cầu khuẩn và tử vong. Thí nghiệm này còn được gọi là thí nghiệm máy xay sinh tố do hai nhà khoa học liên tục dùng loại xay sinh tố thường được sử dụng nhà bếp như một thiết bị chính. Trong thí nghiệm của mình, Hershey và Chase sử dụng E.coli và thể thực khuẩn, và kết quả đã chứng minh rằng DNA của thể thực khuẩn, sau khi lây nhiễm vào tế bào vi khuẩn, có chứa tất cả thông tin cần thiết để tổng hợp các thể thực khuẩn đời con cháu. Hai nhà khoa học đã đánh dấu lớp vỏ protein của thể thực khuẩn bằng đồng vị phóng xạ lưu huỳnh. Trong khi đó, DNA của thể thực khuẩn được đánh dẫu bằng đồng vị phóng xạ phosphorus. Sau đó, hai mẫu thể thực khuẩn tách biệt lần lượt được cho vào hai ống nghiệm khác nhau. Sau khi trộn thể thực khuẩn bị nhiễm phóng xạ và E.coli ở trong ống nghiệm, hai mẫu được ủ ở điều kiện thích hợp nhằm khiến cho thể thực khuẩn có thể chuyển vật chất di truyền (protein hoặc DNA) sang tế bào E.coli. Tiếp theo, hỗn hợp vi khuẩn và thể thực khuẩn được đưa vào máy xay sinh tố để trộn hoặc khuấy động nhằm tách thể thực khuẩn ra khỏi tế bào E.coli. Toàn bộ hỗn hợp được ly tâm. Phần cặn bên dưới đáy ống nghiệm có chứa tế bào E.coli được giữ lại và kiểm tra, còn phần loại chất lỏng được loại bỏ. Sau khi kiểm tra tế bào E.coli chỉ chứa đồng vị phóng xạ phốt pho, điều này cho thấy vật chất di truyền được biến nạp là DNA chứ không phải là protein.
DNA của thể thực khuẩn sau khi biến nạp sẽ được tích hợp vào DNA của E.coli. Do đó, phần DNA của E.coli bị nhiễm phóng xạ thực chất là của thể thực khuẩn. Khi vi khuẩn tiếp tục phát triển và sinh sản, đoạn DNA đột biến này có thể được truyền lại cho thế hệ tiếp theo, và từ đây, lý thuyết về tải nạp gen đã ra đời. Tải nạp là một quá trình trong đó DNA của vi khuẩn có chứa một đoạn ADN của thể thực khuẩn, và đoạn DNA này sẽ được truyền cho thế hệ vi khuẩn tiếp theo. Đồng thời, tải nạp có thể được xem là một ví dụ của hoạt động chuyển gen ngang.[5]
Sinh học phân tử hiện đại
[sửa | sửa mã nguồn]Khi xã hội loài người đang dần bước đến giữa những năm 20 của thế kỷ 21, sinh học phân tử cũng đang bước vào thời kỳ hoàng kim nhờ vào sự phát triển của khoa học kỹ thuật. Các công nghệ mới đang cho phép theo dõi các quá trình sinh học ở cấp độ nguyên tử ở thời gian thực.[29] Ngày nay, các nhà sinh học phân tử có thể truy cập vào kho dữ liệu trình tự DNA của các loài đồ sộ với một mức chi phí hợp lý, và điều này đã tạo điều kiện phát triển các phương pháp chỉnh sửa gen mới ở các sinh vật khác bên cạnh sinh vật mô hình. Tương tự như vậy, các nhà sinh học phân tử tổng hợp sẽ thúc đẩy quá trình sản xuất công nghiệp các tiểu và đại phân tử thông qua việc phát triển các con đường trao đổi chất ngoại sinh trong các dòng tế bào nhân sơ và nhân thực khác nhau.[30]
Dữ liệu trình tự sinh học ngày càng có giá cả phải chăng hơn khiến cho nó sử dụng trong nhiều lĩnh vực khoa học khác nhau. Điều này hứa hẹn sẽ thúc đẩy sự phát triển của các ngành công nghiệp ở các quốc gia đang phát triển, và giúp tăng khả năng các nhà nghiên cứu tư nhân có thể tiếp cận được thông tin cần thiết cho những thực nghiệm của học. Ngoài ra, các thí nghiệm chỉnh sửa gen dùng công nghệ CRISPR-Cas9 hiện có thể được thực hiện trên các sinh vật mới bởi các công ty tư nhân với giá dưới 10.000 đô la, và điều này sẽ giúp thúc đẩy cho sự phát triển của việc ứng dụng công nghệ này vào các lĩnh vực công nghiệp và y tế.[31]
Quan hệ với các phân ngành sinh học khác
[sửa | sửa mã nguồn]
- Xét về định nghĩa:[32]
- Sinh học phân tử là nghiên cứu về cơ sở phân tử của các hiện tượng sinh học, tập trung vào những quá trình tổng hợp, biến đổi, cơ chế, hay tương tác phân tử.
- Hóa sinh là nghiên cứu về các chất hóa học và các quá trình quan trọng xảy ra trong cơ thể sinh vật. Các nhà hóa sinh tập trung chủ yếu vào vai trò, chức năng, và cấu trúc của các đại phân tử như protein, lipid, cacbohydrate, và nucleic acid.[33]
- Di truyền học là nghiên cứu về cách những khác biệt về mặt di truyền ảnh hưởng đến các sinh vật. Di truyền học cố gắng dự đoán cách các đột biến, các gen riêng lẻ, và các tương tác di truyền có thể ảnh hưởng đến biểu hiện gen và quá trình tạo nên một kiểu hình.[34]
Khi các nhà khoa học thực hành những kỹ thuật cụ thể cho nghiên cứu sinh học phân tử, họ sẽ thường kết hợp các kỹ thuật này với nhiều phương pháp khác từ phân ngành di truyền học và hóa sinh. Phần lớn sinh học phân tử là nghiên cứu định lượng, và trong thời gian gần đây, một lượng lớn công việc đã được thực hiện bằng cách sử dụng các kỹ thuật khoa học máy tính như trong tin sinh học và sinh học tính toán. Di truyền phân tử, hay việc nghiên cứu về cấu trúc và chức năng của gen, là một trong những lĩnh vực phụ nổi bật nhất của sinh học phân tử kể từ đầu những năm 2000. Sinh học phân tử cung cấp thông tin cho các phân ngành sinh học khác theo cả hai cách trực tiếp và gián tiếp. Ở cách trực tiếp, sinh học phân tử nghiên cứu tương tác của các phân tử và những kết quả gặt hái được sau này giúp mở rộng kiến thức cho các phân ngành như sinh học tế bào hay sinh học phát triển. Ở cách gián tiếp, các kỹ thuật trong sinh học phân tử được ứng dụng để tìm các đặc tính lịch sử của các quần thể hoặc loài, và những thông tin có được từ việc làm này giúp phong phú thêm kiến thức trong lĩnh vực sinh học tiến hóa như di truyền học quần thể và phát sinh chủng loài học. Ngoài ra, cũng có một truyền thống lâu đời về việc nghiên cứu các phân tử sinh học ở cấp độ thấp nhất (hay ở cấp độ phân tử) trong phân ngành lý sinh học.[35]
Các kỹ thuật trong sinh học phân tử
[sửa | sửa mã nguồn]
Nhân bản phân tử
[sửa | sửa mã nguồn]
Nhân bản phân tử là một kỹ thuật được sử dụng để phân lập và chuyển chuỗi DNA mong muốn vào một tác nhân (hay còn gọi là vector) plasmid.[36] Công nghệ DNA tái tổ hợp này được phát triển lần đầu tiên vào những năm 1960.[37] Trong kỹ thuật này, trình tự DNA mã hóa cho một protein mong muốn sẽ được nhân bản bằng phản ứng chuỗi polymerase (PCR) hoặc các enzym giới hạn để trờ thành một plasmid (vector biểu hiện). Vector plasmid thường có ít nhất 3 thành phần đặc biệt: vị trí bắt đầu sao chép (điểm ori), các vị trí tạo dòng (tiếng Anh: Multiple Cloning Site hay MCS), và marker chọn lọc (thường là các gen giúp kháng các loại kháng sinh). Ngoài ra, nằm ở vị trí ngược dòng của MCS là vùng gen khởi động và vị trí bắt đầu quá trình phiên mã nhằm giúp điều hòa sự biểu hiện của gen được nhân bản.
Sau khi được tổng hợp, plasmid có thể được đưa vào tế bào vi khuẩn hoặc động vật. Việc đưa ADN vào tế bào vi khuẩn có thể được thực hiện bằng cách biến nạp thông qua hấp thụ DNA trần, hay tiếp hợp thông qua tiếp xúc giữa tế bào, hoặc tải nạp thông qua vector virus. Việc đưa DNA vào tế bào nhân thực, chẳng hạn như tế bào động vật, bằng các phương pháp vật lý hoặc hóa học được gọi là quá trình chuyển nạp. Có nhiều kỹ thuật chuyển nạp khác nhau như chuyển nạp calcium phosphate, điện phân, vi tiêm, hay chuyển nạp liposome. Plasmid có thể được tích hợp vào bộ gen của tế bào chủ và tạo nên hiện tượng chuyển nạp ổn định.[38][39] Đồng thời, plasmid cũng có thể tồn tại độc lập với bộ gen của tế bào chủ và được biểu hiện tạm thời, và hiện tượng này được gọi là chuyển nạp thoáng qua.
Khi DNA mã hóa cho một protein mong muốn nằm bên trong tế bào, protein đó hiện có thể được biểu hiện. Nhiều yếu tố khác nhau, chẳng hạn như tương tác giữa chất xúc tiến cảm ứng với vùng gen khởi động hay các tín hiệu tế bào cụ thể, giúp quá trình tổng hợp protein mong muốn xảy ra ở một mức độ cao. Sau khi quá trình này hoàn tất, một lượng lớn protein có thể được chiết xuất từ tế bào vi khuẩn hoặc tế bào nhân thực. Protein lúc này có thể được mang đi để kiểm tra hoạt động xúc tác trong nhiều tình huống khác nhau. Ngoài ra, protein có thể được kết tinh để có thể nghiên cứu cấu trúc bậc ba của nó, hoặc, trong ngành dược phẩm, có thể nghiên cứu hoạt tính của các loại thuốc mới đối với protein.[40]
Phản ứng chuỗi polymerase
[sửa | sửa mã nguồn]Phản ứng chuỗi polymerase (PCR) là một kỹ thuật để sao chép DNA có tính ứng dụng cao. Kỹ thuật PCR cho phép sao chép hoặc sửa đổi một trình tự DNA cụ thể theo những cách đã được định sẵn. Phản ứng này cực kỳ công hiệu, và trong điều kiện hoàn hảo có thể khuếch đại một phân tử DNA trở thành 1,07 tỷ phân tử trong vòng chưa đầy hai giờ. PCR có nhiều ứng dụng, bao gồm nghiên cứu biểu hiện gen, phát hiện vi sinh vật gây bệnh, phát hiện đột biến gen, và đưa đột biến vào đoạn DNA.[41] Kỹ thuật PCR có thể được sử dụng để đưa các vị trí enzyme giới hạn vào các đầu của phân tử DNA, hoặc để kích thích đột biến của một base cụ thể trên đoạn DNA thông qua phương pháp gây đột biến có định hướng. PCR cũng có thể được sử dụng để xác định xem một đoạn DNA cụ thể có được tìm thấy trong thư viện DNA bổ sung (cDNA) hay không. PCR có nhiều biến thể, như PCR phiên mã ngược (RT-PCR) để khuếch đại RNA, và gần đây là PCR định lượng cho phép đo lường chính xác số phân tử DNA hoặc RNA.[42][43]

Điện di trên gel
[sửa | sửa mã nguồn]
Điện di trên gel là một kỹ thuật tách các phân tử theo kích thước của chúng bằng cách sử dụng gel agarose hoặc polyacrylamide.[44] Kỹ thuật này là một trong những công cụ chính của sinh học phân tử. Nguyên tắc cơ bản của kỹ thuật này là các đoạn DNA với kích thước có thể được tách ra bằng cách cho dòng điện chạy qua gel. Bởi vì khung xương của DNA chứa các nhóm phosphate mang điện tích âm, nên DNA sẽ di chuyển qua gel agarose về phía đầu dương của dòng điện.[44] Protein cũng có thể được phân tách dựa trên kích thước bằng cách sử dụng gel SDS-PAGE, hoặc dựa trên kích thước và điện tích của chúng bằng cách sử dụng phương pháp điện di trên gel 2D.[45]

Phương pháp xét nghiệm Bradford
[sửa | sửa mã nguồn]Thử nghiệm Bradford là một kỹ thuật sinh học phân tử cho phép định lượng nhanh chóng và chính xác các phân tử protein bằng cách sử dụng các đặc tính độc đáo của một loại thuốc nhuộm có tên là Coomassie Brilliant Blue G-250.[46] Coomassie Blue trải qua một sự chuyển đổi màu sắc có thể nhìn thấy từ màu nâu đỏ sang màu xanh lam sáng khi liên kết với protein. Ở trạng thái điện tích dương (cation), cấu trúc của thuốc nhuộm không ổn định và có bước sóng nền là 465 nm và tạo ra màu nâu đỏ. Khi Coomassie Blue liên kết với protein trong dung dịch axit, bước sóng nền chuyển sang 595 nm và thuốc nhuộm tạo ra màu xanh lam sáng. Protein trong xét nghiệm liên kết với màu xanh lam Coomassie trong khoảng 2 phút và phức hợp protein-thuốc nhuộm có cấu trúc ổn định trong khoảng một giờ, mặc dù người ta khuyến cáo rằng các phép đo độ hấp thụ được thực hiện trong vòng 5 đến 20 phút sau khi bắt đầu phản ứng. Sau đó, nồng độ của protein trong xét nghiệm Bradford có thể được đo bằng máy quang phổ mà không cần một thiết bị đắt tiền nào khác.
Phương pháp này được phát triển vào năm 1975 bởi Marion M. Bradford, và đã cho phép định lượng protein nhanh và chính xác hơn đáng kể so với các phương pháp trước đó như quy trình Lowry hay xét nghiệm biuret. Không giống như các phương pháp trước đây, xét nghiệm Bradford không dễ bị nhiễu bởi một số phân tử không phải protein, bao gồm ethanol, Natri chloride, hay Magnesi chloride. Tuy nhiên, phương pháp này dễ bị ảnh hưởng bởi các chất đệm kiềm mạnh, chẳng hạn như sodium dodecyl sulfate (SDS).
Các phương pháp thấm và hybridization probe (probe) các đại phân tử
[sửa | sửa mã nguồn]Các thuật ngữ Northern (phương bắc), Western (phương tây), và Eastern (phương đông) có nguồn gốc ban đầu là từ một trò đùa trong phân ngành sinh học phân tử khi các nhà khoa học đặt tên nhằm chơi chữ với thuật ngữ Southern blotting (phương pháp thấm Southern), sau khi kỹ thuật được Edwin Southern mô tả để lai tạo DNA bị thấm. Patricia Thomas, nhà phát triển phương pháp thấm ARN mà sau đó được gọi là Northern blot (phương pháp thấm Northern), thực sự không sử dụng thuật ngữ này.
Phương pháp thấm Southern
[sửa | sửa mã nguồn]Phương pháp thấm Southern được đặt theo tên người phát minh ra kỹ thuật này là nhà sinh vật học Edwin Southern. Đây là một phương pháp để probe hay thăm dò sự hiện diện của một chuỗi DNA cụ thể trong một mẫu hỗn hợp DNA. Các mẫu DNA trước hoặc sau khi cắt bằng enzyme giới hạn (endonuclease giới hạn) sẽ được phân tách bằng phương pháp điện di trên gel và sau đó được chuyển sang màng lọc bằng cách thấm nhờ vào hiện tượng mao dẫn. Sau đó, màng lọc này được tiếp xúc với một đầu dò DNA được đánh dấu có chứa trình tự gen có thể lai ghép với đoạn DNA quan tâm thông qua nguyên tắc bổ sung. Phương pháp thấm Southern ngày này ít được sử dụng hơn trong các phòng thí nghiệm khoa học do sự ưu việt hơn của các kỹ thuật khác, chẳng hạn như PCR, để phát hiện các trình tự DNA cụ thể từ các mẫu DNA. Tuy nhiên, phương pháp này vẫn được sử dụng cho một số ứng dụng, chẳng hạn như đo số bản sao gen biến đổi ở chuột biến đổi gen hoặc trong kỹ thuật tạo dòng tế bào gốc phôi bằng phương pháp gen knockout.
Phương pháp thấm Northern
[sửa | sửa mã nguồn]Phương pháp thấm Northern được sử dụng để nghiên cứu sự hiện diện của các phân tử RNA cụ thể nhằm so sánh tương đối giữa một tập hợp các mẫu RNA khác nhau. Về cơ bản, kỹ thuật này là sự kết hợp giữa phương pháp điện di trên gel của RNA biến tính với phương pháp thấm. Trong quá trình này, RNA được phân tách dựa trên kích thước và sau đó được chuyển đến màng lọc trước khi được thăm dò thông qua nguyên tắc bổ sung với một trình tự quan tâm được đánh dấu. Kết quả có thể được hình dung thông qua nhiều cách khác nhau tùy thuộc vào chất đánh dấu được sử dụng. Tuy nhiên, hầu hết kết quả được nhìn thấy là các dải đại diện cho kích thước của RNA được phát hiện trong mẫu. Cường độ của các dải này liên quan đến số lượng RNA mục tiêu trong các mẫu được phân tích. Quy trình này thường được sử dụng để nghiên cứu thời điểm và mức độ biểu hiện gen bằng cách đo lượng RNA đó hiện diện trong các mẫu khác nhau với giả định rằng không xảy ra quá trình điều hòa sau phiên mã và các mức RNA thông tin phản ánh mức tỷ lệ của protein tương ứng được sản xuất. Phương pháp này là một trong những công cụ cơ bản nhất để xác định thời điểm và điều kiện một số gen nhất định được biểu hiện trong các mô sống
Phương pháp thấm Western
[sửa | sửa mã nguồn]Phương pháp thấm Western là một kỹ thuật mà các protein cụ thể có thể được phát hiện từ một hỗn hợp các protein. Kỹ thuật này có thể được sử dụng để xác định kích thước của các protein cô lập, cũng như để định lượng sự biểu hiện của chúng. Trong phương pháp thấm Western, các protein lần đầu tiên được phân tách theo kích thước trong một lớp gel mỏng được kẹp giữa hai tấm thủy tinh, và kỹ thuật này được gọi là SDS-PAGE. Các protein trong gel sau đó được chuyển sang màng polyvinylidene fluoride (PVDF), nitrocellulose, nylon, hoặc các màng hỗ trợ khác. Màng lọc này sau đó có thể được thăm dò bằng các dung dịch kháng thể. Các kháng thể liên kết cụ thể với protein quan tâm sau đó có thể được hình dung bằng nhiều kỹ thuật khác nhau, bao gồm các phẩm màu, chất phát quang hóa học, hoặc chất phóng xạ tự chụp. Thông thường, các kháng thể được đánh dấu bằng các enzyme. Khi một chất nền phát quang hóa học được tiếp xúc với enzyme, tổ hợp này có thể được phát hiện. Sử dụng kỹ thuật thấm Western hông chỉ cho phép phát hiện mà còn cho phép phân tích định lượng. Các phương pháp tương tự với phương pháp này có thể được sử dụng để nhuộm trực tiếp các protein cụ thể trong tế bào sống hoặc các phần mô
Phương pháp thấm Eastern
[sửa | sửa mã nguồn]Phương pháp thấm Eastern được sử dụng để phát hiện các biến đổi sau quá trình dịch mã của protein. Trong kỹ thuật này, protein thấm trên màng PVDF hoặc nitrocellulose được kết hợp với các chất nền cụ thể nhằm thăm dò các sửa đổi của protein sau dịch mã.
Kỹ thuật ADN microarray
[sửa | sửa mã nguồn]Một DNA microarray hay DNA chip là một tập hợp các điểm được gắn vào một giá đỡ vững chắc như kính hiển vi, và trong mỗi điểm chứa một hoặc nhiều đoạn oligonucleotide DNA sợi đơn. Các dãy hay array giúp đặt một số lượng lớn các điểm rất nhỏ (đường kính 100 micromet) trên một mặt kính duy nhất. Mỗi điểm có một phân tử đoạn DNA bổ sung cho một chuỗi ADN đơn. Một biến thể của kỹ thuật này cho phép biểu hiện gen của một sinh vật ở một giai đoạn phát triển cụ thể. Trong kỹ thuật này, RNA trong mô được phân lập và chuyển đổi thành DNA bổ sung (cDNA) được đánh dấu. cDNA này sau đó được lai với các đoạn trên dãy, và hình ảnh của quá trình lai có thể được ghi lại. Vì nhiều dãy có thể được tạo thành bởi các đoạn gen giống nhau, điều này đặc biệt hữu ích để so sánh sự biểu hiện gen của hai mô khác nhau, chẳng hạn như mô khỏe mạnh và mô ung thư. Ngoài ra, người ta có thể đo những gen nào được biểu hiện và biểu hiện đó thay đổi như thế nào theo thời gian hoặc với các yếu tố khác. Có nhiều cách khác nhau để chế tạo các dãy; phổ biến nhất là các chip silicon, các lam kính hiển vi với các điểm có đường kính ~ 100 micromet, các dãy được tinh chỉnh, và các dãy với các điểm lớn trên bề mặt một tấm màng với nhiều lỗ (macroarrays). Có thể có từ 100 điểm đến hơn 10,000 trên một dãy nhất định. Dãy cũng có thể được tạo bằng các phân tử khác ngoài DNA.
Oligonucleotide đặc hiệu alen
[sửa | sửa mã nguồn]Oligonucleotide đặc hiệu alen (tiếng Anh: Allele-specific oligonucleotide hay ASO) là một kỹ thuật cho phép phát hiện các đột biến cơ sở đơn lẻ mà không cần dùng đến kỹ thuật PCR hoặc điện di trên gel. Các mẫu dò ngắn (chiều dài khoảng 20–25 nucleotide) được đánh dấu và cho tiếp xúc với DNA mục tiêu không phân mảnh. Quá trình lai xảy ra với độ đặc hiệu cao do chiều dài của các đầu dò tương đối ngắn, và thậm chí một sự thay đổi của một base đơn lẻ sẽ cản trở quá trình lai. DNA mục tiêu sau đó được rửa sạch nhằm loại bỏ các mẫu dò được đánh dấu không lai. DNA mục tiêu sau đó được phân tích để tìm ra sự hiện diện của mẫu dò thông qua phóng xạ hoặc huỳnh quang. Trong thí nghiệm này, cũng như trong hầu hết các kỹ thuật sinh học phân tử khác, một nhóm kiểm soát phải được sử dụng để chắc chắn rằng thí nghiệm thành công.
Trong sinh học phân tử, các quy trình và công nghệ liên tục được phát triển và các công nghệ cũ hơn bị loại bỏ. Ví dụ, trước khi xuất hiện kỹ thuật điện di trên gel (agarose hoặc polyacrylamide) cho DNA, kích thước của các phân tử DNA thường được xác định bằng tốc độ lắng trong gradient đường sucrose, một kỹ thuật chậm, tốn nhiều công sức, và đòi hỏi thiết bị đo đắt tiền. Và trước kỹ thuật gradient đường sucrose, máy đo độ nhớt đã được sử dụng để đo kích thước phân tử DNA. Đôi khi, việc hiểu biết các công nghệ cũ là cần thiết vì các kỹ thuật này có thể trở nên hữu ích khi giải quyết một vấn đề mới khác mà các công nghệ mới hơn không thể làm được.
Tham khảo
[sửa | sửa mã nguồn]- ^ "ScienceimageAdenovirus".
- ^ Alberts B, Johnson A, Lewis J, Morgan D, Raff M, Roberts K, Walter P (2014). Molecular Biology of the Cell, Sixth Edition. Garland Science. tr. 1–10. ISBN 978-1-317-56375-4.
- ^ a b Gannon F (tháng 2 năm 2002). "Molecular biology--what's in a name?". EMBO Reports. Quyển 3 số 2. tr. 101. doi:10.1093/embo-reports/kvf039. PMC 1083977. PMID 11839687.
- ^ "Molecular biology - Latest research and news | Nature". www.nature.com (bằng tiếng Anh). Truy cập ngày 7 tháng 11 năm 2021.
- ^ a b c d S., Verma, P. (2004). Cell biology, genetics, molecular biology, evolution and ecology. S Chand and Company. ISBN 81-219-2442-1. OCLC 1045495545.
{{Chú thích sách}}: Quản lý CS1: nhiều tên: danh sách tác giả (liên kết) - ^ Astbury, W. T. (tháng 6 năm 1961). "Molecular Biology or Ultrastructural Biology ?". Nature (bằng tiếng Anh). Quyển 190 số 4781. tr. 1124. Bibcode:1961Natur.190.1124A. doi:10.1038/1901124a0. ISSN 1476-4687. PMID 13684868. S2CID 4172248.
- ^ a b Morange, Michel (ngày 15 tháng 2 năm 2016), "History of Molecular Biology", eLS, Chichester, UK: John Wiley & Sons, Ltd, tr. 1–8, doi:10.1002/9780470015902.a0003079.pub3, ISBN 9780470016176, truy cập ngày 7 tháng 11 năm 2021
- ^ "Polymerase Chain Reaction (PCR)", Definitions, Qeios, ngày 26 tháng 11 năm 2019, doi:10.32388/167113, S2CID 94561339
- ^ "Smithsonian Institution Archives". siarchives.si.edu. Bản gốc lưu trữ ngày 13 tháng 3 năm 2011. Truy cập ngày 7 tháng 11 năm 2021.
- ^ GS.TS. Lê Đình Lương - Nguyên Lý Kỹ Thuật Di Truyền (trang 11). Hà Nội: Khoa Học và Kỹ Thuật. 2001.
- ^ "central dogma".
- ^ SGK "Sinh học 12" - Nhà xuất bản Giáo dục, 2016.
- ^ SGK "Sinh học 9" - Nhà xuất bản Giáo dục, 2017.
- ^ Cox, Michael M. (ngày 16 tháng 3 năm 2015). Molecular biology: principles and practice. Doudna, Jennifer A.,, O'Donnell, Michael (Biochemist) . New York. ISBN 978-1-4641-2614-7. OCLC 905380069.
{{Chú thích sách}}: Quản lý CS1: địa điểm thiếu nhà xuất bản (liên kết) - ^ Bello, Elizabeth A.; Schwinn, Debra A. (ngày 1 tháng 12 năm 1996). "Molecular Biology and Medicine: A Primer for the Clinician". Anesthesiology. Quyển 85 số 6. tr. 1462–1478. doi:10.1097/00000542-199612000-00029. ISSN 0003-3022. PMID 8968195. S2CID 29581630.
- ^ Morange, Michel (tháng 6 năm 2021). A history of biology. ISBN 978-0-691-18878-2. OCLC 1184123419.
- ^ Fields, Stanley (ngày 28 tháng 8 năm 2001). "The interplay of biology and technology". Proceedings of the National Academy of Sciences (bằng tiếng Anh). Quyển 98 số 18. tr. 10051–10054. doi:10.1073/pnas.191380098. ISSN 0027-8424. PMC 56913. PMID 11517346.
- ^ Griffith F (tháng 1 năm 1928). "The significance of pneumococcal types". Journal of Hygiene. Quyển 27 số 2. tr. 113–59. doi:10.1017/S0022172400031879. PMC 2167760. PMID 20474956.
- ^ Ellis, T. H. Noel; Hofer, Julie M. I.; Timmerman-Vaughan, Gail M.; Coyne, Clarice J.; Hellens, Roger P. (ngày 1 tháng 11 năm 2011). "Mendel, 150 years on". Trends in Plant Science (bằng tiếng Anh). Quyển 16 số 11. tr. 590–596. doi:10.1016/j.tplants.2011.06.006. ISSN 1360-1385. PMID 21775188.
- ^ "12.3C: Mendel's Law of Segregation". Biology LibreTexts (bằng tiếng Anh). ngày 12 tháng 7 năm 2018. Truy cập ngày 18 tháng 11 năm 2021.
- ^ "Mendelian Inheritance". Genome.gov (bằng tiếng Anh). Truy cập ngày 18 tháng 11 năm 2021.
- ^ a b "Discovery of DNA Double Helix: Watson and Crick | Learn Science at Scitable". www.nature.com (bằng tiếng Anh). Truy cập ngày 25 tháng 11 năm 2021.
- ^ George., Wolf (2003). Friedrich Miescher: the man who discovered DNA. OCLC 907773747.
- ^ Levene, P.A. (1919). "Structure of Yeast Nucleic Acid". Journal of Biological Chemistry. Quyển 43 số 2. tr. 379–382. doi:10.1016/s0021-9258(18)86289-5. ISSN 0021-9258.
- ^ Chargaff, Erwin (1950). "Chemical specificity of nucleic acids and mechanism of their enzymatic degradation". Experientia. Quyển 6 số 6. tr. 201–209. doi:10.1007/bf02173653. ISSN 0014-4754. PMID 15421335. S2CID 2522535.
- ^ a b Watson, J. D.; Crick, F. H. C. (tháng 4 năm 1953). "Molecular Structure of Nucleic Acids: A Structure for Deoxyribose Nucleic Acid". Nature (bằng tiếng Anh). Quyển 171 số 4356. tr. 737–738. Bibcode:1953Natur.171..737W. doi:10.1038/171737a0. ISSN 1476-4687. PMID 13054692. S2CID 4253007.
- ^ Crick, F. H. C.; Barnett, Leslie; Brenner, S.; Watts-Tobin, R. J. (1961). "General Nature of the Genetic Code for Proteins". Nature. Quyển 192 số 4809. Springer Science and Business Media LLC. tr. 1227–1232. Bibcode:1961Natur.192.1227C. doi:10.1038/1921227a0. ISSN 0028-0836. PMID 13882203. S2CID 4276146.
- ^ Epstein, R. H.; Bolle, A.; Steinberg, C. M.; Kellenberger, E.; Boy de la Tour, E.; và đồng nghiệp (ngày 1 tháng 1 năm 1963). "Physiological Studies of Conditional Lethal Mutants of Bacteriophage T4D". Cold Spring Harbor Symposia on Quantitative Biology. Quyển 28. Cold Spring Harbor Laboratory. tr. 375–394. doi:10.1101/sqb.1963.028.01.053. ISSN 0091-7451.
- ^ Mojiri, Soheil; Isbaner, Sebastian; Mühle, Steffen; Jang, Hongje; Bae, Albert Johann; Gregor, Ingo; Gholami, Azam; Gholami, Azam; Enderlein, Jörg (ngày 1 tháng 6 năm 2021). "Rapid multi-plane phase-contrast microscopy reveals torsional dynamics in flagellar motion". Biomedical Optics Express (bằng tiếng Anh). Quyển 12 số 6. tr. 3169–3180. doi:10.1364/BOE.419099. ISSN 2156-7085. PMC 8221972. PMID 34221652.
- ^ van Warmerdam, T. "Molecular Biology Laboratory Resource". Yourbiohelper.com.
- ^ van Warmerdam, T. "Molecular biology laboratory resource". Yourbiohelper.com.
- ^ Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). Molecular cell biology (ấn bản thứ 4). New York: Scientific American Books. ISBN 978-0-7167-3136-8.
- ^ Berg, Jeremy (2002). Biochemistry. Tymoczko, John L.; Stryer, Lubert (ấn bản thứ 5). New York: W.H. Freeman. ISBN 0-7167-3051-0. OCLC 48055706.
- ^ Reference, Genetics Home. "Help Me Understand Genetics". Genetics Home Reference. Truy cập ngày 31 tháng 12 năm 2016.
- ^ Tian J, biên tập (2013). Molecular Imaging: Fundamentals and Applications. Springer-Verlag Berlin & Heidelberg GmbH & Co. K. tr. 542. ISBN 9783642343032. Truy cập ngày 8 tháng 7 năm 2019.
- ^ "Foundations of Molecular Cloning - Past, Present and Future | NEB". www.neb.com. Truy cập ngày 25 tháng 11 năm 2021.
- ^ "Foundations of Molecular Cloning - Past, Present and Future | NEB". www.neb.com. Truy cập ngày 4 tháng 11 năm 2021.
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. Isolating, Cloning, and Sequencing DNA (bằng tiếng Anh). Truy cập ngày 31 tháng 12 năm 2016.
- ^ Lessard, Juliane C. (ngày 1 tháng 1 năm 2013). "Molecular cloning". Laboratory Methods in Enzymology: DNA. Quyển 529. tr. 85–98. doi:10.1016/B978-0-12-418687-3.00007-0. ISBN 978-0-12-418687-3. ISSN 1557-7988. PMID 24011038.
{{Chú thích sách}}: Đã bỏ qua|journal=(trợ giúp) - ^ Kokate C, Jalalpure SS, Hurakadle PJ (2016). Textbook of Pharmaceutical Biotechnology. Expression Cloning. Elsevier. tr. 125. ISBN 9788131239872. Truy cập ngày 8 tháng 7 năm 2019.
- ^ Lenstra, J. A. (tháng 7 năm 1995). "The applications of the polymerase chain reaction in the life sciences". Cellular and Molecular Biology (Noisy-Le-Grand, France). Quyển 41 số 5. tr. 603–614. ISSN 0145-5680. PMID 7580841.
- ^ "Polymerase Chain Reaction (PCR)". National Center for Biotechnology Information. U.S. National Library of Medicine. Truy cập ngày 31 tháng 12 năm 2016.
- ^ "Polymerase Chain Reaction (PCR) Fact Sheet". National Human Genome Research Institute (NHGRI). Truy cập ngày 31 tháng 12 năm 2016.
- ^ a b Lee, Pei Yun; Costumbrado, John; Hsu, Chih-Yuan; Kim, Yong Hoon (ngày 20 tháng 4 năm 2012). "Agarose Gel Electrophoresis for the Separation of DNA Fragments". Journal of Visualized Experiments. Số 62. tr. 3923. doi:10.3791/3923. ISSN 1940-087X. PMC 4846332. PMID 22546956.
- ^ Lee PY, Costumbrado J, Hsu CY, Kim YH (tháng 4 năm 2012). "Agarose gel electrophoresis for the separation of DNA fragments". Journal of Visualized Experiments. Số 62. doi:10.3791/3923. PMC 4846332. PMID 22546956.
- ^ Bradford, Marion M. (ngày 7 tháng 5 năm 1976). "A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding". Analytical Biochemistry (bằng tiếng Anh). Quyển 72 số 1. tr. 248–254. doi:10.1016/0003-2697(76)90527-3. ISSN 0003-2697. PMID 942051. S2CID 4359292.
- Sinh học phân tử của tế bào. Lê Đức Trình. Nhà xuất bản Khoa học và Kỹ thuật, 2001, 264tr
- Sinh học phân tử của ung thư vòm họng GS. VS. TSKH. Đái Duy Ban công ty Daibio. Nhà xuất bản Khoa học và kỹ thuật, 2003 - 115 trang
Liên kết ngoài
[sửa | sửa mã nguồn] GIẢM
13%
GIẢM
13%
 GIẢM
-50%
GIẢM
-50%
 GIẢM
3%
GIẢM
3%
 GIẢM
17%
GIẢM
17%





