Cisplatin
| Cisplatin | ||
|---|---|---|
| Naziv lijeka | Cisplatin | |
| Druga imena | Cisplatinum, platamin, neoplatin, cismaplat, cis-diaminedihloroplatinum(II) | |
| Grupa | Porodica antineoplazijskih lijekova na bazi platine. | |
| Trgovačka imena | Platinol i srodna | |
| ||
| ATC kodovi | L01, XA01 | |
| CAS registarski broj | 15663-27-1 | |
| ||
| Stručne informacije | ||
| ||
   Ime po IUPAC (SP-4-2)-diaminedihloridoplatinum(II) | ||
| Sumarna formula | N2H6Cl2Pt | |
| Molarna masa | 298,035 | |
| ||
| Biološka raspoloživost | 100% (IV) | |
| Metabolizam | Vezanje proteina >95% | |
| Poluvrijeme eliminacije | 30–100 sati intravenozno | |
| Izlučivanje | Mokraćom | |
Cisplatin je hemoterapijski lijek koji se koristi za liječenje brojnih kancera.[1] To uključuje rak testisa, rak jajnika, rak grlića maternice, rak dojke, rak mjehura, rak glave i vrata, rak jednjaka, rak pluća, mezoteliom, tumore mozga i neuroblastom.[2] Daje se injektiranje u venu.[2]
Nuspojave i mehanizmi
[uredi | uredi izvor]Uobičajene nuspojave uključuju supresiju koštane srži, problema sa sluhom, oštećenje bubrega i povraćanje.[2][3] Ostale ozbiljne nuspojave uključuju utrnulost, poteškoće pri hodanju, alergijske reakcije, probleme s elektrolitima i bolest srca. Upotreba tokom trudnoća može oštrtiti fetus during pregnancy can cause harm to the developing fetus. Cisplatin je u porodici lijekova antineoplazijskih lijekova na bazi platine.[2] Djelimično djeluje tako što se vezuje za DNK i inhibira njenu replikaciju.[2]
Medicinska upotreba
[uredi | uredi izvor]Cisplatin se primjenjuje intravenozno kao kratkotrajna infuzija u normalnoj fiziološkoj otopini za liječenje solidnih i krvnih malignosti. Koristi se za liječenje različitih tipova karcinoma, uključujući sarkom, neke karcinome (npr. karcinom pluća malih čelija, karcinom skvamoznih ćelija glave i vrata, te rak jajnika), limfomi, rak mokraćne bešike, rak grlića maternice,[4] i tumori zametnih ćelija.
Cisplatin je posebno efikasan protiv raka testisa; njegovo usvajanje povećalo je stopu izlječenja sa 10% na 85%.[5]
Iako su neophodna dalja ispitivanja, cisplatin je proučavan sa Augerpvom terapijom, kako bi se povećali terapeutski efekti cisplatina, bez povećanja toksičnosti za normalna tkiva.[6]
Neželjeni efekti
[uredi | uredi izvor]Cisplatin ima niz nuspojava koje mogu ograničiti njegovu upotrebu:
- Nefrotoksičnost (oštećenje bubrega) je primarna nuspojava koja ograničava dozu i predstavlja veliku kliničku zabrinutost. Cisplatin se selektivno akumulira u proksimalnu tubulu preko bazolateralnog do apikalnog transporta, gdje remeti mitohondrijsku energiju i endoplazmatskoretikulumske homeostaze Ca2+ i stimulira reaktivne vrste kisika i proupalni citokini.[7] Klinički i pretklinički se istražuje više strategija ublažavanja, uključujući režime hidratacije, amifostin, inhibitore transportera, antioksidanse, antiupalne lijekove i epoksieikozatrienske kiseline i njihove analoge.[7][8]
- Neurotoksičnost (oštećenje živaca) može se predvidjeti izvođenjem studija nervne provodljivosti prije i nakon tretmana. Uobičajene neurološke nuspojave cisplatina uključuju vizuelnu percepciju i poremećaj sluha, koji se može pojaviti ubrzo nakon početka liječenja.[9] Iako pokretanje apoptoze ometanjem replikacije DNK ostaje primarni mehanizam cisplatina, nije utvrđeno da to doprinosi neurološkim nuspojavama. Nedavne studije su pokazale da cisplatin nekompetitivno inhibira arhetipski, na membranu vezan mehanosenzitivni transporter iona natrij-vodika poznat kao NHE-1.[9] Primarno se nalazi na ćelijama perifernog nervnog sistema, koje su agregirane u velikom broju u blizini centara za primanje očnih i slušnih stimulansa. Ova nekonkurentna interakcija povezana je s hidroelektrolitskim neravnotežama i promjenama citoskeleta, a oba su potvrđena i in vitro i in vivo. Međutim, utvrđeno je da je inhibicija NHE-1 i dozno zavisna (poluinhibicija = 30 μg/mL) i reverzibilna.[9]
- Mučnina i povraćanje: cisplatin je jedan od najemetogenih hemoterapijskih agenasa, ali se ovaj simptom liječi profilaksnim antiemeticima (ondansetron, granisetron, itd.) u kombinaciji sa kortikosteroidima. Aprepitant u kombinaciji sa ondansetronom i deksametazonom pokazao se boljim za visoko emetogenu hemoterapiju nego samo ondansetron i deksametazon.
- Ototoksičnost (gubitak sluha): Za sada ne postoji efikasan tretman za prevenciju ove nuspojave, koja može biti ozbiljna, iako je u toku istraživanje injekcija acetilcisteina kao preventivne mjere.[10] Audiometrijska analiza može biti neophodna za procjenu ozbiljnosti ototoksičnosti. Drugi lijekovi (kao što je aminoglikozidna klasa antibiotika) također mogu uzrokovati ototoksičnost, a primjena ove klase antibiotika kod pacijenata koji primaju cisplatin se općenito izbjegava. Ototoksičnost i aminoglikozida i cisplatina može biti povezana sa njihovom sposobnošću da se vežu za melanin u stria vascularis unutrašnjeg uha ili stvaranje reaktivnih vrsta kiseonika.
- Poremećaj elektrolita: Cisplatin može uzrokovati hipomagneziemiju, hipokalemiju i hipokalcemiju. Čini se da se hipokalcemija javlja kod onih sa niskim nivoom magnezija u serumu zbog cisplatina, tako da nije prvenstveno posljedica cisplatina.
- Hemolitska anemija može se razviti nakon nekoliko ciklusa cisplatina. Pretpostavlja se da je antitijelo koje reaguje sa membranom crvenih krvnih ćelija odgovorno za hemolizu.[11]
Farmakologija
[uredi | uredi izvor]Cisplatin ometa replikaciju DNK, što ubija ćelije koje se najbrže razmnožavaju, a koje su u teoriji kancerogene. Nakon primjene, jedan hloridni ion se polako zamjenjuje vodom kako bi se dobio vodeni kompleks cis-[PtCl(NH3)2(H< sub>2O)]+, u procesu koji se naziva akvacija. Disocijacija hlorida je favorizovana unutar ćelije jer je unutarćelijska koncentracija hlorida samo 3-20% od približno 100 mM koncentracije hlorida u vanćelijskoj tečnosti.[12][13]
Molekula vode u cis-[PtCl(NH3)2(H2O)]+ se lahko se zamenjuje "N"-heterocikličkom bazom na DNK. Prvenstveno se vezuje guanin. Nakon formiranja [PtCl(guanin-DNK)(NH3)2]+, može doći do umrežavanja putem zamjene drugog hlorida, obično drugim guaninom. Cisplatin umrežava DNK na nekoliko različitih načina, ometajući ćelijsku diobu mitozom. Oštećena DNK izaziva popravak DNK mehanizme, koji zauzvrat aktiviraju apoptozu kada se popravak pokaže nemogućim. 2008. istraživači su uspjeli pokazati da apoptoza izazvana cisplatinom na ljudskim ćelijama raka debelog crijeva ovisi o mitohondrijskoj serin-proteazi Omi/Htra2.[14] Pošto je ovo pokazano samo za ćelije karcinoma debelog creva, ostaje otvoreno pitanje da li protein Omi/Htra2 učestvuje u apoptozi izazvanoj cisplatinom u karcinomima iz drugih tkiva.[14]
Najznačajnije među promjenama u DNK su 1,2-unutarlančane poprečne veze umrežavanja sa purinskim bazama. To uključuje 1,2-ujnutarlančane d(GpG) adukte, koji čine skoro 90% adukata i manje uobičajene 1,2-unutarlančane d(ApG) adukte. Javljaju se i 1,3-unutarlančani d(GpXpG) adukti, ali se lako izrezuju nukleotidnom ekscizijskom popravkom (NER). Ostali adukti uključuju međulančane umrežene veze i nefunkcionalne adukte za koje se pretpostavlja da doprinose aktivnosti cisplatina. Interakcija sa ćelijskim proteinima, posebno proteinima domena HMG, takođe je napredovala kao mehanizam ometanja mitoza, iako to vjerovatno nije njegov primarni način djelovanja.[15]
Otpornost na cisplatin
[uredi | uredi izvor]Kombinirana hemoterapija cisplatinom je kamen temeljac liječenja mnogih karcinoma. Početni odgovor na platinu je visok, ali većina pacijenata sa karcinomom će se na kraju vratiti sa bolešću rezistentnom na cisplatin. Predloženi su mnogi mehanizmi rezistencije na cisplatin, uključujući promjene u ćelijskom unosu i efluksu lijeka, povećanu detoksikaciju lijeka, inhibiciju apoptoze i povećan popravak DNK.[16] Oksaliplatin je aktivan u laboratorijskim ćelijama raka koje su vrlo otporne na cisplatin; međutim, malo je dokaza o njegovoj aktivnosti u kliničkom liječenju pacijenata sa karcinomom rezistentnim na cisplatin.[16] The drug paclitaxel may be useful in the treatment of cisplatin-resistant cancer; the mechanism for this activity is unknown.[17]
Transplatin
[uredi | uredi izvor]Transplatin, trans-stereoizomer cisplatina, ima formulu trans -[PtCl2(NH3)2] i ne pokazuje uporedivo koristan farmakološki efekat. Predložena su dva mehanizma koji objašnjavaju smanjeni antikancerogeni učinak transplatina. Prvo, smatra se da "trans" raspored hloro liganda daje transplatinu veću hemijsku reaktivnost, uzrokujući da se transplatin deaktivira prije nego što stigne do DNK, gdje cisplatin ispoljava svoje farmakološko djelovanje. Drugo, stereo-konformacija transplatina je takva da nije u stanju da formira karakteristične 1,2-unutarlančane d(GpG) adukte formirane od cisplatina u izobilju.[18]
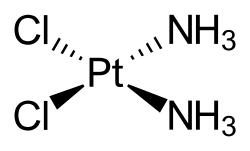
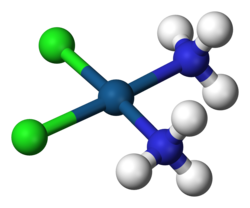
Molekulaka struktura
[uredi | uredi izvor]Cisplatin je kvadratni planarni koordinacijski kompleks cis-[Pt(NH3)2Cl2].[19]:286–8[20]:689 Prefiks cis označava cis izomer u kojem su dva slična liganda na susjednim pozicijama.[19][20]:550 Sistematski hemijski naziv ove molekule je cis–diamindihloroplatina,[19]:286 gdje amin sa dva m označava amonijak (NH 3) ligand, za razliku od organskog amina sa jednim m.[19]:284
Sinteza
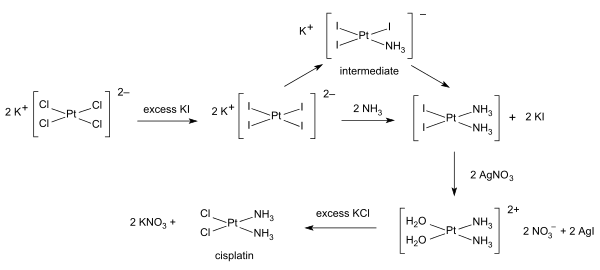
[uredi | uredi izvor]Sinteze cisplatina počinju od kalij-tetrahloroplatinata. Dostupno je nekoliko procedura. Jedna od prepreka je lahko formiranje Magnusove zelene soli (MGS), koja ima istu empirijsku formulu kao cisplatin. Tradicijski način izbjegavanja MGS-a uključuje konverziju K2PtCl4 u K2PtI4, kao što je prvobitno opisao Dhara.[21][22] Reakcija sa amonijakom formira PtI2(NH3)2 koji je izolovan kao žuti spoj. Kada se u vodu doda srebro-nitrat i nerastvorljivi srebro-jodid taloži se i [Pt(OH2)2(NH3)2](NO3)2 ostaje u rastvoru. Dodavanje kalij-hlorida će formirati konačni proizvod koji precipitira. U trijodo intermedijeru, dodavanjem drugog amonijačnog liganda upravlja trans efekat.
Razvijena je sinteza u jednoj posudi cisplatina iz K2PtCl4. Oslanja se na sporo oslobađanje amonijaka iz amonij-acetata.[23]
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ "Cisplatin Monograph for Professionals". Drugs.com (jezik: engleski). Pristupljeno 18. 3. 2022.
- ^ a b c d e "Cisplatin". The American Society of Health-System Pharmacists. Archived from the original on 21 December 2016. Retrieved 8 December 2016.
- ^ Oun R, Moussa YE, Wheate NJ (maj 2018). "The side effects of platinum-based chemotherapy drugs: a review for chemists". Dalton Transactions. 47 (19): 6645–6653. doi:10.1039/c8dt00838h. PMID 29632935.
- ^ "Cisplatin". National Cancer Institute. 2. 3. 2007. Arhivirano s originala, 8. 10. 2014. Pristupljeno 13. 11. 2014.
- ^ Einhorn LH (novembar 1990). "Treatment of testicular cancer: a new and improved model". Journal of Clinical Oncology. 8 (11): 1777–81. doi:10.1200/JCO.1990.8.11.1777. PMID 1700077.
- ^ Ku, Anthony; Facca, Valerie J.; Cai, Zhongli; Reilly, Raymond M. (11. 10. 2019). "Auger electrons for cancer therapy – a review". EJNMMI Radiopharmacy and Chemistry. 4 (1): 27. doi:10.1186/s41181-019-0075-2. ISSN 2365-421X. PMC 6800417. PMID 31659527.
- ^ a b Miller RP, Tadagavadi RK, Ramesh G, Reeves WB (oktobar 2010). "Mechanisms of Cisplatin Nephrotoxicity". Toxins. 2 (11): 2490–2518. doi:10.3390/toxins2112490.
- ^ Singh N, Vik A, Lybrand DB, Morisseau C, Hammock BD (novembar 2021). "New Alkoxy- Analogues of Epoxyeicosatrienoic Acids Attenuate Cisplatin Nephrotoxicity In Vitro via Reduction of Mitochondrial Dysfunction, Oxidative Stress, Mitogen-Activated Protein Kinase Signaling, and Caspase Activation". Chemical Research in Toxicology. 34 (12): 2579–2591. doi:10.1021/acs.chemrestox.1c00347.
- ^ a b c Milosavljevic N, Duranton C, Djerbi N, Puech PH, Gounon P, Lagadic-Gossmann D, et al. (oktobar 2010). "Nongenomic effects of cisplatin: acute inhibition of mechanosensitive transporters and channels without actin remodeling". Cancer Research. 70 (19): 7514–22. doi:10.1158/0008-5472.CAN-10-1253. PMID 20841472.
- ^ Sarafraz Z, Ahmadi A, Daneshi A (juni 2018). "Transtympanic Injections of N-acetylcysteine and Dexamethasone for Prevention of Cisplatin-Induced Ototoxicity: Double Blind Randomized Clinical Trial". The International Tinnitus Journal. 22 (1): 40–45. doi:10.5935/0946-5448.20180007. PMID 29993216.
- ^ Levi JA, Aroney RS, Dalley DN (juni 1981). "Haemolytic anaemia after cisplatin treatment". British Medical Journal. 282 (6281): 2003–4. doi:10.1136/bmj.282.6281.2003. PMC 1505958. PMID 6788166.
- ^ Wang D, Lippard SJ (april 2005). "Cellular processing of platinum anticancer drugs". Nature Reviews. Drug Discovery. 4 (4): 307–320. doi:10.1038/nrd1691. PMID 15789122. S2CID 31357727.
- ^ Johnstone TC, Suntharalingam K, Lippard SJ (mart 2016). "The Next Generation of Platinum Drugs: Targeted Pt(II) Agents, Nanoparticle Delivery, and Pt(IV) Prodrugs". Chemical Reviews. 116 (5): 3436–3486. doi:10.1021/acs.chemrev.5b00597. PMC 4792284. PMID 26865551.
- ^ a b Pruefer FG, Lizarraga F, Maldonado V, Melendez-Zajgla J (juni 2008). "Participation of Omi Htra2 serine-protease activity in the apoptosis induced by cisplatin on SW480 colon cancer cells". Journal of Chemotherapy. 20 (3): 348–354. doi:10.1179/joc.2008.20.3.348. PMID 18606591. S2CID 11052459.
- ^ Hu J, Lieb JD, Sancar A, Adar S (oktobar 2016). "Cisplatin DNA damage and repair maps of the human genome at single-nucleotide resolution". PNAS. 113 (41): 11507–11512. doi:10.1073/pnas.1614430113. PMC 5068337. PMID 27688757. S2CID 11052459.
- ^ a b Stordal B, Davey M (novembar 2007). "Understanding cisplatin resistance using cellular models" (PDF). IUBMB Life. 59 (11): 696–699. doi:10.1080/15216540701636287. PMID 17885832. S2CID 30879019.
- ^ Stordal B, Pavlakis N, Davey R (decembar 2007). "A systematic review of platinum and taxane resistance from bench to clinic: an inverse relationship" (PDF). Cancer Treatment Reviews. 33 (8): 688–703. doi:10.1016/j.ctrv.2007.07.013. hdl:2123/4068. PMID 17881133.
- ^ Coluccia M, Natile G (januar 2007). "Trans-platinum complexes in cancer therapy". Anti-Cancer Agents in Medicinal Chemistry. 7 (1): 111–123. doi:10.2174/187152007779314080. PMID 17266508.
- ^ a b c d Miessler GL, Tarr DA (1999). Inorganic Chemistry (2nd izd.). Prentice Hall. ISBN 978-0-13-841891-5.
- ^ a b Housecroft CE, Sharpe AG (2005). Inorganic Chemistry (2nd izd.). Pearson Prentice Hall. ISBN 978-0-130-39913-7.
- ^ Dhara SC (1970). "Cisplatin". Indian J. Chem. 8: 123–134.
- ^ Alderden RA, Hall MD, Hambley TW (2006). "The Discovery and Development of Cisplatin". J. Chem. Educ. 83 (5): 728. Bibcode:2006JChEd..83..728A. doi:10.1021/ed083p728. S2CID 29546931.
- ^ Kukushikin VY, Oskarsson Å, Elding LI, Farrell N (2007). Facile Synthesis of Isomerically Pure cis -Dichlorodiammineplatinum(II), Cisplatin. Inorganic Syntheses. 32. str. 141–144. doi:10.1002/9780470132630.ch23. ISBN 9780470132630.
Dopunska literatura
[uredi | uredi izvor]- Riddell IA, Lippard SJ (2018). "Cisplatin and Oxaliplatin: Our Current Understanding of Their Actions". u Sigel A, Sigel H, Freisinger E, Sigel RK (ured.). Metallo-Drugs: Development and Action of Anticancer Agents. Metal Ions in Life Sciences. 18. Berlin: de Gruyter GmbH. str. 1–42. doi:10.1515/9783110470734-007. ISBN 978-3-11-046984-4. PMID 29394020.
Vanjski linkovi
[uredi | uredi izvor]- "Cisplatin". Drug Information Portal. U.S. National Library of Medicine.
- IARC Monograph: "Cisplatin" Arhivirano 24. 6. 2021. na Wayback Machine