Globin
| Porodica globina (porodica M) | |
|---|---|
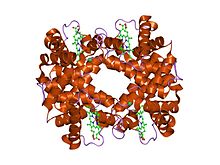 Struktura dezoksihemoglobina Rothschild 37 beta Trp → Arg: mutacija koja stvara međupodjedinično mjesto vezanja hlorida.[1] | |
| Identifikatori | |
| Simbol | Globulini |
| Bakterioliki globin (porodica T) | |
|---|---|
 Kristalna struktura skraćanog hemoglobina n (hbn) iz Mycobacterium tuberculosis sa xe atomIMA | |
| Identifikatori | |
| Simbol | Bac-globin |
| Protoglobin (porodica S) | |
|---|---|
 | |
| Identifikatori | |
| Simbol | Protoglobin |
Globini (lat. globus, prema grč. σφαίρα – sfera = kugla, lopta) su natporodica globulsstih proteina sa hemom uključenih u vezivanje i/ili transport kisika. Svi ovi proteini uključuju globinski nabor, seriju od po osam α heliksnih segmenata. Dva istaknuta člana uključuju mioglobin i hemoglobin. Oba ova proteina reverzibilno vezuju kisik preko hemske prostetske grupe. Široko su rasprostranjeni u mnogim organizmima.[2]
Struktura
[uredi | uredi izvor]Članovi natporodice globina imaju zajednički trodimenzijski nabor.[3] Ovaj 'globinski nabor' sastoji se obično od osam α heliksa, iako neki proteini imaju dodatne spiralne ekstenzije na svojim krajevima.[4] Budući da globinski nabor sadrži samo heliksa, klasifikovan je kao sve-α proteinski nabor.
Globinski nabor nalazi se u njegovom istoimenoj globinu porodice kao i u fikocijaninima. Globinski nabor je tako bio prvi otkriveni proteinski nabor (mioglobin je bio prvi protein čija je struktura riješena).
Heliksno pakovanje
[uredi | uredi izvor]Osam spirala jezgra globinskog nabora dijele značajnu nelokalnu strukturu, za razliku od drugih strukturnih motiva u kojima su aminokiseline bliske jedna drugoj u primarnoj sekvenci također blizu u prostoru. Heliksi se zbijaju zajedno pod prosječnim uglom od oko 50 stepeni, znatno strmiji od ostalih spiralnih pakovanja kao što je heliksni paket. Tačan ugao pakovanja heliksa zavisi od sekvence proteina, jer je pakovanje posredovano sternim i hidrofobnim interakcijama aminokiselinskih bočnih lanca u blizini interfejsa spirale.
Evolucija
[uredi | uredi izvor]Globini su evoluirali od zajedničkog predačkog proteina i mogu se podijeliti u tri grupe: globini s jednim domenom i dva tipa himernih globina, flavohemoglobina i globin-spojenim senzorima. Bakterije imaju sva tri tipa globina, dok Archaea nemaju flavohemoglobine, a eukarioti nemaju senzore koji su povezani sa globinom.[5][6] Nekoliko funkcionalno različitih hemoglobina može koegzistirati u istoj vrsti.
Poznato je da se osam globina javlja kod kičmenjaka: androglobin, citoglobin, globin E, globin X, globin Y, hemoglobin, mioglobin i neuroglobin.
Konzevirane sekvence
[uredi | uredi izvor]Iako je nabor globinske natporodice evolucijski visoko prirodno konzerviran, sekvence koje formiraju nabor mogu imati čak 16% identiteta sekvence. Iako specifičnost sekvence nabora nije stroga, hidrofobno jezgro proteina mora se održavati i moraju se izbjegavati hidrofobna obojenja na općenito hidrofilnoj površini izloženoj rastvaraču, kako bi struktura ostala stabilna i rastvorljiva. Najpoznatija mutacija u globinskom naboru je promjena iz glutamata u valin u jednom lancu molekula hemoglobina. Ova mutacija stvara "hidrofobnu pjegu" na površini proteina koja podstiče međumolekulsku agregaciju, događaj koji uzrokuje anemiju srpastih ćelija.
Potporodice
[uredi | uredi izvor]- Leghaemoglobin InterPro: IPR001032
- Mioglobin InterPro: IPR002335
- Erithrocruorin InterPro: IPR002336
- Hemoglobin beta InterPro: IPR002337
- Hemoglobin alfa InterPro: IPR002338
- Mioglobin trematodnog tipa InterPro: IPR011406
- Nematodni globin InterPro: IPR012085
- Globin koloustnog tipa InterPro: IPR013314
- Globin anelidnog tipa InterPro: IPR013316
- Vanćelijski hemoglobin InterPro: IPR014610
Primjeri
[uredi | uredi izvor]Ljudski geni koji kodiraju globinske proteine uključuju:
Globini uključuju:
- Hemoglobin (Hb)
- Mioglobin (Mb)
- Neuroglobin: hemprotein sličan mioglobinu eksprimiran u mozgu i mrežnjačama kičmenjaka, gdje je uključen u neuroprotekciju od oštećenja uzrokovanih hipoksijom ili ishemijom.[7] Neuroglobin pripada grani porodice globina koja je rano divergirala u evoluciji globina.
- Citoglobin: senzor kisika eksprimiran u više tkiva. Vezan za neuroglobin.[8]
- Eritrokruorin: visoko kooperativan vanćelijski respiratorni proteini u Annelida i Arthropoda koji su sastavljeni od po čak 180 podjedinica u heksagoske dvoslojeve.[9]
- Leghemoglobin (legHb ili simbiotski Hb): javlja se u korijenovom čvoru mahunastih biljaka, gdje olakšava difuziju kisika u simbiozu bakterioda, kako bi se podstaknula fiksacija dušika.
- Nesimbiotski hemoglobin (NsHb): javlja se u biljkama koje nisu mahunarke i može biti pretjerano ieksprimiran u biljkama pod stresom.
- Flavohemoglobin (FHb): himerni, sa N-terminalnim domenom globina i C-terminalnim feredoksinskim reduktazama sličnim NAD/FAD domenom. FHb pruža zaštitu od dušik-oksida preko svog C-terminalnog domena, koji prenosi elektrone do hema u globinu.[10]
- Globin E: globin odgovoran za skladištenje i isporuku kisika mrežnjačama kod ptica [11]
- Globin-spregnuti senzori: himerni, sa N-terminalnim domenom sličnim mioglobinu i C-terminalnim domenom koji liči na domen citoplazmatske signalizacije bakterijskih hemoreceptora. Oni molekulski vežu kisik i deluju tako da iniciraju aerotaksijski odgovor ili regulišu ekspresije gena.[12][13]
- Protoglobin: jednostruku domen globina u archaea povezana sa N-terminalnim domenom senzora koji su povezani sa globinom.[14]
- Skraćeni 2/2 globini: nedostaje prvi heliks, što im daje 2-preko-2 umjesto kanonskog 3-preko-3 alfa-heliksna sendviča nabora. Na osnovu strukturnih karakteristika, ,ože se podijeliti u tri glavne grupe (I, II i II).
- HbN (ili GlbN): skraćeni protein sličan hemoglobinu koji kooperativno veže kisik sa veoma visokim afinitetom i sporom disocijacijskom stopom, što ga može isključiti iz transporta kisika. Čini se da je uključen u bakterijsku detoksikaciju dušik-oksida i u nitrozni stres.[15]
- Cijanoglobin (ili GlbN): skraćeni hemoprotein koji se nalazi u cijanobakterijama koji ima visok afinitet za kisik i služi kao deio terminalnih oksidaza, a ne kao respiratorni pigment.[16]
HbO (ili GlbO): skraćeni protein sličan hemoglobinu sa nižim afinitetom za kisik od HbN. HbO se povezuje sa membranom bakterijskih ćelija, gde značajno povećava unos kisika u membrane kojima nedostaje ovaj protein. Čini se da HbO reaguje sa terminalnom oksidazom i može sudjelovati u procesu prijenosa kisika/elektrona koji olakšavaju prijenos kisika tokom aerobnog metabolizma.[17]
- Glb3: jedarno kodirani skraćeni hemoglobin iz biljaka koji se čini bližim HbO nego HbN. Glb3 iz Arabidopsis thaliana (Thalova grbaštica) pokazuje neobično vezivanje kiseika i ugljik-dioksida nezavisno od koncentracije.[18]
Savijanje globina
[uredi | uredi izvor]Globinski nabor (cd01067) također uključuje neke nehemske proteine. Neki od njih su fikobiliproteini, N-terminalni domen dvokomponentnog regulatornog sistema histidin-kinaza, RsbR i RsbN.
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Kavanaugh JS, Rogers PH, Case DA, Arnone A (april 1992). "High-resolution X-ray study of deoxyhemoglobin Rothschild 37 beta Trp----Arg: a mutation that creates an intersubunit chloride-binding site". Biochemistry. 31 (16): 4111–21. doi:10.1021/bi00131a030. PMID 1567857.
- ^ Vinogradov SN, Hoogewijs D, Bailly X, Mizuguchi K, Dewilde S, Moens L, Vanfleteren JR (august 2007). "A model of globin evolution". Gene. 398 (1–2): 132–42. doi:10.1016/j.gene.2007.02.041. PMID 17540514.
- ^ Branden, Carl; Tooze, John (1999). Introduction to protein structure (2nd izd.). New York: Garland Pub. ISBN 978-0815323051.
- ^ Bolognesi, M; Onesti, S; Gatti, G; Coda, A; Ascenzi, P; Brunori, M (1989). "Aplysia limacina myoglobin. Crystallographic analysis at 1.6 a resolution". Journal of Molecular Biology. 205 (3): 529–44. doi:10.1016/0022-2836(89)90224-6. PMID 2926816.
- ^ Vinogradov SN, Hoogewijs D, Bailly X, Arredondo-Peter R, Gough J, Dewilde S, Moens L, Vanfleteren JR (2006). "A phylogenomic profile of globins". BMC Evol. Biol. 6: 31. doi:10.1186/1471-2148-6-31. PMC 1457004. PMID 16600051.
- ^ Solène Song, Viktor Starunov, Xavier Bailly, Christine Ruta, Pierre Kerner, Annemiek J. M. Cornelissen, Guillaume Balavoine: Globins in the marine annelid Platynereis dumerilii shed new light on hemoglobin evolution in bilaterians. In: BMC Evolutionary Biology Vol. 20, Issue 165. 29 December 2020. doi:10.1186/s12862-020-01714-4. See also:
- A single gene 'invented' haemoglobin several times Arhivirano 15. 4. 2021. na Wayback Machine. On: EurekAlert! 29 December 2020. Source: CNRS
- ^ Pesce A, Dewilde S, Nardini M, Moens L, Ascenzi P, Hankeln T, Burmester T, Bolognesi M (septembar 2003). "Human brain neuroglobin structure reveals a distinct mode of controlling oxygen affinity". Structure. 11 (9): 1087–95. doi:10.1016/S0969-2126(03)00166-7. PMID 12962627.
- ^ Fago A, Hundahl C, Malte H, Weber RE (2004). "Functional properties of neuroglobin and cytoglobin. Insights into the ancestral physiological roles of globins". IUBMB Life. 56 (11–12): 689–96. doi:10.1080/15216540500037299. PMID 15804833. S2CID 21182182.
- ^ Royer WE, Omartian MN, Knapp JE (januar 2007). "Low resolution crystal structure of Arenicola erythrocruorin: influence of coiled coils on the architecture of a megadalton respiratory protein". J. Mol. Biol. 365 (1): 226–36. doi:10.1016/j.jmb.2006.10.016. PMC 1847385. PMID 17084861.
- ^ Mukai M, Mills CE, Poole RK, Yeh SR (mart 2001). "Flavohemoglobin, a globin with a peroxidase-like catalytic site". J. Biol. Chem. 276 (10): 7272–7. doi:10.1074/jbc.M009280200. PMID 11092893.
- ^ Blank M, Kiger L, Thielebein A, Gerlach F, Hankeln T, Marden MC, Burmeister T (2011). "Oxygen supply from the bird's eye perspective: Globin E is a respiratory protein in the chicken retina". J. Biol. Chem. 286 (30): 26507–15. doi:10.1074/jbc.M111.224634. PMC 3143615. PMID 21622558.
- ^ Hou S, Freitas T, Larsen RW, Piatibratov M, Sivozhelezov V, Yamamoto A, Meleshkevitch EA, Zimmer M, Ordal GW, Alam M (juli 2001). "Globin-coupled sensors: a class of heme-containing sensors in Archaea and Bacteria". Proc. Natl. Acad. Sci. U.S.A. 98 (16): 9353–8. Bibcode:2001PNAS...98.9353H. doi:10.1073/pnas.161185598. PMC 55424. PMID 11481493.
- ^ Freitas TA, Saito JA, Hou S, Alam M (januar 2005). "Globin-coupled sensors, protoglobins, and the last universal common ancestor". J. Inorg. Biochem. 99 (1): 23–33. doi:10.1016/j.jinorgbio.2004.10.024. PMID 15598488.
- ^ Freitas TA, Hou S, Dioum EM, Saito JA, Newhouse J, Gonzalez G, Gilles-Gonzalez MA, Alam M (april 2004). "Ancestral hemoglobins in Archaea". Proc. Natl. Acad. Sci. U.S.A. 101 (17): 6675–80. Bibcode:2004PNAS..101.6675F. doi:10.1073/pnas.0308657101. PMC 404104. PMID 15096613.
- ^ Lama A, Pawaria S, Dikshit KL (juli 2006). "Oxygen binding and NO scavenging properties of truncated hemoglobin, HbN, of Mycobacterium smegmatis". FEBS Lett. 580 (17): 4031–41. doi:10.1016/j.febslet.2006.06.037. PMID 16814781.
- ^ Yeh DC, Thorsteinsson MV, Bevan DR, Potts M, La Mar GN (februar 2000). "Solution 1H NMR study of the heme cavity and folding topology of the abbreviated chain 118-residue globin from the cyanobacterium Nostoc commune". Biochemistry. 39 (6): 1389–99. doi:10.1021/bi992081l. PMID 10684619.
- ^ Pathania R, Navani NK, Rajamohan G, Dikshit KL (maj 2002). "Mycobacterium tuberculosis hemoglobin HbO associates with membranes and stimulates cellular respiration of recombinant Escherichia coli". J. Biol. Chem. 277 (18): 15293–302. doi:10.1074/jbc.M111478200. PMID 11796724.
- ^ Watts RA, Hunt PW, Hvitved AN, Hargrove MS, Peacock WJ, Dennis ES (august 2001). "A hemoglobin from plants homologous to truncated hemoglobins of microorganisms". Proc. Natl. Acad. Sci. U.S.A. 98 (18): 10119–24. Bibcode:2001PNAS...9810119W. doi:10.1073/pnas.191349198. PMC 56925. PMID 11526234.