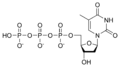
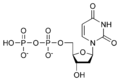
Nucleòtid
| Part d'una sèrie sobre |
| Genètica |
|---|
 |
|
Conceptes fonamentals |
|
Medicina de precisió |
| Codi | Equivalència | Complement |
|---|---|---|
| A | A | T o U |
| C | C | G |
| G | G | C |
| T | T | A |
| U | U | A |
| M | A o C | K |
| R | A o G | Y |
| W | A o T | W |
| S | C o G | S |
| Y | C o T | R |
| K | G o T | M |
| V | A o C o G | B |
| H | A o C o T | D |
| D | A o G o T | H |
| B | C o G o T | V |
| X o N | A o C o G o T | X |
Els nucleòtids són les unitats estructurals bàsiques dels àcids nucleics, és a dir que els àcids nucleics estan formats per l'encadenament de nucleòtids. També es poden trobar lliures a totes les cèl·lules.
Estan compostos per molècules d'àcid fosfòric, un glúcid de cinc carbonis, és a dir, una pentosa, i bases nitrogenades. La pentosa pot ser una ribosa o el seu derivat, la 2-desoxiribosa. La ribosa apareix en els nucleòtids que constitueixen les molècules d'ARN,i la desoxiribosa forma part de les d'ADN.
A més, els nucleòtids participen en la senyalització cel·lular (guanosina monofosfat cíclica i adenosina monofosfat cíclica) i estan incorporats com a uns dels importants cofactors de les reaccions enzimàtiques (coenzim A, dinucleòtid de flavina i adenina, mononucleòtid de flavina, i fosfat de dinucleòtid de nicotinamida i adenina). Els derivats dels nucleòtids, com ara el nucleòsid trifosfat tenen un paper central en el metabolisme, on serveixen com a font d'energia química (trifosfat d'adenosina [ATP] i trifosfat de guanosina [GTP]).[1]

Estructura dels nucleòtids
[modifica]
Un nucleòtid està compost per una base nitrogenada, un sucre de cinc carbonis (ribosa o 2-desoxiribosa) i un grup fosfat.[2] La base nitrogenada i el sucre junts formen un nucleòsid. El grup fosfat forma enllaços amb el carboni 2, 3, o 5 del sucre, sent el carboni 5 el més comú. Els nucleòtids cíclics es formen quan el grup fosfat és enllaçat amb dos dels grups hidroxils dels sucres.[1] Els ribonucleòtids són nucleòtids on el sucre és la ribosa, i els desoxiribonucleòtids contenen el sucre desoxiribosa. Els nucleòtids poden tenir tant la base purina com la base pirimidina.
Els àcids nucleics són macromolècules, considerades polímers, fets de nucleòtids, que són els monòmers d'aquestes estructures. En el DNA, les bases de la purina són l'adenina i la guanina, mentre que les pirimidines són la timina i la citosina. El RNA fa servir l'uracil en comptes de la timina. L'adenina sempre forma parella amb la timina mitjançant dos ponts d'hidrogen, mentre que la guanina forma parella amb la citosina mitjançant tres ponts d'hidrogen, cadascun degut a les seves estructures úniques.
Funcions biològiques
[modifica]La funció principal dels nucleòtids a les cèl·lules és formar part dels àcids nucleics. L’ADN està format per desoxiribonucleòtids i l’ARN per ribonucleòtids. Mentre que la funció pràcticament exclusiva dels desoxiribonucleòtids és formar part de l’ADN, els ribonucleòtids tenen molts altres papers a banda de formar part de l’ARN.
Magatzem i transferència d’energia. Els trifosfats de ribonucleòtids, especialment l’ATP i en menor mesura el GTP, són molt utilitzats en processos cel·lulars que requereixen energia. De fet s’ha denominat l’ATP «la moneda universal d’energia».[3] El trencament de l'enllaç anhidre entre el 3r i el 2n grup fosfat dels trifosfats de ribonucleòtids allibera una quantitat d’energia que és fàcilment aprofitada per enzims de síntesi de macromolècules, per al transport de molècules contra gradient, en la contracció muscular, etc.
Els ribonucleòtids trifosfat poden actuar com a coenzims transferint grups en reaccions catalitzades per enzims. El més habitual és la transferència d’un grup fosfat en reaccions de fosforilació, si bé poden transferir grups difosfat o pirofosfat o fins i tot nucleòtids monofosfat com l’adenilat o AMP.[4]
Un altre possible destí dels ribonucleòtids dins de la cèl·lula és formar part de coenzims. Alguns dels coenzims més habituals com el coenzim A, el dinucleòtid de flavina i adenina (FAD), el dinucleòtid de nicotinamida i adenina (NAD) o el SAM tenen un component d’origen ribonucleotídic a la seva estructura.
Alguns ribonucleòtids tenen funcions molt importants en la transducció de senyals. Hi ha alguns nucleòtids que poden ser transformats en formes cíclades donant lloc a importants segons missatgers com el monofosfat d'adenosina cíclic (AMPc) o el fosfat de guanosina cíclic (GMPc). Algunes proteïnes molt importants en transducció de senyals, com ara les proteïnes G heterotrimèriques (acoblades a receptors 7TM) o les proteïnes G monomèriques (Ras, Rho), es regulen segons estiguin unides al ribonucleòtid GDP (estat inactiu) o GTP (estat actiu).
Mentre que la majoria de funcions biològiques dels ribonucleòtids es duen a terme a l’interior cel·lular, alguns nucleòtids són alliberats de forma regulada o accidental i participen en la comunicació intercel·lular estimulant receptors en altres cèl·lules.[5] Els receptors estimulats per aquests nucleòtids s’anomenen receptors purinèrgics,[6] tot i que en alguns casos poden ser estimulats per nucleòtids de pirimidina. Els principals nucleòtids amb funció de comunicació intercel·lular són l’ATP, l’ADP, l’UTP i nucleòsids con l’adenosina. Els nucleòtids i nucleòsids que estimulen receptors purinèrgics tenen papers importants en la resposta immunitària,[7] en l'agregació plaquetària,[8] en neurotransmissió,[9][10] vasoconstricció[11] i en processos patològics com ara el càncer[12] o en la resposta a infeccions virals.[13]
Metabolisme de nucleòtids
[modifica]Els nucleòtids poden ser sintetitzats per les cèl·lules de novo o reciclats mitjançant vies de recuperació.[14] En la síntesi de novo dels ribonucleòtids, la ribosa i el fosfat són aportats pel fosforribosil pirofosfat (PRPP), un monosacàrid que se sintetitza a partir de la ribosa 5-fosfat, mentre que les bases són sintetitzades en vies metabòliques complexes on aminoàcids, CO2 i grups formats aporten els àtoms per a la síntesi de les bases. La síntesi de novo de purines i la de pirimidines segueixen vies diferents i independents. Donat que la síntesi de novo de ribonucleòtids és un procés costós energèticament, existeixen vies per sintetitzar nucleòtids a partir de nucleòsids o de bases provinents de la degradació de nucleòtids; són les denominades vies de recuperació o de reciclatge.
Síntesi de novo de ribonucleòtids de pirimidina
[modifica]
La síntesi de pirimidines CTP i UTP té lloc al citoplasma i comença amb la formació de carbamoïl-fosfat a partir de glutamina i CO₂. A continuació, l'aspartat experimenta una reacció de condensació amb el carbamoïl-fosfat per donar lloc a la formació d'àcid oròtic. Posteriorment es dona una reacció de ciclació en la qual un enzim anomenat aspartat carbamoïltransferasa forma N-carbamoïl-aspartat el qual és convertit immediatament en àcid dihidrooròtic per l'acció de l'enzim dihidroorotasa. Finalment aquest àcid esdevé orotat gràcies a la dihidroorotat oxidasa. Així, la reacció neta és la següent:
(S)-Dihidroorotat + O₂ = Orotat + H₂O₂.
L'orotat està unit per un enllaç covalent amb una unitat ribosil fosforilada. Aquest enllaç covalent entre la ribosa i la pirimidina és entre el carboni 1 de la molècula de ribosa (la qual conté un pirofosfat) i el nitrogen 1 de l'anell de pirimidina. L'orotat fosforibosiltransferasa (“PPRP transferasa”) catalitza la reacció global produint orotidina monofosfat: La reacció aquesta vegada és la següent:
Orotat + 5-fosfo-α-D-ribosa 1-difosfat (PRPP") = Orotidina 5'-fosfat + Pirofosfat
L'orotidina-5-fosfat és descarboxilat pel corresponent enzim (orotidina-5-fosfat descarboxilasa) per formar uridina monofosfat (UMP). La PRPP transferasa catalitza tant la reacció de ribosilació com la de descarboxilació, formant UMP a partir de l'àcid oròtic amb la presència de PRPP. És a partir d'aquest UMP d'on derivaran altres nucleòtids del grup pirimidina. L'UMP (monofosfat d'uridina) és fosforilat per dues cinases per mitjà de dues reaccions en cadena. Primer es duu a terme la primera fosforilació, aconseguint uridina difosfat i finalment s'arriba al producte uridina trifosfat (UTP) amb la segona fosforilació. Ambdós passos aconsegueixen l'energia a partir de la hidròlisi d'ATP:
2) UDP + ATP = UTP + ADP
La citidina trifosfat (CTP) es forma a continuació per una aminació del UTP gràcies a l'acció catalítica de la UTP sintetasa. L'NH3 prové de la Glutamina. Així tornem a tenir una reacció com la següent, amb la hidròlisi de l'ATP com a font d'energia: UTP + Glutamina + ATP + H₂O = CTP + ADP + Pi La citidina monofosfat (CMP) deriva de la citidina trifosfat (CTP) quan es desfosforila dues vegades.[15] [16]
Síntesi de novo de ribonucleòtids de purina
[modifica]Els àtoms que són utilitzats per construir el nucleòtid de purina provenen de moltes fonts diferents.

 |
Orígens biosintetics dels àtoms amb anell de purina N1 sorgeix del grup amino de l'Asp C₂ i C₈ provenen del format. N₃ i N9 estan sota la contribució del grup amida de Gln. C₄, C₅ i N₇ deriven de la Gly mentre que el C₆ té l'origen en HCO₃- (CO₂). |
El procés de novo síntesi dels nucleòtids de purina és on aquests precursors s'incorporen al procés de l'anell de purina mitjançant 10 passos fins al punt de ramificació intermedi IMP, el nucleòtid de base hipoxantina. L'AMP i el GMP són posteriorment sintetitzats a partir d'aquest intermediari per vies separades en dues etapes. Així, restes de purina són inicialment formades com a part dels ribonucleòtids, en lloc de com a bases lliures. Sis enzims participen en la síntesi de IMP. Tres d'ells són multifuncionals: GART (reaccions 2,3 i 5) PAICS (reaccions 6 i 7) ATIC (reaccions 9 i 10)
El procés comença amb la formació de PRPP. PRPS1 és l'enzim encarregat d'activar el R5P, que es forma principalment per la pentosa fosfat, a PRPP al reaccionar amb l'ATP. La reacció en què un grup pirofosfat és transferit directament de l'ATP fins al C1 del R5P on el producte té la configuració alfa sobre C1, considerat inusual. Aquesta reacció està també compartida per la síntesi de Trp, His i els nucleòtids de pirimidina i està altament regulada, ja que té lloc en un creuament metabòlic important i requereix molta energia.
En la primera reacció única per la biosíntesi del nucleòtid de purina, PPAT catalitza el desplaçament del grup pirofosfat PRPP (PPi) per un nitrogen de l'amida donat per qualsevol glutamina (N), glicina (N + C), aspartat (N), àcid fòlic (C1), o pel CO₂. Aquest procés està realitzat durant la síntesi de purina. La reacció es produeix amb la inversió de la configuració de la ribosaC1, formant β-5-fosforibosilamina (5-PRA) i establint la forma anomèrica del futur nucleòtid. Més endavant una glicina s'incorpora, impulsada durant la hidròlisi d'ATP, i el grup carboxil forma un enllaç amida amb NH₂ introduït prèviament. Una unitat d'un carboni de l'àcid fòlic coenzim N10-formil-THF s'afegeix al grup amino de la glicina substituïda seguit pel trencament de l'anell de imidazol. Seguidament, un segon grup NH₂ es transfereix des de la glutamina fins al primer carboni de la unitat de glicina. Una carboxilació del segon carboni de la unitat de glicina es fa al mateix moment. Aquest nou carboni és modificat per l'addició d'una tercera unitat d'NH₂, aquesta vegada transferit des d'un residu d'aspartat. Finalment, una segona unitat de carboni-formil-THF s'afegeix al grup de nitrogen i l'anell es tanca covalentment per formar el precursor comú purina inosina monofosfat (IMP).
El monofosfat d'inosina es converteix en adenosina monofosfat en dos passos. En primer lloc, la hidròlisi de GTP permet l'addició d'aspartat al IMP gràcies a la sintetasa adenilosuccinato, substituint l'oxigen carbonil per nitrogen i formant l'intermediari adenilosuccinat. El fumarat s'escindeix després per formar monofosfat d'adenosina. Aquesta etapa és catalitzada gràcies a l'adenilosuccinato liasa. La inosina monofosfat es converteix en guanosina monofosfat gràcies a l'oxidació de l'IMP que forma xantilat, seguida per la inserció d'un grup amina en el C2. El NAD+ és l'acceptor d'electrons en la reacció d'oxidació. La transferència del grup amida des de la glutamina és impulsat per la hidròlisi d'ATP.
Síntesi de nucleòtids per reciclatge
[modifica]A banda de la síntesi de novo, les cèl·lules poden sintetitzar nucleòtids a partir de nucleòsids o de bases que provenen generalment de la degradació dels nucleòtids, tot i que una fracció molt petita pot provenir de la dieta.
Síntesi de nucleòtids per reciclatge de nucleòsids
[modifica]Consisteix en la fosforil·lació de nucleòsids mitjançant cinases de nucleòsids específiques, per donar lloc a nucleòtids monofosfat. Aquesta via existeix tant a la síntesi de ribonucleòtids com de desoxiribonucleòtids, ja siguin de purina o de pirimidina. L'esquema de la reacció és: Nucleòsid + ATP → Nucleòtid monofosfat + ADP
Exemples de cinases de nucleòsids són adenosina cinasa[17] (EC 2.7.1.20), timidina cinasa[18] (EC 2.7.1.21), desoxiguanosina cinasa[19] (EC 2.7.1.113), desoxicitidina cinasa[20] (EC 2.7.1.74).
Síntesi de nucleòtids per reciclatge de bases
Consisteix en la unió d’una base a una molècula de PRPP donant lloc al ribonucleòtid monofosfat corresponent. Aquesta reacció està catalitzada per enzims fosforibosiltransferases. Aquesta via permet sintetitzar ribonucleòtids a partir de bases reciclades, però no desoxiribonucleòtids. L'esquema de la reacció és: Base + PRPP → Nucleòtid monofosfat + PPi
Exemples d’enzims que catalitzen aquestes reaccions són la Hipoxantina-guanina fosforibosiltransferasa[21] (EC 2.4.2.8) o Adenina fosforibosiltransferasa[22] (EC 2.4.2.7).
Síntesi de desoxiribonucleòtids
[modifica]Els desoxiribonucleòtids se sintetitzen a partir de ribonucleòtids. El fet que els ribonucleòtids siguin precursors en la síntesi de desoxiribonucleòtids és un argument bioquímic a favor de la hipòtesi del món d’ARN. Aquesta teoria postula que anteriorment a la vida que hi ha actualment sobre la terra, va existir una vida basada en el RNA com a magatzem d’informació genètica que va evolucionar cap a les formes de vida actuals amb DNA.[23]
Concretament les cèl·lules sintetitzen desoxiribonucleòtids difosfat a partir de ribonucleòtids difosfat. Aquesta síntesi es duu a terme en una única reacció de reducció catalitzada per l'enzim ribonucleòtid reductasa (RNR)[24] que reconeix com a substrats els ribonucleòtids difosfat d’A, G, C i U. A partir dels desoxiribonucleòtids difosfat d’A, G i C es sintetitzen els corresponents desoxiribonucleòtids trifosfat mitjançant cinases de nucleòtids difosfat (NDPK).[25] Pel que fa a la síntesi dels desoxiribonucleòtids de Timina, l'enzim clau és la timidilat sintasa (EC. 2.1.1.45)[26] que sintetitza dTMP a partir de dUMP. A diferència dels ribonucleòtids que juguen múltiples funcions biològiques, els desoxiribonucleòtids trifosfat d’A, G, C i T són utilitzats només en la replicació del DNA i en la reparació de dany al DNA.
Degradació de nucleòtids
[modifica]Els àcids nucleics són degradats per enzims anomenats de forma genèrica nucleases. Dins les nucleases trobem les desoxiribonucleases (o DNAses)[27] i les ribonucleases (o RNAses)[28] que degraden DNA i RNA, respectivament. Les nucleases es poden classificar també en exonucleases (E.C. 3.1.11 - 3.1.16),[29] que alliberen els nucleòtids d’un en un per l'extrem de la cadena de polinucleòtids, i endonucleases (E.C. 3.1.21 - 3.1.31),[30][31] que trenquen l'enllaç fosfodièster en punts interns de la cadena. Els nucleòtids monofosfat, tant si provenen de la degradació d’àcids nucleics com si formen part del pool de nucleòtids amb altres funcions cel·lulars, són degradats per nucleotidases (E.C. 3.1.3.5, 3.1.3.6)[32] donant lloc a nucleòsids. Els nucleòsids poden ser reciclats mitjançant la síntesi de nucleòtids per reciclatge de nucleòsids o bé ser degradats per l’acció de nucleosidases (E.C. 3.2.2) donant lloc a bases.
En cèl·lules humanes, els anells de pirimidina (C, T, U) poden ser degradats completament en CO2 i NH3 (excreció d'urea). Cal dir que els anells de purina (G, A) no poden. En comptes d'això, es degraden en l'àcid metabòlic úric inert que després s'excreta del cos. L'àcid úric es forma quan el GMP es divideix en la base guanina i en la ribosa. La guanina es desamina a xantina que al seu torn s'oxida a àcid úric, sent aquesta última reacció irreversible. De la mateixa manera, l'àcid úric es pot formar quan AMP és desaminat en IMP del qual s'extreu la unitat de ribosa per formar hipoxantina. La hipoxantina s'oxida formant xantina i finalment creant àcid úric. En lloc de la secreció d'àcid úric, la guanina i el IMP poden ser utilitzats pel procés de reciclatge i per la síntesi d'àcids nucleics en presència de PRPP i aspartat (NH₃ donants).
Molts fàrmacs utilitzats en quimioteràpia pel tractament del càncer tenen com a diana enzims del metabolisme de nucleòtids[33] Molts d’ells pertanyen a la classe dels antimetabòlits, petites molècules químicament similars a metabòlits dels nucleòtids, que inhibeixen de manera competitiva l’activitat dels enzims implicats en la síntesi de nucleòtids. Alguns exemples importants són:
- la mercaptopurina. És un anàleg de purina i un inhibidor de la PRPP amidotransferasa, un enzim clau en la síntesi de novo de nucleòtids de purina. S’utilitza en quimioteràpia pel tractament de diversos càncers com leucèmies i limfoma non Hodgkin.[34]
- el 5-fluorouracil. És un anàleg de pirimidina, estructuralment semblant a l’uracil, que inhibeix la timidilat sintasa, provocant la disminució en la disponibilitat de desoxiribonucleòtids de timina per a la síntesi de DNA. El 5-fluorouracil i els seus derivats s’utilitzen en el tractament de càncer colorectal i pancreàtic, entre d’altres.[35][36]
- la gemcitabina i la citarabina. Són anàlegs de nucleòsids de pirimidina que s’incorporen al DNA provocant l’aturada de la síntesi de la nova cadena de DNA de manera que causen la mort de les cèl·lules que intenten entrar en divisió cel·lular. S’utilitzen pel tractament de diversos càncers, com el càncer de pàncrees.[37]
- el metotrexat. Pertany a la classe dels antifolats. Es un inhibidor del dihidrofolat reductasa, l'enzim de síntesi del tetrahidrofolat, un coenzim necessari per la funció de diversos enzims del metabolisme de nucleòtids com el timidilat sintasa.[38]
Els fàrmacs que tenen com a diana enzims del metabolisme de nucleòtids, presenten generalment efectes secundaris causats per la seva citotoxicitat sobre cèl·lules no canceroses amb alta taxa de divisió cel·lular.[39] En els darrers anys s’han fet importants avenços en el desenvolupament de fàrmacs amb dianes més específiques de les cèl·lules tumorals[40] o amb estratègies per fer arribar fàrmacs específicament a aquestes cèl·lules.[41] Tot i això la recerca en fàrmacs en el metabolisme continua i algunes dianes molt estudiades recentment inclouen els enzims dihidroorotat deshidrogenasa (DHODH),[42] l’únic enzim mitocondrial de la síntesi de novo de nucleòtids de pirimidina, o la inosina monofosfat deshidrogenasa (IMPDH),[43] l'enzim limitant en la síntesi de novo de nucleòtids de GMP.
Unitat de longitud
[modifica]El nucleòtid és una unitat de longitud comuna per una sola cadena de RNA, similar als parells de bases (bp) com a unitat de longitud de la doble cadena de DNA.
Codis d'abreujament per a bases degenerades
[modifica]La Unió Internacional de Química Pura i Aplicada (IUPAC, de l'anglès International Union of Pure and Applied Chemistry) té designats símbols per als nucleòtids.[44] A part de les cinc bases nitrogenades (A, G, C, T/U), normalment les bases degenerades s'utilitzen per designar encebadors de la reacció en cadena de la polimerasa (PCR). Els codis dels nucleòtidssón:
| Codi de nucleòtids IUPAC | Bases |
|---|---|
| A | Adenina |
| C | Citosina |
| G | Guanina |
| T (o U) | Timina (o Uracil) |
| R | A o G |
| Y | C o T (U) |
| S | G o C |
| W | A o T (U) |
| K | G o T (U) |
| M | A o C |
| B | C o G o T (U) |
| D | A o G o T (U) |
| H | A o C o T (U) |
| V | A o C or G |
| N | qualsevol base |
| . o - | buit |
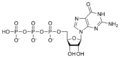
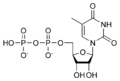
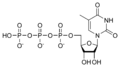
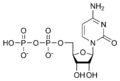
Estructures químiques
[modifica]Ribonucleòtids
[modifica]Desoxiribonucleòtids
[modifica]Vegeu també
[modifica]Referències
[modifica]- ↑ 1,0 1,1 Alberts B, Johnson A, Lewis J, Raff M, Roberts K & Wlater P (2002). Molecular Biology of the Cell (4th ed.). Garland Science. ISBN 0-8153-3218-1. pp. 120-121.
- ↑ Coghill, Anne M.; Garson, Lorrin R.. The ACS style guide: effective communication of scientific information. 3a edició. Washington, D.C.: American Chemical Society, 2006, p. 244. ISBN 9780841239999.
- ↑ Knowles, J. R. «Enzyme-catalyzed phosphoryl transfer reactions». Annual Review of Biochemistry, 49, 1980, pàg. 877–919. DOI: 10.1146/annurev.bi.49.070180.004305. ISSN: 0066-4154. PMID: 6250450.
- ↑ Itzen, Aymelt; Blankenfeldt, Wulf; Goody, Roger S. «Adenylylation: renaissance of a forgotten post-translational modification». Trends in Biochemical Sciences, 36, 4, 4-2011, pàg. 221–228. DOI: 10.1016/j.tibs.2010.12.004. ISSN: 0968-0004. PMID: 21256032.
- ↑ Zimmermann, Herbert «Extracellular ATP and other nucleotides-ubiquitous triggers of intercellular messenger release». Purinergic Signalling, 12, 1, 3-2016, pàg. 25–57. DOI: 10.1007/s11302-015-9483-2. ISSN: 1573-9546. PMC: 4749530. PMID: 26545760.
- ↑ Burnstock, Geoffrey «Purine and purinergic receptors». Brain and Neuroscience Advances, 2, 1-2018, pàg. 2398212818817494. DOI: 10.1177/2398212818817494. ISSN: 2398-2128. PMC: 7058212. PMID: 32166165.
- ↑ Zyma, Marharyta; Pawliczak, Rafał «Characteristics and the role of purinergic receptors in pathophysiology with focus on immune response». International Reviews of Immunology, 39, 3, 2020, pàg. 97–117. DOI: 10.1080/08830185.2020.1723582. ISSN: 1563-5244. PMID: 32037918.
- ↑ Gachet, Christian; Hechler, Beatrice «Platelet Purinergic Receptors in Thrombosis and Inflammation». Hamostaseologie, 40, 2, 5-2020, pàg. 145–152. DOI: 10.1055/a-1113-0711. ISSN: 2567-5761. PMID: 32464678.
- ↑ del Puerto, Ana; Wandosell, Francisco; Garrido, Juan José «Neuronal and glial purinergic receptors functions in neuron development and brain disease». Frontiers in Cellular Neuroscience, 7, 28-10-2013. DOI: 10.3389/fncel.2013.00197. ISSN: 1662-5102. PMC: 3808753. PMID: 24191147.
- ↑ Tozaki-Saitoh, Hidetoshi; Tsuda, Makoto; Inoue, Kazuhide «Role of purinergic receptors in CNS function and neuroprotection». Advances in Pharmacology (San Diego, Calif.), 61, 2011, pàg. 495–528. DOI: 10.1016/B978-0-12-385526-8.00015-1. ISSN: 1557-8925. PMID: 21586368.
- ↑ Burnstock, Geoffrey «Purinergic Signaling in the Cardiovascular System». Circulation Research, 120, 1, 06-01-2017, pàg. 207–228. DOI: 10.1161/CIRCRESAHA.116.309726. ISSN: 1524-4571. PMID: 28057794.
- ↑ Di Virgilio, F.; Adinolfi, E. «Extracellular purines, purinergic receptors and tumor growth». Oncogene, 36, 3, 19-01-2017, pàg. 293–303. DOI: 10.1038/onc.2016.206. ISSN: 1476-5594. PMC: 5269532. PMID: 27321181.
- ↑ Paoletti, Audrey; Raza, Syed Qasim; Voisin, Laurent; Law, Frédéric; Pipoli da Fonseca, Juliana «Multifaceted roles of purinergic receptors in viral infection». Microbes and Infection, 14, 14, 11-2012, pàg. 1278–1283. DOI: 10.1016/j.micinf.2012.05.010. ISSN: 1769-714X. PMID: 22683717.
- ↑ Zaharevitz, DW; Anerson, LW; Manlinowski, NM; Hyman, R; Strong, JM; Cysyk, RL. «Contribution of de-novo and salvage synthesis to the uracil nucleotide pool in mouse tissues and tumors in vivo». .
- ↑ Jones, ME «Pyrimidine nucleotide biosynthesis in animals: Genes, enzymes, and regulation of UMP biosynthesis». Ann. Rev. Biochem, 49, 1, 1980, pàg. 253–79. DOI: 10.1146/annurev.bi.49.070180.001345. PMID: 6105839.
- ↑ McMurry, JE; Begley, TP. The organic chemistry of biological pathways. Roberts & Company, 2005. ISBN 9780974707716.
- ↑ «ADK adenosine kinase [Homo sapiens (human) - Gene - NCBI]». [Consulta: 6 abril 2021].
- ↑ «TK1 thymidine kinase 1 [Homo sapiens (human) - Gene - NCBI]». [Consulta: 6 abril 2021].
- ↑ «DGUOK deoxyguanosine kinase [Homo sapiens (human) - Gene - NCBI]». [Consulta: 6 abril 2021].
- ↑ «DCK deoxycytidine kinase [Homo sapiens (human) - Gene - NCBI]». [Consulta: 6 abril 2021].
- ↑ «HPRT1 hypoxanthine phosphoribosyltransferase 1 [Homo sapiens (human) - Gene - NCBI]». [Consulta: 6 abril 2021].
- ↑ «APRT adenine phosphoribosyltransferase [Homo sapiens (human) - Gene - NCBI]». [Consulta: 6 abril 2021].
- ↑ Neveu, Marc; Kim, Hyo-Joong; Benner, Steven A. «The "strong" RNA world hypothesis: fifty years old». Astrobiology, 13, 4, 4-2013, pàg. 391–403. DOI: 10.1089/ast.2012.0868. ISSN: 1557-8070. PMID: 23551238.
- ↑ Nordlund, Pär; Reichard, Peter «Ribonucleotide reductases». Annual Review of Biochemistry, 75, 2006, pàg. 681–706. DOI: 10.1146/annurev.biochem.75.103004.142443. ISSN: 0066-4154. PMID: 16756507.
- ↑ Boissan, Mathieu; Schlattner, Uwe; Lacombe, Marie-Lise «The NDPK/NME superfamily: state of the art». Laboratory Investigation; a Journal of Technical Methods and Pathology, 98, 2, 2-2018, pàg. 164–174. DOI: 10.1038/labinvest.2017.137. ISSN: 1530-0307. PMID: 29451272.
- ↑ Taddia, Laura; D'Arca, Domenico; Ferrari, Stefania; Marraccini, Chiara; Severi, Leda «Inside the biochemical pathways of thymidylate synthase perturbed by anticancer drugs: Novel strategies to overcome cancer chemoresistance». Drug Resistance Updates: Reviews and Commentaries in Antimicrobial and Anticancer Chemotherapy, 23, 11-2015, pàg. 20–54. DOI: 10.1016/j.drup.2015.10.003. ISSN: 1532-2084. PMID: 26690339.
- ↑ Lauková, Lucia; Konečná, Barbora; Janovičová, Ľubica; Vlková, Barbora; Celec, Peter «Deoxyribonucleases and Their Applications in Biomedicine». Biomolecules, 10, 7, 11-07-2020. DOI: 10.3390/biom10071036. ISSN: 2218-273X. PMC: 7407206. PMID: 32664541.
- ↑ Canestrari, Emanuele; Paroo, Zain «Ribonucleases as Drug Targets». Trends in Pharmacological Sciences, 39, 10, 10-2018, pàg. 855–866. DOI: 10.1016/j.tips.2018.07.005. ISSN: 1873-3735. PMID: 30144949.
- ↑ Shevelev, Igor V.; Hübscher, Ulrich «The 3' 5' exonucleases». Nature Reviews. Molecular Cell Biology, 3, 5, 5-2002, pàg. 364–376. DOI: 10.1038/nrm804. ISSN: 1471-0072. PMID: 11988770.
- ↑ Dehé, Pierre-Marie; Gaillard, Pierre-Henri L. «Control of structure-specific endonucleases to maintain genome stability». Nature Reviews. Molecular Cell Biology, 18, 5, 5-2017, pàg. 315–330. DOI: 10.1038/nrm.2016.177. ISSN: 1471-0080. PMID: 28327556.
- ↑ Hirata, Akira «Recent Insights Into the Structure, Function, and Evolution of the RNA-Splicing Endonucleases». Frontiers in Genetics, 10, 2019, pàg. 103. DOI: 10.3389/fgene.2019.00103. ISSN: 1664-8021. PMC: 6379350. PMID: 30809252.
- ↑ Ipata, P. L.; Balestri, F. «The functional logic of cytosolic 5'-nucleotidases». Current Medicinal Chemistry, 20, 34, 2013, pàg. 4205–4216. DOI: 10.2174/0929867311320340002. ISSN: 1875-533X. PMID: 23992316.
- ↑ Villa, Elodie; Ali, Eunus S.; Sahu, Umakant; Ben-Sahra, Issam «Cancer Cells Tune the Signaling Pathways to Empower de Novo Synthesis of Nucleotides». Cancers, 11, 5, 17-05-2019. DOI: 10.3390/cancers11050688. ISSN: 2072-6694. PMC: 6562601. PMID: 31108873.
- ↑ Elion, G. B. «Nobel lecture in physiology or medicine--1988. The purine path to chemotherapy». In Vitro Cellular & Developmental Biology: Journal of the Tissue Culture Association, 25, 4, 1989-04-XX, pàg. 321–330. DOI: 10.1007/BF02624593. ISSN: 0883-8364. PMID: 2654122.
- ↑ Heidelberger, C.; Chaudhuri, N. K.; Danneberg, P.; Mooren, D.; Griesbach, L. «Fluorinated pyrimidines, a new class of tumour-inhibitory compounds». Nature, 179, 4561, 30-03-1957, pàg. 663–666. DOI: 10.1038/179663a0. ISSN: 0028-0836. PMID: 13418758.
- ↑ Wagner, Anna D.; Grothe, Wilfried; Haerting, Johannes; Kleber, Gerhard; Grothey, Axel «Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data». Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 24, 18, 20-06-2006, pàg. 2903–2909. DOI: 10.1200/JCO.2005.05.0245. ISSN: 1527-7755. PMID: 16782930.
- ↑ Parker, William B. «Enzymology of purine and pyrimidine antimetabolites used in the treatment of cancer». Chemical Reviews, 109, 7, 7-2009, pàg. 2880–2893. DOI: 10.1021/cr900028p. ISSN: 1520-6890. PMC: 2827868. PMID: 19476376.
- ↑ Walling, Jackie «From methotrexate to pemetrexed and beyond. A review of the pharmacodynamic and clinical properties of antifolates». Investigational New Drugs, 24, 1, 1-2006, pàg. 37–77. DOI: 10.1007/s10637-005-4541-1. ISSN: 0167-6997. PMID: 16380836.
- ↑ Luengo, Alba; Gui, Dan Y.; Vander Heiden, Matthew G. «Targeting Metabolism for Cancer Therapy». Cell Chemical Biology, 24, 9, 21-09-2017, pàg. 1161–1180. DOI: 10.1016/j.chembiol.2017.08.028. ISSN: 2451-9448. PMC: 5744685. PMID: 28938091.
- ↑ «Treatment strategies in cancer from past to present» (en anglès). Drug Targeting and Stimuli Sensitive Drug Delivery Systems, 01-01-2018, pàg. 1–37. DOI: 10.1016/B978-0-12-813689-8.00001-X.
- ↑
- ↑ Madak, Joseph T.; Bankhead, Armand; Cuthbertson, Christine R.; Showalter, Hollis D.; Neamati, Nouri «Revisiting the role of dihydroorotate dehydrogenase as a therapeutic target for cancer». Pharmacology & Therapeutics, 195, 3-2019, pàg. 111–131. DOI: 10.1016/j.pharmthera.2018.10.012. ISSN: 1879-016X. PMID: 30347213.
- ↑ Naffouje, Rand; Grover, Punita; Yu, Hongyang; Sendilnathan, Arun; Wolfe, Kara «Anti-Tumor Potential of IMP Dehydrogenase Inhibitors: A Century-Long Story». Cancers, 11, 9, 11-09-2019. DOI: 10.3390/cancers11091346. ISSN: 2072-6694. PMC: 6770829. PMID: 31514446.
- ↑ «IUPAC nucleotide code». Arxivat de l'original el 2011-11-08. [Consulta: 12 novembre 2011].
Enllaços externs
[modifica]- Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents (IUPAC)
- Provisional Recommendations 2004 (IUPAC)
- Chemistry explanation of nucleotide structure Arxivat 2006-09-01 a Wayback Machine.
| Principals famíles bioquímiques | ||
| Àcids nucleics | Alcaloides | Aminoàcids | Carbohidrats | Carotenoides | Cofactors enzimàtics | Esteroides | Flavonoides | Glicòsids | Lípids | Pèptids | Policètids | Tetrapirrols | Terpens | ||
| Anàlegs d'àcids nucleics: | Tipus d'àcids nucleics | Anàlegs d'àcids nucleics : |
| Bases nitrogenades: | Adenina | Timina | Uracil | Guanina | Citosina | Purina | Pirimidina | |
|---|---|---|
| Nucleòsids: | Adenosina | Uridina | Guanosina | Citidina | Desoxiadenosina | Timidina | Desoxiguanosina | Desoxicitidina | |
| Nucleòtids: | AMP | UMP | GMP | CMP | ADP | UDP | GDP | CDP | ATP | UTP | GTP | CTP | AMPc | GMPc | ADPRc | |
| Desoxinucleòtids: | dAMP | TMP | dGMP | dCMP | dADP | TDP | dGDP | dCDP | dATP | TTP | dGTP | dCTP | |
| Àcids ribonucleics: | ARNm | ARNt | ARNr | ARNn | ARNnc | ARNmi | |
| Àcids desoxiribonucleics: | ADMmt | ADNc | |
| Anàlegs d'àcids nucleics: | AGN | APN | ATN | Morfolí | ARNin | |
| Seqüències: | Plasmidi | Còsmid | CAB | CAH | Cromosoma | Oligonucleòtid | |