Chlorid boritý
| Chlorid boritý | |
|---|---|
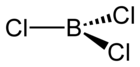 Strukturní vzorec | |
 3D model | |
| Obecné | |
| Systematický název | Chlorid boritý |
| Anglický název | Boron trichloride |
| Sumární vzorec | BCl3 |
| Vzhled | Bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 10294-34-5 |
| EC-no (EINECS/ELINCS/NLP) | 233-658-4 |
| Indexové číslo | 005-002-00-5 |
| Číslo RTECS | ED1925000 |
| Vlastnosti | |
| Molární hmotnost | 117,169 g/mol |
| Teplota tání | −107,3 °C (165,85 K) |
| Teplota varu | 12,5 °C (285,65 K) (1 013 hPa) |
| Hustota | 1,340 g/cm3 (12,5 °C, kapalina) 4,95 kg/m3 (15 °C, 1 013 hPa, plyn) |
| Kritická teplota Tk | 178,8 °C (451,95 K) |
| Kritický tlak pk | 3 746 kPa |
| Kritická hustota | 0,7 g/cm3 |
| Rozpustnost ve vodě | Rozklad |
| Rozpustnost v nepolárních rozpouštědlech | CCl4 |
| Měrná magnetická susceptibilita | −6,65×10−6cm3g−1 |
| Povrchové napětí | 16,7 mN/m |
| Struktura | |
| Krystalová struktura | šesterečná |
| Hrana krystalové mřížky | a=614 pm, c=660,3 pm |
| Tvar molekuly | planární |
| Dipólový moment | 0 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −418,4 kJ/mol |
| Entalpie tání ΔHt | 58,1 J/g |
| Entalpie varu ΔHv | 204 J/g |
| Standardní molární entropie S° | 206 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −387,2 kJ/mol |
| Izobarické měrné teplo cp | 0,913 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H330 H300 H314 EUH014 |
| R-věty | R14, R26/28, R34 |
| S-věty | S1/2, S9, S26, S28, S36/37/39, S45 |
| Teplota vznícení | Není vznítitelný |
Některá data mohou pocházet z datové položky. | |
Chlorid boritý je za normální teploty plyn štiplavého a dráždivého zápachu, s přibližně čtyřikrát větší hustotou než vzduch.
Příprava
[editovat | editovat zdroj]Připravuje se buď přímým slučováním elementárního bóru s chlorem
2 B + 3 Cl2 → 2 BCl3, |
|
nebo redukcí oxidu boritého uhlíkem za přítomnosti chlóru; vedlejším produktem reakce je oxid uhelnatý:
B2O3 +3 C + 3 Cl2 → 2 BCl3 + 3 CO |
|
Vlastnosti
[editovat | editovat zdroj]Molekula chloridu boritého je svou strukturou velmi podobná struktuře molekuly fluoridu boritého, je planární (rovinná) a má trojčetnou symetrii.
Vzhledem k tomu, že valenční elektronová slupka atomu bóru je neúplně obsazená pouze šesti elektrony, molekula chloridu boritého vystupuje v reakcích jako Lewisova kyselina a snadno se váže s molekulami obsahujícími volný elektronový pár; vzhledem k velkému objemu chlórového atomu však obvykle následuje disociace chlorového atomu, takže postupně dochází k výměně chlorových atomů, pokud reagující molekuly jsou menší než atomy chloru.
Tak např. při reakci s vodou vzniká v prvním stupni
BCl3 + H2O → Cl3B−−O+H2 → Cl2B—OH + HCl. |
|
Postupně tak dojde k nahrazení všech atomů chloru hydroxylovými skupinami, takže souhrnnou reakcí vzniká kyselina boritá a chlorovodík:
BCl3 + 3 H2O → H3BO3 + 3 HCl. |
|
Tato reakce probíhá i se vzdušnou vlhkostí, proto kapalný chlorid boritý ponechaný v otevřené nádobě na vzduchu dýmá. Je tedy za přítomnosti stop vody značně korozivní a z toho důvodu se nesmí uchovávat v kovových nádobách bez náležité povrchové úpravy.
Podobně reakcí s amoniakem vzniká triamid kyseliny borité a chlorid amonný:
- BCl3 + 6 NH3 → B(NH2)3 + 3 NH4Cl.
Použití
[editovat | editovat zdroj]Chlorid boritý se používá pro vnášení atomů bóru (dopování) do monokrystalických vrstev křemíku pří výrobě polovodičů typu p.
Fyziologické působení
[editovat | editovat zdroj]Páry chloridu boritého při nadechnutí uvolňují působením vody ve sliznicích chlorovodík, který je dráždí. Ve větším množství může způsobit poleptání sliznic nebo kůže, případně až edém plic. Je proto nebezpečný již při koncentracích ve vzduchu kolem 20 ppm.
Reference
[editovat | editovat zdroj]- ↑ a b Boron trichloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu chlorid boritý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid boritý na Wikimedia Commons
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.

