Chlorid iriditý
| Chlorid iriditý | |
|---|---|
 α-IrCl3 | |
 β-IrCl3 | |
| Obecné | |
| Systematický název | Chlorid iriditý |
| Anglický název | Iridium(III) chloride |
| Německý název | Iridium(III)-chlorid |
| Sumární vzorec | IrCl3 |
| Vzhled | tmavězelené krystaly |
| Identifikace | |
| Registrační číslo CAS | (bezvodý) 14996-61-3 (hydrát)&Units=SI 10025-83-9 (bezvodý) 14996-61-3 (hydrát) |
| SMILES | Cl[Ti](Cl)Cl |
| InChI | InChI=1S/3ClH.Ti/h3*1H;/q;;;+3/p-3 |
| Vlastnosti | |
| Molární hmotnost | 154,225 g/mol |
| Teplota tání | 763 °C |
| Hustota | 5,30 g·cm−3 |
Některá data mohou pocházet z datové položky. | |
Chlorid iriditý je chemická sloučenina s vzorcem IrCl3. V bezvodém stavu je poměrně vzácný, ale trihydrát (IrCl3·3H2O) je výhodnou sloučeninou pro přípravu jiných sloučenin iridia.
Příprava
[editovat | editovat zdroj]Bezvodý chlorid iriditý lze připravit reakcí kovového iridia s chlorem za teploty 300–400 °C:[1][2][3]
- 2 Ir + 3 Cl2 → 2 IrCl3
Hydratovaný připravíme zahříváním oxidu iriditého s kyselinou chlorovodíkovou:[3]
- Ir2O3 + 6 HCl → 2 IrCl3 + 3 H2O
Struktura
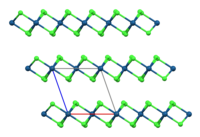
[editovat | editovat zdroj]Bezvodý α-IrCl3 má vrstevnatou strukturu izomorfní s AlCl3.[1] Zahříváním hnědé α modifikace na teplotu 600–800 °C dojde k přechodu na červenou, romboedrickou modifikaci β.[4]
Použití
[editovat | editovat zdroj]Hydratovaný chlorid se používá pro přípravy jiných sloučenin iridia, např. Vaskova komplexu, trans-IrCl(CO)[P(C6H5)3]2.[5]
- IrCl3(H2O)3 + 3 P(C6H5)3 + HCON(CH3)2 + C6H5NH2 → IrCl(CO)[P(C6H5)3]2 + [(CH3)2NH2]Cl + OP(C6H5)3 + [C6H5NH3]Cl + 2 H2O
Zahříváním alkenu s chloridem iriditým lze připravit odpovídající alkenový komplex iridia.[6]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Iridium(III) chloride na anglické Wikipedii.
- ↑ a b HOUSECROFT, Catherine E. Anorganická chemie. Vyd. 1. vyd. Praha: Vysoká škola chemicko-technologická v Praze xxx, 1119 s. s. Dostupné online. ISBN 978-80-7080-872-6, ISBN 80-7080-872-1. OCLC 894846634 S. 805.
- ↑ DILLAMORE, I.M.; EDWARDS, D.A. The reactions of sulphuryl chloride with metals—II. Journal of Inorganic and Nuclear Chemistry. 1969-08, roč. 31, čís. 8, s. 2427–2430. Dostupné online [cit. 2021-07-09]. DOI 10.1016/0022-1902(69)80574-9. (anglicky)
- ↑ a b GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. OCLC 320245801 S. 1382–1384.
- ↑ MEISEL, A.; LEONHARDT, G. Die Kristallstruktur von ?-Iridium(III)-Chlorid. Zeitschrift für anorganische und allgemeine Chemie. 1965-09, roč. 339, čís. 1–2, s. 57–66. Dostupné online [cit. 2021-07-09]. ISSN 0044-2313. DOI 10.1002/zaac.19653390109. (německy)
- ↑ G. S. Girolami; T. B. Rauchfuss; R. J. Angelici. Synthesis and Technique in Inorganic Chemistry. [s.l.]: University Science Books, 1999. Dostupné online. ISBN 0-935702-48-2. S. 190.
- ↑ HERDE, J. L.; LAMBERT, J. C.; SENOFF, C. V. Cyclooctene and 1,5-Cyclooctadiene Complexes of Iridium(I). Příprava vydání George W. Parshall. Hoboken, NJ, USA: John Wiley & Sons, Inc. Dostupné online. ISBN 978-0-470-13246-3, ISBN 978-0-470-13176-3. DOI 10.1002/9780470132463.ch5. S. 18–20. DOI: 10.1002/9780470132463.ch5.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Chlorid iriditý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chlorid iriditý na Wikimedia Commons