Glykosylace

Glykosylace je řada enzymatických nebo chemických reakcí, při kterých jsou sacharidy (dřívější název glycidy) nebo polysacharidy (dřívější název glykany) vázány na proteiny, lipidy nebo jiné sloučeniny. Sacharid (donor glykosylu) se připojí k funkční skupině jiné molekuly (akceptor glykosylu) za účelem vytvoření glykokonjugátu. Výsledný reakční produkt se obecně nazývá glykosid (v případě proteinů glykoprotein, v případě lipidů glykolipid).
Glykosidy hrají významnou roli v mnoha biologických procesech:
- Glykosylací prochází většina proteinů syntetizovaných v hrubém endoplazmatickém retikulu.
- Glykosylace je přítomna v cytoplazmě a jádře jako modifikace O-GlcNAc
- Aglykosylace je vlastností umělých protilátek k obcházení glykosylace.
Dělení
[editovat | editovat zdroj]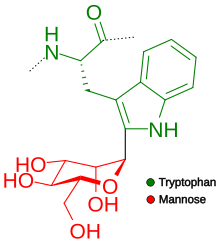
Glykosylace polysacharidy (glykany) je rozdělena do pěti skupin podle vazby na daný prvek:
- N-vázané glykany připojené k dusíku asparaginu nebo argininovým postranním řetězcům. N-vázaná glykosylace vyžaduje účast speciálního lipidu nazývaného dolicholfosfát.
- O-vázané glykany připojené na hydroxylový kyslík v serinu, threoninu, tyrosinu, hydroxylysinu, na postranní řetězce hydroxyprolinu nebo na kyslíky v lipidech, jako je ceramid.
- P-vázané glykany (fosfoglykany) připojené na fosfát fosfoserinu.
- C-vázané glykany připojené na uhlík. Je to vzácná forma glykosylace, kdy se sacharid váže k uhlíku na postranním řetězci tryptofanu. Příkladem je glykosid aloin, který je jednou z mála přirozeně se vyskytujících látek. Nachází se v rostlině Aloe vera.
- Glypiace (přidání glykosylfosfatidylinositolu - tak zvané GPI kotvy) spojuje proteiny s lipidy vazbou glykosylfosfatidylinositolu. Umožňuje tak zakotvení proteinu v lipidové vrstvě membrány.
Výskyt
[editovat | editovat zdroj]- Glykosylace se vyskytuje prakticky u všech organismů, liší se pouze v sekvencích a v počtech sacharidů. Většina eukaryotických proteinů je glykosylována.
- Glykosylační reakce jsou zapojené do buněčných signalizačních procesů
- Jsou důležitou součástí posttranslačních modifikací proteinů. Vysoce specifické enzymy zapojené do tohoto procesu se označují jako glykosyltransferázy.
- Negativní vliv má glykosylace při infekčních onemocněních, neboť umožňuje virům nebo bakteriím navázat se na buňky, které následně infikují. Děje se tak především na sliznicích nebo ve střevech hostitele.
- Chemické glykosylační metody byly vyvinuty i pro laboratorní chemickou syntézu.
Funkce
[editovat | editovat zdroj]Glykosylace plní v živém organismu velmi odlišné funkce:
- Zvyšuje stabilitu některých proteinů a chrání před proteolytickou degradací.
- Mnoho proteinů se neskládá správně, pokud nebyly předem glykosylovány.
- Může také změnit afinitu k vazebným partnerům (například inzulinový receptor).
- Kromě signálních peptidů se glykosylace používá také pro intracelulární transport a exocytózu. Glykoproteiny jsou transportovány na buněčnou membránu, neglykosylované proteiny nemohou být uvolněny.
- Sacharidy zapojené do glykosylace slouží také jako strukturní složky buněčných membrán a přispívají k interakci buněk.
- Různá glykosylace povrchových proteinů erytrocytů vede k různým krevním typům mnoha savců.
- Glykosylace může také plnit funkci jako mazivo v sliznici nebo hlenu.
Glykosylace proteinů
[editovat | editovat zdroj]
Glykosylace proteinů, při které vznikají glykoproteiny, probíhá především v hrubém endoplazmatickém retikulu a částečně následně v Golgiho aparátu. Různé enzymy vedou katalyzované procesy k různým typům glykosylace proteinů, jako je například N-glykosylace na asparagin nebo O-glykosylace na serin, threonin nebo tyrosin. Tyto procesy jsou velmi specifické. Pouze určité aminokyseliny jsou glykosylovány a složení příslušné sacharidové skupiny je také velmi specifické.
Glykosylace lipidů
[editovat | editovat zdroj]Glykosylace lipidů je enzymaticky zprostředkovaná reakce, při které vznikají glykolipidy. Oligosacharidová část glykolipidů se obvykle nachází na vnější straně buněčné membrány. Hraje zde roli v interakcích mezi jednotlivými buňkami nebo při přenosu signálů (glykokalyx).
Mutace glykosylace
[editovat | editovat zdroj]Různá dědičná onemocnění vedou k nesprávné nebo chybějící glykosylaci, která je pak fyziologicky méně účinná. V závislosti na mutaci může být defektní biopolymer nebo glykosylační enzym. Například Marfanův syndrom je způsoben vadnou glykosylací fibrilinu.
Glykace
[editovat | editovat zdroj]Rozlišuje se mezi glykosylací (zapojení enzymů do chemické reakce) a glykací (chemickou reakcí bez zapojení enzymů mezi aminem aminokyseliny a redukujícím sacharidem).
Jedná se například o Maillardovu reakci, která probíhá přes Schiffovu bázi na Amadoriho produkt. Nevzniká glykosid, ale přeskupení na α-aminoketon R-NH-CH2-C(O)-R ́.
Reference
[editovat | editovat zdroj]V tomto článku byly použity překlady textů z článků Glykosylierung na německé Wikipedii a Glycosylation na anglické Wikipedii.