Malononitril
| Malononitril | |
|---|---|
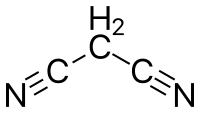 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | propandinitril |
| Funkční vzorec | NCCH2CN |
| Sumární vzorec | C3H2N2 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 109-77-3 |
| EC-no (EINECS/ELINCS/NLP) | 203-703-2 |
| PubChem | 8010 |
| ChEBI | 33186 |
| SMILES | N#CCC#N |
| InChI | InChI=1S/C3H2N2/c4-2-1-3-5/h1H2 |
| Vlastnosti | |
| Molární hmotnost | 66,061 g/mol |
| Teplota tání | 32 °C (305 K)[1] |
| Teplota varu | 219 °C (492 K)[1] |
| Hustota | 1,191 g/cm3 (20 °C)[1] |
| Index lomu | 1,4146 g/cm3 (34 °C)[1] |
| Rozpustnost ve vodě | 13,3 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu, ethanolu, kyselině octové a chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu[1] |
| Tlak páry | 27 Pa[1] |
| Ionizační energie | 12,88 eV[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H301 H311 H331 H400 H410[1] |
| P-věty | P261 P264 P270 P271 P273 P280 P301+316 P302+352 P304+340 P316 P321 P361+364 P391 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Malononitril je organická sloučenina patřící mezi nitrily, se vzorcem CH2(CN)2. V čisté podobě jde o bílou pevnou látku, starší vzorky bývají zabarvené do žluta nebo hněda. Využití má v organické syntéze.
Příprava, výroba a reakce
[editovat | editovat zdroj]Malononitril se dá připravit dehydratací kyanoacetamidu.[2] V průmyslu se nejčastěji používá reakce plynného acetonitrilu s chlorkyanem:[3]
- NCCl + CH3CN → NCCH2CN + HCl
Z malononitrilu se vyrábí thiamin, léčiva triamteren a minoxidil, a barviva disperzní žluť 90 a disperzní modř 354.[3]
Malononitril je slabě kyselý, jeho pKa má ve vodě hodnotu 11,4.[4] Lze jej tak zapojit do Knoevenagelových kondenzací, například při výrobě 2-chlorbenzylidenmalononitrilu:

Malononitril je také vhodný pro Gewaldovy reakce, kde kondenzují nitrily s ketony nebo aldehydy za přítomnosti zásady a elementární síry, přičemž se tvoří 2-aminované thiofeny.[5]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Malononitrile na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m https://pubchem.ncbi.nlm.nih.gov/compound/8010
- ↑ Alexander Surrey. Malononitrile. Organic Syntheses. 1945, s. 63–64. DOI 10.15227/orgsyn.025.0063.
- ↑ a b Harald Strittmatter; Stefan Hildbrand; Peter Pollak. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: [s.n.], 2007. ISBN 978-3527306732. DOI 10.1002/14356007.a16_063.pub2. Kapitola Malonic Acid and Derivatives.
- ↑ PUBCHEM. Malononitrile. pubchem.ncbi.nlm.nih.gov [online]. [cit. 2023-07-01]. Dostupné online. (anglicky)
- ↑ R. W. Sabnis; D. W. Rangnekar; N. D. Sonawane. 2-Aminothiophenes By The Gewald Reaction. Journal of Heterocyclic Chemistry. 1999, s. 333–345. Dostupné online. DOI 10.1002/jhet.5570360203.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Malononitril na Wikimedia Commons
Obrázky, zvuky či videa k tématu Malononitril na Wikimedia Commons

