Acryloylchlorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Acryloylchlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H3ClO | |||||||||||||||
| Kurzbeschreibung |
farblose[1] bis hellgelbe[2] Flüssigkeit mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 90,51 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
löslich in Chlorkohlenwasserstoffen wie Dichlormethan und Chloroform,[3] in Tetrahydrofuran[5] | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Acryloylchlorid ist eine α,β-ungesättigte Carbonylverbindung und als Chlorid der Acrylsäure bzw. als Carbonsäurechlorid und funktionales Alken besonders reaktiv. Mit Wasser reagiert Acryloylchlorid heftig unter Zersetzung[4] und in Kontakt mit Polymerisationsinitiatoren polymerisiert es explosionsartig.
Wegen seiner hohen Giftigkeit, Entzündbarkeit und Korrossivität muss Acryloylchlorid mit großer Vorsicht gehandhabt werden.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Bei der Umsetzung von Acrylsäure mit anorganischen Säurechloriden,[6] wie z. B. Phosphoroxychlorid oder Thionylchlorid, oder mit organischen Verbindungen, wie Benzoylchlorid[7][8] oder Benzotrichlorid.[9]

Acryloylchlorid ist auch durch Reaktion von Vinylchlorid und Kohlenmonoxid an einem Palladium-Gold-Kontakt bei Temperaturen um 150 °C und Drücken um 100 atm in Batch- und kontinuierlicher Fahrweise zugänglich.[10]

Die direkte Carbonylierung von Vinylchlorid mit einem CO-Überschuss verläuft in sehr guten Ausbeuten (>90 % d.Th.) und liefert in Gegenwart von Alkoholen als Lösungsmittel den entsprechenden Acrylsäureester.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Acryloylchlorid ist in reinem Zustand eine klare, farblose, leicht flüchtige Flüssigkeit mit stechendem Geruch. Die Dämpfe sind leicht entzündlich und bilden mit Luft leicht explosionsfähige Gemische. Die Verbindung hat einen Flammpunkt von −4 °C.[1] Die Grenzspaltweite wurde mit 1,06 mm bestimmt.[1] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[1] In Wasser hydrolysiert Acryloylchlorid in einer stark exothermer Reaktion zu Acrylsäure und Salzsäure und wirkt sehr giftig, ätzend und korrosiv.[11]
Acryloylchlorid neigt leicht zur Polymerisation.[11] Es muss daher in fest verschlossenen, lichtundurchlässigen Gefäßen trocken bei 2–8 °C gelagert und mit wirksamen Mengen eines Polymerisationsinhibitor, z. B. 100 ppm Hydrochinon, 200 ppm Hydrochinonmonomethylether (MEHQ) oder 200 ppm Phenothiazin[4] stabilisiert werden.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Aufgrund seiner ausgeprägten Reaktivität gegenüber Nucleophilen ist Acryloylchlorid ein wirksames Agens zur Bildung von Anhydriden, Estern, Thioestern und Amiden unter Einführung der polymerisationsaktiven Acryloylgruppe.
Mit dem Alkohol 2-Phenyl-2-(phenylthio)ethanol (aus Thiophenol und Styroloxid in Gegenwart von Zinkchlorid erhalten) reagiert Acryloylchlorid in Ausbeuten bis 94 % d.Th. zu dem entsprechenden Acrylsäureestermonomer, der sich durch eine niedrige Glasübergangstemperatur von 25 °C und einen hohen Brechungsindex von 1,584 auszeichnet.[12]

Der Ester eignet sich als Comonomer zur Herstellung von besonders dünnen, leichten und flexiblen Kontaktlinsen.
Das durch Umsetzung von Acryloylchlorid mit Agmatin erhaltene Acrylamidoagmatin findet Anwendung als Comonomer zur Polymerisation mit Acrylamid.[13]
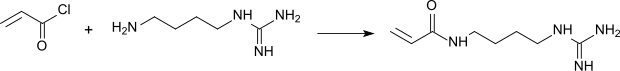
Aus den stark basischen Copolymeren können hydrophile Gele für die Elektrophorese und Chromatographie hergestellt werden.
Die Fähigkeit der Acrylsäurederivate zur Michael-Addition von Nucleophilen, insbesondere von Thiolen und Aminen an die aktivierte Doppelbindung kann z. B. zur Herstellung funktionalisierter Glas- oder Siliciumoberflächen zum Aufbau von Microarrays für die DNA- und Proteinanalytik eingesetzt werden.[14]
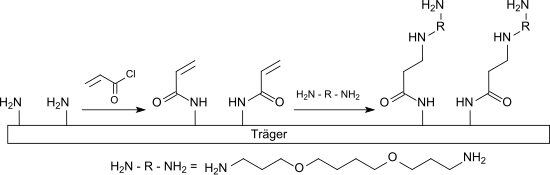
So wird eine aminfunktionalisierte Trägeroberfläche mit Acryloylchlorid zum Acrylamid umgesetzt und anschließend mit einem hydrophilen langkettigen Diamin, wie z. B. 1,4-Bis(3-aminopropoxy)butan, in einer Michael-Addition verknüpft. Die freie primäre Aminogruppe dieses Spacermoleküls kann mit einem bifunktionellen Vernetzer, wie z. B. Phenylendiisothiocyanat (PDITC), zur Bindung mit einem aminogruppenhaltigen Biomolekül, z. B. einem Protein, aktiviert werden.
Die gleiche Synthesestrategie – Umsetzung von aktivierten Acrylsäurederivaten wie Acryloylchlorid mit mehrwertigen Aminen und anschließende Michael-Addition – eröffnet einen Zugang zu hochverzweigten Polymeren (engl. hyperbranched polymers).[15]
Aus Acryloylchlorid und Diethylentriamin wird ein fünffach acylierten Zwischenprodukt erhalten[8][in der angegebenen Literaturstelle bereits als hyperbranched polymer bezeichnet], das weiter zu einem hochverzweigten Polymeren reagieren kann.
Acryloylchlorid reagiert mit Dianol 22 (Bisphenol A bis(2-hydroxyethyl)ether)[16] zum Diacrylat (DDA), das wegen seiner hervorragenden Filmbildungs- und Weichmachereigenschaften in Beschichtungsharzen als Vernetzer eingesetzt wird.[17]

Die freie radikalische Homopolymerisation von Acryloylchlorid mit Azobis(isobutyronitril) (AIBN) führt zum Poly(acryloylchlorid)[18]

In 1,4-Dioxan als Lösungsmittel erhält man bei 50 °C mit einer Ausbeute von 90 % d. Th. unverzweigtes Polymer.
Über polymeranaloge Reaktionen der Säurechloridgruppen des Poly(acryloylchlorids) mit Aminen oder Alkoholen können die entsprechenden Seitengruppen in das Polymer eingeführt werden.[19]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k Eintrag zu Acrylsäurechlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b c d e Datenblatt Acryloyl chloride 97% bei Sigma-Aldrich, abgerufen am 25. November 2014 (PDF).
- ↑ a b c W.M. Haynes: Handbook of Chemistry and Physics, 91st ed., 2010–2011. CRC Press, Boca Raton, 2010, ISBN 978-1-4398-2077-3, S. 3–442.
- ↑ a b c Datenblatt Acrylsäurechlorid (stabilisiert mit Phenothiazin) zur Synthese bei Merck, abgerufen am 25. November 2014.
- ↑ G.R. Deen: Solution Properties of Water-Soluble “Smart” Poly(N-acryloyl-N′-ethyl piperazine-co-methyl methacrylate). In: Polymers. Band 4, 2012, S. 32–45, doi:10.3390/polym4010032.
- ↑ W. Bauer: Acrylic Acid and Derivatives. In: Kirk-Othmer Encyclopedia of Chemical Technology. 5. Auflage. Volume 1. Wiley, 2004, ISBN 0-471-48522-5.
- ↑ G.H. Stempel Jr., R.P. Cross, R.P. Mariella: The preparation of acrylyl chloride. In: J. Am. Chem. Soc. Band 72, Nr. 2, 1950, S. 2299–2300, doi:10.1021/ja.001161a527.
- ↑ a b R.N. Jagtap, Y.T. Chimankar: Synthesis of dumbbell shape hyperbranched polymer: Based on diethylene triamine and acryloyl chloride used as rheology modifier for water based paints. In: Adv. Appl. Sci. Res. Band 4, Nr. 2, 2013, S. 228–237.
- ↑ Patent US5395966: Process for the manufacture of acryloyl chloride. Angemeldet am 22. Juli 1994, veröffentlicht am 7. März 1995, Anmelder: Atochem, Erfinder: J.-F. Croizy, P. Grosius.
- ↑ Patent US3626005: Preparation of unsaturated acyl halides. Angemeldet am 14. Juli 1967, veröffentlicht am 7. Dezember 1971, Anmelder: National Distillers and Chemical Corp., Erfinder: J.A. Scheben, J.M. Fischer, I.L. Mador.
- ↑ a b L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Acrylsäurechlorid, CD-ROM Ausgabe 12/2021, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4.
- ↑ Patent WO2014072995A2: Sulphur containing high refractive index monomer. Angemeldet am 30. Oktober 2013, veröffentlicht am 15. Mai 2014, Anmelder: Council of Scientific and Industrial Research, India, Erfinder: S. Ponrathnam, R.V. Ghorpade, N.N. Chavan, K.S. Rajdeo, S.S. Bhongale.
- ↑ Patent US2007106090: Method for synthesis of acrylamide derivatives. Angemeldet am 18. Oktober 2004, veröffentlicht am 10. Mai 2007, Anmelder: GE Healthcare Bio-Sciences Corp., Erfinder: M. Algotsson, P. Busson, N. Thevenin.
- ↑ K. Aboytes, J. Humphreys, S. Reis, B. Ward: A beginner’s guide to microarrays, E. M. Blalock ed. Chapter 1: Slide coating and DNA immobilization chemistries. Kluwer Academic Publishers, 2003, ISBN 1-4020-7472-7.
- ↑ C. Gao, D. Yan: Hyperbranched polymers: from synthesis to applications. In: Prog. Polym. Sci. Band 29, 2004, S. 183–275, doi:10.1016/j.progpolymsci.2003.12.002.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Bisphenol A bis(2-hydroxyethyl)ether: CAS-Nr.: 901-44-0, EG-Nr.: 212-985-6, ECHA-InfoCard: 100.011.805, GESTIS: 107723, PubChem: 61909, ChemSpider: 55770, Wikidata: Q27116159.
- ↑ R.H. Leach, R.J. Pierce (Hrsg.): The Printing Ink Manual. 5. Auflage. Springer, 2007, ISBN 978-0-948905-81-0, S. 286.
- ↑ R.C. Schulz, P. Elzer, W. Kern: Über die Polymerisation von Acrylsäurechlorid. In: Makromol. Chem. Band 42, Nr. 1, 1960, S. 189–196, doi:10.1002/macp.1960.020420119.
- ↑ H.R. Kricheldorf, O. Nuyken, G. Swift (Hrsg.): Handbook of Polymer Synthesis. 2. Auflage. M. Dekker, 2005, ISBN 0-8247-5473-5, S. 286–288.


