Edoxaban
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Edoxaban | |||||||||||||||
| Andere Namen |
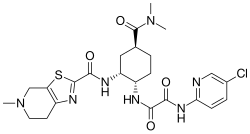
N-(5-Chlor-2-pyridinyl)-N'-[(1S,2R,4S)-4-(dimethylcarbamoyl)-2-{[(5-methyl-4,5,6,7-tetrahydro[1,3]thiazolo[5,4-c]pyridin-2-yl)carbonyl]amino}cyclohexyl]ethandiamid (IUPAC) | |||||||||||||||
| Summenformel | C24H30ClN7O4S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 548,06 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Edoxaban (Handelsname Lixiana, in manchen Ländern Savaysa) ist ein Arzneistoff der Klasse der Antikoagulanzien (Gerinnungshemmer). Er wurde 2011 in Japan und 2015 in Europa zur Verlangsamung der Blutgerinnung zugelassen. Die Substanz ist ein direkter Faktor-Xa-Inhibitor und gehört damit zur Gruppe der direkten oralen Antikoagulanzien (DOAK), die auch als neue orale Antikoagulanzien (NOAK) bezeichnet werden.[2]
Das Wort Edoxaban setzt sich zusammen aus dem alten Namen Edo für Tokio, dem Sitz des Herstellers Daiichi Sankyo, aus Xa als Abkürzung für die Hemmung des Gerinnungsfaktors Xa und aus dem Suffix -(b)an für die Gruppe der DOAKs.
Indikation
[Bearbeiten | Quelltext bearbeiten]Edoxaban wird wie die anderen neuen oralen Antikoagulanzien im Rahmen von nicht-valvulärem Vorhofflimmern zur Vorbeugung einer Embolie bzw. eines Schlaganfalls verschrieben. Eine weitere zugelassene Anwendung ist die Therapie einer tiefen Beinvenenthrombose bzw. Lungenembolie.
Wirkung
[Bearbeiten | Quelltext bearbeiten]Edoxaban hemmt wie Rivaroxaban und Apixaban den aktivierten Blutgerinnungsfaktor Xa direkt. Dadurch wird weniger Thrombin hergestellt, das den letzten Schritt der Blutgerinnung, nämlich die Bildung von Fibrin aus Fibrinogen, bewirkt. Somit läuft die Blutgerinnung verzögert oder gar nicht ab. Es wirkt damit über einen anderen Mechanismus als Warfarin oder Phenprocoumon.[3][4]
Die herkömmlichen Gerinnungstests wie INR oder PTT zeigen die Wirkung von Edoxaban nicht zuverlässig an. Nur in speziellen Labors ist die direkte Bestimmung von Faktor Xa zum Nachweis einer Therapie mit Edoxaban oder einem anderen Faktor-Xa-Antagonisten möglich. Eine routinemäßige Kontrolle der Wirkung ist nicht notwendig. Die Standarddosierung ist einmal täglich 60 mg. Die Halbwertszeit von Edoxaban beträgt 9 bis 11 Stunden.[4]
Studien
[Bearbeiten | Quelltext bearbeiten]Der Hersteller führte zur Zulassung die ENGAGE AF-TIMI 48-Studie weltweit in 46 Ländern an 1393 Kliniken mit mehr als 21.000 Patienten mit Vorhofflimmern durch. Einschlusskriterium war ein CHADS2-Score von 2 oder höher mit Indikation zur medikamentösen Vorbeugung eines Schlaganfalls.
In dieser Studie zeigten sich eine geringfügig bessere Wirkung von Edoxaban bei der Verhinderung von Schlaganfällen und zusätzlich ein deutlich geringeres Risiko unerwünschter Blutungskomplikationen, was typisch für die neuen oralen Antikoagulanzien ist.[5] Die Wahrscheinlichkeit einer Blutung im Augeninneren (intraokular) war nach einer 2019 erschienenen Meta-Analyse geringer als unter anderen NOAK und als unter Warfarin.[6]
Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Vor Operationen, vor allem solchen mit erhöhtem oder nicht tragbarem Blutungsrisiko, wie auch vor rückenmarksnahen Regionalanästhesien sollte Edoxaban ausreichend lange (zwei bis fünf Halbwertszeiten) pausiert werden, wenn dies vertretbar ist. Keine Zulassung für das Stadium V der Niereninsuffizienz mit einer glomerulären Filtrationsrate unter 15 ml/min. Verbot bei Schwangerschaft und Stillzeit.
Die Dosis sollte reduziert werden bei eingeschränkter Nierenfunktion (mit einer Kreatinin-Clearance von 15 bis 50 ml/min), bei geringem Körpergewicht (≤ 60 kg) und/oder während der Einnahme von P-gp-Hemmern (Dronedaron, Erythromycin, Ketoconazol, Ciclosporin).
Frühe Nutzenbewertung
[Bearbeiten | Quelltext bearbeiten]In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
In einem solchen Verfahren wurde 2015 Edoxaban in zwei Indikationen bewertet: erstens zur Prophylaxe von Schlaganfällen und systemischen Embolien bei erwachsenen Patienten mit nicht-valvulärem Vorhofflimmern und mindestens einem Risikofaktor wie kongestiver Herzinsuffizienz, Hypertonie, Alter ≥ 75 Jahren, Diabetes mellitus, Schlaganfall oder transitorischer ischämischer Attacke (TIA) in der Anamnese und zweitens zur Behandlung von tiefen Venenthrombosen und Lungenembolien sowie zur Prophylaxe von entsprechenden Rezidiven bei Erwachsenen.[7] Gemäß G-BA-Beschluss gibt es für die erstgenannte Patientengruppe einen Hinweis auf einen geringen Zusatznutzen gegenüber Vitamin-K-Antagonisten als zweckmäßiger Vergleichstherapie. Für die zweitgenannte Gruppe ist gegenüber derselben zweckmäßigen Vergleichstherapie ein Zusatznutzen nicht belegt.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Vorhofflimmern: Edoxaban neue Alternative zu Warfarin. In: aerzteblatt.de, 20. November 2013.
- ↑ Henri Bounameaux, A. John Camm: Edoxaban: An Update on the New Oral Direct Factor Xa Inhibitor. In: Drugs, 74, 2014, S. 1209; doi:10.1007/s40265-014-0261-1.
- ↑ a b Gerinnungshemmung: Edoxaban hemmt Faktor Xa. Pharmazeutische Zeitung online; abgerufen am 24. Februar 2017
- ↑ Edoxaban versus Warfarin in Patients with Atrial Fibrillation. In: The New England Journal of Medicine; doi:10.1056/NEJMoa1310907.
- ↑ K Phan et al.: Intraocular bleeding in patients managed with novel oral anticoagulation and traditional anticoagulation: a network meta-analysis and systematic review. In: Br J Ophthalmol, 2019, 103, S. 641–647.
- ↑ A15-29 Edoxaban - Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 20. April 2020.
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Edoxaban (Prophylaxe von thromboembolischen Ereignissen). g-ba.de; abgerufen am 20. April 2020.