Enoxaparin-Natrium
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
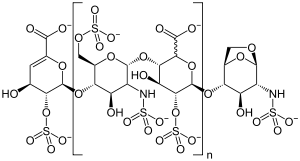
| Möglicher Strukturausschnitt von Enoxaparin-Natrium | |||||||||
| Allgemeines | |||||||||
| Name | Enoxaparin-Natrium | ||||||||
| CAS-Nummer | 679809-58-6 | ||||||||
| Monomere/Teilstrukturen | glykosidisch verknüpfte Glucosamin- und Uronsäurebausteine | ||||||||
| PubChem | 772 | ||||||||
| ATC-Code | |||||||||
| DrugBank | DB01225 | ||||||||
| Kurzbeschreibung |
kristalliner Feststoff[1] | ||||||||
| Arzneistoffangaben | |||||||||
| Wirkstoffklasse | |||||||||
| Eigenschaften | |||||||||
| Schmelzpunkt | |||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Enoxaparin-Natrium ist ein Arzneistoff zur Hemmung der Blutgerinnung.
Chemischer Aufbau
[Bearbeiten | Quelltext bearbeiten]Enoxaparin-Natrium zählt zu den niedermolekularen Heparinen, das heißt, es weist gleiche Strukturelemente wie unfraktioniertes Standardheparin auf,[2] hat aber eine geringere durchschnittliche Molekülgröße als dieses. Enoxaparin ist ein komplexes Gemisch von Oligosacchariden, deren Ketten aus Glucosamin- und Uronsäurebausteinen aufgebaut sind, die glykosidisch miteinander verknüpft sind. Die Molekülketten bestehen aus vier bis 24 Monomeren. Die meisten Ketten besitzen eine 4-Enopyranoseuronat-Struktur am nicht reduzierenden Ende. 15 bis 25 Prozent der Komponenten haben eine 1,6-Anhydro-Struktur am reduzierenden Kettenende.
Die Spezifikation des Europäischen Arzneibuchs definiert einen Sulfatierungsgrad von circa 2 pro Disaccharideinheit sowie eine mittlere relative Molekülmasse im Bereich von 3800 bis 5000, wobei der charakteristische Wert etwa 4500 beträgt. Der Natriumgehalt beträgt 11,3 bis 13,5 Prozent, bezogen auf die getrocknete Substanz.[3]
Klinische Angaben
[Bearbeiten | Quelltext bearbeiten]Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Enoxaparin-Natrium hemmt den gerinnungsfördernden Faktor Xa. Es wird zur Behandlung wie auch zur Prophylaxe[4] von Thrombosen (Blutgerinnsel) eingesetzt.[5] Es eignet sich zur Primärprophylaxe tiefer Venenthrombosen bei chirurgischen[6] und nichtchirurgischen Patienten mit einem Risiko für thromboembolische Ereignisse, zur Thromboseprophylaxe und Gerinnungshemmung bei extrakorporalem Kreislauf während der Hämodialyse, zur Therapie der tiefen Venenthrombosen mit und ohne Lungenembolie. Weiters stellen niedermolekulare Heparine (NMH) eine Alternative zu unfraktioniertem Heparin (UFH) in der Behandlung der instabilen Angina Pectoris und des Non-Q-Wave-Myokardinfarktes (UA/NQMI) dar. Bei Patienten mit instabiler Angina Pectoris oder einem Myokardinfarkt ohne ST-Hebung verringert Enoxaparin die Häufigkeit klinischer Ereignisse in der Akutphase der Behandlung um 20 %.[7][8][9]
Enoxaparin ist für folgende Anwendungsgebiete zugelassen:
- alle Stärken: Thromboseprophylaxe und Gerinnungshemmung bei extrakorporalem Kreislauf während der Hämodialyse.
- 20 mg / Tag: Primärprophylaxe tiefer Venenthrombosen: peri- und postoperativ bei Patienten mit niedrigem oder mittlerem thromboembolischen Risiko (z. B. Allgemeinchirurgie).
- 40 mg / Tag: Primärprophylaxe tiefer Venenthrombosen: peri- und postoperativ bei Patienten mit hohem thromboembolischen Risiko (z. B. in der orthopädischen Chirurgie), Primärprophylaxe tiefer Venenthrombosen bei nicht-chirurgischen Patienten mit mittlerem oder hohem thromboembolischem Risiko bei akuten schweren internistischen Erkrankungen (Herzinsuffizienz NYHA III bzw. IV, Infektionen, respiratorische Erkrankungen) mit weitgehender Immobilisation.
- 60 – 100 mg / Tag: Therapie tiefer Venenthrombosen mit und ohne Lungenembolie, Therapie der instabilen Angina Pectoris und des Nicht-ST-Hebungs-Myokardinfarktes, Therapie des akuten ST-Hebungs-Myokardinfarktes (STEMI), konservativ oder mit nachfolgender PCI (Percutaneous coronary intervention).[10]
Art der Anwendung
[Bearbeiten | Quelltext bearbeiten]Enoxaparin wird unter die Haut, am häufigsten unter die Bauchhaut, gespritzt. Es ist für die subkutane Injektion vorgesehen und darf nicht intramuskulär verabreicht werden.[10] Patienten mit Niereninsuffizienz können mit einer entsprechenden Dosisreduktion überbrückend mit Enoxaparin antikoaguliert werden.[11]
Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Enoxaparin-Natrium darf nicht angewendet werden bei einer Überempfindlichkeit gegenüber Enoxaparin oder anderen niedermolekularen Heparinen, ferner nicht bei kürzlich zurückliegenden Blutungen (z. B. durch Verletzungen oder Operationen, klinisch relevanter gastrointestinaler oder urogenitaler Blutung, hämorrhagischen Schlaganfall oder andere intrakranielle Blutungen). Eine Anwendung ist auch nicht erlaubt bei klinisch relevanten Gerinnungsstörungen, Magen- oder Darmulzera, Abortus imminens, schweren Leber- oder Pankreaserkrankungen, unkontrollierbarer schwerer Hypertonie oder Endokarditis.
Gewinnung und Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Als niedermolekulares Heparin wird Enoxaparin durch die chemische Depolymerisation von porcinem intestinalem Heparin hergestellt. Der Verarbeitungsprozess (Extraktion, Fraktionierung) dieses Ausgangsmaterials biologischen Ursprungs legt die Eigenschaften des Wirkstoffs fest.[12][13]
Enoxaparin-Natrium, das als Referenz für neue Mittel in diesem Bereich gilt, hat ein charakteristisches und reproduzierbares Oligosaccharidprofil, das für die spezifischen pharmakologischen Eigenschaften verantwortlich ist: So weist Enoxaparin-Natrium eine höhere und gleichmäßigere Bioverfügbarkeit nach subkutaner Verabreichung auf als unfraktioniertes Heparin, hat eine längere Plasmahalbwertszeit und ist weniger stark an Plasmaproteine gebunden.[14]
Seit 2017 sind Biosimilars zu Enoxaparin-Natrium auf dem Markt.[15]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Handelsnamen: Clexane, Lovenox (Hersteller: Sanofi) u. a.
Biosimilars: Enoxaparin Ledraxen (Hersteller: Venipharm)[16], Hepaxane (Hersteller: ITF Pharma), Enoxaparin BECAT[17][18] (Hersteller: Rovi), Inhixa (Hersteller: Techdow), Thorinane (Hersteller: Pharmathen)
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]- Enoxaparin Injection MedlinePlus
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag Enoxaparin Sodium CRS beim Europäisches Direktorat für die Qualität von Arzneimitteln (EDQM), abgerufen am 4. November 2018.
- ↑ Eintrag zu Enoxaparin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ Europäisches Arzneibuch 8. Ausgabe, 1. Nachtrag (2014), Seite 5427.
- ↑ Meyer Michel Samama et al.: A Comparison of Enoxaparin with Placebo for the Prevention of Venous Thromboembolism in Acutely Ill Medical Patients. In: The New England Journal of Medicine, 341, 1999, S. 793–800. doi:10.1056/NEJM199909093411103
- ↑ Clexane 20 mg/40 mg ( vom 17. Februar 2015 im Internet Archive) (PDF; 77 kB) und Clexane Multidose 20/40/60/80/100/500/1000 mg (PDF; 109 kB) Fachinformation: Zusammenfassung der Merkmale des Arzneimittels. Abgerufen am 20. Dezember 2017.
- ↑ Afshin Assadian: Enoxaparin in der Gefäßchirurgie. ( vom 21. Februar 2014 im Internet Archive) Springer Verlag, 2009.
- ↑ Antman EM, Cohen M, McCabe C, Goodman SG, Murphy SA, Braunwald E: Enoxaparin is superior to unfractionated heparin for preventing clinical events at 1-year follow-up of TIMI 11B and ESSENCE. In: European Heart Journal. 23. Jahrgang, Nr. 4, Februar 2002, S. 308–314, doi:10.1053/euhj.2001.2779, PMID 11812067.
- ↑ Zulassung für Clexane® (Enoxaparin-Natrium) um ST-Hebungs-Myokardinfarkt erweitert. (PDF) sanofi-aventis.de, 24. September 2007, archiviert vom am 17. November 2008; abgerufen am 19. Juli 2012.
- ↑ H. Darius, K. Hester, G.-J. Sanderink, W. D. Paar, Antithrombotische Therapie mit niedermolekularen Heparinen bei Niereninsuffizienz, Austrian Journal of Cardiology, 2004.
- ↑ a b Kurzcharakteristik von Clexane ( vom 5. November 2013 im Internet Archive).
- ↑ Heyder Omran et al.: Perioperative überbrückende Antikoagulation mit Enoxaparin. In: Medizinische Klinik, Volume 102, Number 10, 2007, S. 809–815, doi:10.1007/s00063-007-1098-0.
- ↑ EMA (Hrsg.): Guideline on Non-Clinical and Clinical Development of Similar Biological Medicinal Products Containing Low-Molecular-Weight-Heparins. 10. November 2016 (europa.eu [PDF; 64 kB; abgerufen am 4. November 2018]).
- ↑ C. Houiste et al.: Quantitative PCR and Disaccharide Profiling to Characterize the Animal Origin of Low-Molecular-Weight Heparins. In: Clinical and applied thrombosis/hemostasis. Band 15, Nummer 1, Februar 2009, S. 50–58, doi:10.1177/1076029608320831, PMID 18805847.
- ↑ J. Fareed, D. Hoppensteadt, J. Walenga, O. Iqbal, Q. Ma, W. Jeske, T. Sheikh: Pharmacodynamic and pharmacokinetic properties of enoxaparin : implications for clinical practice. In: Clinical Pharmacokinetics. Band 42, Nummer 12, 2003, S. 1043–1057, doi:10.2165/00003088-200342120-00003, PMID 12959635 (Review).
- ↑ aerztezeitung.de: Enoxaparin-Biosimilar erweitert Therapieoptionen, 20. Oktober 2017, abgerufen am 4. November 2018.
- ↑ Enoxaparin: Enoxaparin Ledraxen® - Venipharm GmbH. Abgerufen am 7. September 2021.
- ↑ Enoxaparin Biosimilar made in Europe, PM auf journalonko, abgerufen am 14. November 2018
- ↑ Enoxaparinbecat.de, Website des Herstellers, abgerufen am 14. November 2018
