Ethylenoxid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
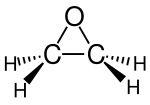
| ||||||||||||||||
| Keile zur Verdeutlichung der Geometrie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ethylenoxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2H4O | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit süßlich-etherischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 44,05 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
1,965 kg·m−3 (0 °C, 1013 hPa)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
10,5 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,3597 (7 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
| |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−78,0 kJ/mol (l) | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Ethylenoxid (kurz EO) ist ein farbloses, hochentzündliches Gas mit süßlichem Geruch und das einfachste Epoxid. Es ist ein wichtiges Zwischenprodukt bei der Herstellung von Ethylenglycol und anderen Chemikalien. Ethylenoxid wird als Desinfektionsmittel für Nahrungsmittel, organische Dämmstoffe (Wolle, Pflanzenfasern), Textilfasern und medizinische Geräte verwendet.
Als mutagenes Klastogen ist Ethylenoxid ein Gift, welches Chromosomenaberrationen hervorrufen kann. Ihm ist die UN-Nummer 1040 zugewiesen.
Nach IUPAC-Nomenklatur wird Ethylenoxid als Oxiran bezeichnet, dessen Name sich aus dem Hantzsch-Widman-System ableitet.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Ethylenoxid wurde erstmals 1859 durch Charles Adolphe Wurtz hergestellt, er behandelte dazu 2-Chlorethanol mit einer Base.
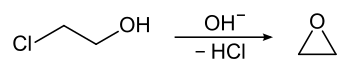
Im Ersten Weltkrieg erlangte Ethylenoxid industrielle Bedeutung als Ausgangsprodukt für das Kühlmittel Ethylenglycol. Da mit Ethylenoxid die chemische Waffe Senfgas (Lost) hergestellt werden kann, fällt es unter das Außenwirtschaftsgesetz.[6]
1931 entdeckte der französische Chemiker Theodore Lefort die Herstellung von Ethylenoxid direkt aus Ethen und Sauerstoff mit Silber als Katalysator.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Historisches Verfahren
[Bearbeiten | Quelltext bearbeiten]Ethylenoxid wurde erstmals 1925 von der Firma Union Carbide Chemicals nach dem Chlorhydrinverfahren hergestellt. Hierzu wurde Ethylen zunächst mit Chlor in alkalischer wässriger Lösung zu Ethylenchlorhydrin umgesetzt, das anschließend mit Calciumhydroxid zu Ethylenoxid reagierte. Nachteile des Verfahrens waren eine beträchtliche Abwasserbelastung mit Chloriden und die Bildung von Halogenkohlenwasserstoffen (z. B. 1,2-Dichlorethan) als Nebenprodukte. Die erste katalytische Direktoxidation von Ethylen zu Ethylenoxid wurde in den 1930er Jahren ebenfalls von der Union Carbide technisch eingeführt.
Industrielle Synthese
[Bearbeiten | Quelltext bearbeiten]Die großtechnische Herstellung von Ethylenoxid erfolgt heute ausschließlich durch die katalytische Oxidation von Ethen mit Sauerstoff bei Temperaturen von 230–270 °C und Drücken von 10–20 bar. Als Katalysator wird fein verteiltes Silberpulver, welches auf einem anorganischen, oxidhaltigen Träger (bevorzugt Aluminiumoxid) aufgebracht ist, eingesetzt.[7]
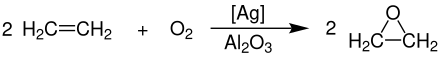
Die komplette Reaktion wird dabei in einem Rohrbündelreaktor, bei dem die beträchtliche Reaktionsenthalpie (ΔHR= −119,7 kJ·mol−1 der Haupt- und ΔHR= −1324 kJ·mol−1 der Nebenreaktion) mithilfe von Salzschmelzen abgeführt und zur Erzeugung von überhitztem Hochdruckdampf genutzt wird, durchgeführt. Der Katalysator ist bei diesem Verfahren als Festbett angeordnet. Die Ausbeute an reinem Ethylenoxid liegt bei 85 %. Als Nebenreaktion tritt die vollständige Oxidation des Ethens zu Kohlenstoffdioxid und Wasser auf.[7]
Im Jahr 2010 wurden weltweit etwa 21 Millionen Tonnen an Ethylenoxid verbraucht.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ethylenoxid ist ein hochentzündliches Gas. Der Flammpunkt beträgt −57 °C[1] und die Zündtemperatur liegt bei 435 °C.[1] Es bildet mit Luft explosionsfähige Gemische, die untere Explosionsgrenze (UEG) liegt bei 2,6 %, die obere (OEG) bei 100 %.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Als Rohstoff
[Bearbeiten | Quelltext bearbeiten]Der größte Anteil des produzierten Ethylenoxids dient als Zwischenprodukt bei der Herstellung anderer Chemikalien. Ein Großteil des Ethylenoxids wird für die Produktion von Ethylenglycol eingesetzt, heute durch den OMEGA-Prozess. Weiter wird es für die Herstellung von Polyestern (beispielsweise PET) oder Hydroxyethylcellulose (HEC) benötigt. Ethylenoxid kann zu – ungiftigem und gut wasserlöslichem – Polyethylenglycol (auch Polyethylenoxid) polymerisieren. Es ist ebenfalls wichtig für die Herstellung von Tensiden (siehe Nichtionische Tenside), z. B. Polyalkylenglycolether. Eine Kategorie von Ethylenoxidderivaten, die große wissenschaftliche Aufmerksamkeit erregt hat, sind die Kronenether, die als zyklische Oligomere des Ethylenoxids angesehen werden können. Diese Verbindungen haben die Fähigkeit, ionische Substanzen in unpolaren Lösungsmitteln löslich zu machen, in denen sie sonst unlöslich sind. Aufgrund hoher Kosten bleibt die Verwendung dieser Substanzen auf Laboranwendungen begrenzt.
Sterilisation
[Bearbeiten | Quelltext bearbeiten]Die Sterilisation mit Ethylenoxid ist heute ein weit verbreitetes Verfahren in der industriellen Herstellung von Medizinprodukten, insbesondere von Einmalprodukten wie Verbandstoffen, Nahtmaterial oder Spritzen und Kathetern, aber auch von chirurgischen Instrumenten und empfindlichen Medizinprodukten (z. B. Cochleaimplantaten). Das Verfahren ist hochgradig standardisiert (u. a. ISO 11135, ISO 10993-7, EN 1422). Die Behandlung von Wattestäbchen mit Ethylenoxidgas kann DNS-Spuren so zersetzen, dass sie mit forensischen Methoden nicht mehr nachweisbar sind.[8] Etwa 2 % der Weltproduktion wird für die Sterilisation mit gasförmigem EO verwendet.
Als Brennstoff
[Bearbeiten | Quelltext bearbeiten]Im militärischen Bereich wird Ethylenoxid als Brennstoff in Aerosol-Kleinbomben, die z. B. in Streubomben des Typs CBU-55 enthalten sind, verwendet.[9]
Als Pestizid, Biozid und im Vorratsschutz
[Bearbeiten | Quelltext bearbeiten]Ethylenoxidgas tötet Bakterien, Viren und Pilze ab, daher kann es zur Begasung von hitzeempfindlichen Substanzen verwendet werden. Die Sterilisation von Gewürzen mit EO wurde 1938 durch den amerikanischen Chemiker Lloyd Hall patentiert und wird auch heute noch in einigen Ländern praktiziert. Ethylenoxid wurde zusammen mit einem höheren Anteil Kohlendioxid (um die Brennbarkeit herabzusetzen) unter den Handelsnamen Cartox und T-Gas als Begasungsmittel von z. B. Silos, Lagerräumen und Containern verwendet.
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Ethylenoxid ist giftig und krebserregend. Symptome einer Vergiftung sind Kopfschmerzen, Schwindel und Übelkeit/Erbrechen. Mit zunehmender Dosis kommt es zu Zuckungen, Krämpfen und schlussendlich zum Koma. Es ist für die Haut und die Atemwege reizend. Die Lunge kann sich Stunden nach dem Einatmen mit Flüssigkeit füllen (Lungenödem).[1]
Ethylenoxid wird normalerweise druckverflüssigt in Kombination mit 10 % Kohlenstoffdioxid gelagert. Bei Normaldruck und Zimmertemperatur verdunstet es sehr schnell und verursacht Frostverbrennungen auf der Haut.
Bei Tieren hat es zahlreiche Fortpflanzungsdefekte wie Mutationen oder Fehlgeburten ausgelöst. Der Einfluss auf die menschliche Fortpflanzung ist noch nicht genau untersucht, es ist aber wahrscheinlich, dass die gleichen Effekte wie im Tierversuch auftreten.[1]
Die Verbindung zählt daher zu den CMR-Stoffen.
Gesetzliche Regelungen
[Bearbeiten | Quelltext bearbeiten]In Deutschland ist der Einsatz von Ethylenoxid als Pflanzenschutzmittel durch die Pflanzenschutz-Anwendungsverordnung seit 1981 verboten,[10][11] da hierbei giftiges 2-Chlorethanol entstehen kann. In der gesamten EU ist die Verwendung von Ethylenoxid als Pflanzenschutzmittel durch Inkrafttreten der Verordnung (EWG) Nr. 414/91 seit 1991 nicht mehr erlaubt.[12][11] In der EU wurde Ethylenoxid als Biozid, zur Verwendung als Schutz von Lebens- und Futtermitteln, 2011 verboten. Die Verwendung von Ethylenoxid in Kosmetik ist in der EU bereits seit 1976 verboten.[13]
In der EU liegen die Höchstwerte für Ethylenoxidrückstände in Lebensmitteln je nach Produkt zwischen 0,02 und 0,1 mg/kg was der jeweiligen unteren analytischen Nachweisgrenze entspricht.[14] Durch die Verordnung (EU) Nr. 231/2012, welche die Spezifikationen für die in der EU zugelassenen Lebensmittelzusatzstoffe enthält, wird festgelegt, dass Ethylenoxid nicht zur Sterilisierung von Lebensmittelzusatzstoffen verwendet werden darf und dass in polyoxyetheylenhaltigen synthetischen Zusatzstoffen ein Ethylenoxidgehalt von 0,2 mg/kg nicht überschritten werden darf. 2020 und 2021 gab es in der EU und der Schweiz zahlreiche Meldungen und Rückrufe für verschiedene importierte Produkte, wie etwa Bio-Sesamsaat und -produkte, den Verdickungsmitteln Guarkernmehl (E412) und Johannisbrotkernmehl (E410), Nahrungsergänzungsmitteln oder (Bio-)Ingwerpulver, bei denen der zulässige Höchstwert um ein Vielfaches überschritten wurde.[15][16][17][18][19] Dabei ist der Rückruf bei Johannisbrotkernmehlprodukten (z. B. Speiseeis) in Ländern wie Frankreich deutlich zahlreicher als in Deutschland.[20]
Ethylenoxid wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Ethylenoxid waren die Besorgnisse bezüglich der Einstufung als CMR-Stoff, hoher (aggregierter) Tonnage. Die Neubewertung fand ab 2012 statt und wurde von Österreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[21][22] Im Rahmen der CLP-Verordnung wurde mit der Verordnung (EU) 2020/217, der 14. Anpassungen an den technischen und wissenschaftlichen Fortschritt (14. ATP) eine harmonisierte Einstufung für die EU festgelegt, die zum 1. Oktober 2021 in Kraft trat.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Ethylenimin (Aziridin), das stickstoffhaltige Analogon
- Thiiran (Ethylensulfid), das schwefelhaltige Analogon
Literatur
[Bearbeiten | Quelltext bearbeiten]- Wolfgang Swodenk, Helmut Waldmann: Moderne Verfahren der Großchemie: Ethylenoxid und Propylenoxid. In: Chemie in unserer Zeit. 12. Jg., Nr. 3, 1978, S. 65–70. doi:10.1002/ciuz.19780120302.
- Berufsgenossenschaft Rohstoffe und chemische Industrie, Merkblatt R 009 Reaktionen mit Ethylenoxid und andere Alkoxylierungen, Ausgabe 04/2022, PDF-Download.
- Gesundheitliche Bewertung von Ethylenoxid-Rückständen in Sesamsamen. (pdf) Aktualisierte Stellungnahme Nr. 024/2021 des BfR vom 1. September 2021. In: www.bfr.bund.de. Bundesinstituit für Risikobewertung, 1. September 2021 (doi:10.17590/20201223-111442).
- Gesundheitsrisiko von Ethylenoxid in Lebensmitteln. (pdf) Fragen und Antworten des BfR vom 2. Juni 2022.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n o p q r s Eintrag zu Ethylenoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-408.
- ↑ Eintrag zu Ethylene oxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 19. Dezember 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-21-8 bzw. Ethylenoxid), abgerufen am 13. September 2019.
- ↑ CRC-Handbook 90. Aufl. (2009–2010), S. 5–22 ( vom 26. April 2015 im Internet Archive). – siehe auch Eintrag zu Ethylenoxid. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 22. März 2010..
- ↑ Außenwirtschaftsgesetz ( vom 6. Juni 2014 im Internet Archive) (PDF; 1,3 MB) in der Fassung der Bekanntmachung vom 27. Mai 2009 (BGBl. I S. 1150), das durch Artikel 1 der Verordnung vom 12. Dezember 2012 (BAnz. 2012) geändert worden ist. S. 200.
- ↑ a b c Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2013, ISBN 978-3-527-33072-0, S. 16 f., 592.
- ↑ Jens Lubbadeh: Forensische DNA-Analyse – Schwachstelle Wattestäbchen, Meldung vom 26. März 2009 in Spiegel Online Wissenschaft.
- ↑ BAK to BSU/BSG – Equipment Listing Designation-Systems.net, Zugriff am 30. Mai 2013.
- ↑ Verordnung über Anwendungsverbote und -beschränkungen für Pflanzenbehandlungsmittel (Pflanzenschutz-Anwendungsverordnung) in BGBl. 1980 I S. 2335
- ↑ a b Rückrufe: Sesam und Ethylenoxid. Verbraucherzentrale Nordrhein-Westfalen, 10. Mai 2021, abgerufen am 1. Juni 2021.
- ↑ EU Pesticides Database (v.2.1) Active substance - Ethylen oxide. In: ec.europa.eu. 1. Juli 2013, abgerufen am 16. Dezember 2020 (englisch).
- ↑ Richtlinie 76/768/EWG des Rates vom 27. Juli 1976 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über kosmetische Mittel, ersetzt durch Verordnung (EG) Nr. 1223/2009 des Europäischen Parlaments und des Rates vom 30. November 2009 über kosmetische Mittel
- ↑ Verordnung (EU) 2015/868 vom 26. Mai 2015 zur Änderung der Anhänge II, III und V der Verordnung (EG) Nr. 396/2005 des Europäischen Parlaments und des Rates hinsichtlich der Höchstgehalte an Rückständen von 2,4,5-T, Barban, Binapacryl, Bromophos-ethyl, Camphechlor (Toxaphen), Chlorbufam, Chloroxuron, Chlozolinat, DNOC, Diallat, Dinoseb, Dinoterb, Dioxathion, Ethylenoxid, Fentinacetat, Fentinhydroxid, Flucycloxuron, Flucythrinat, Formothion, Mecarbam, Methacrifos, Monolinuron, Phenothrin, Propham, Pyrazophos, Quinalphos, Resmethrin, Tecnazen und Vinclozolin in oder auf bestimmten Erzeugnissen
- ↑ Ethylenoxid in Sesamsamen aus Indien: Rückzüge und Rückrufe von Produkten. In: swissdocu.ch. 6. Dezember 2020, abgerufen am 1. Juni 2021.
- ↑ Giftiger Import-Sesam: Probleme im Schweizer Kontrollsystem. Kassensturz (Fernsehsendung), 1. Juni 2021, abgerufen am 1. Juni 2021.
- ↑ Notification 2021.2013 Ethylenoxid in Guarkernmehl aus Indien /// Ethylene oxide in guarflour from India. In: RASFF WINDOW. Abgerufen am 21. August 2021.
- ↑ Notification 2021.4399 Ethylene oxide (sum of ethylene oxide and 2-chloroethanol, expressed as ethylene oxide) in food supplements from the United States. In: RASFF WINDOW. Abgerufen am 21. August 2021.
- ↑ Notification 2021.4293 Ethylene oxide in organic ginger powder. In: RASFF WINDOW. Abgerufen am 21. August 2021.
- ↑ Hohe Dunkelziffer bei Ethylenoxid in Lebensmitteln. In: foodwatch.org. 22. September 2021, abgerufen am 18. Dezember 2021.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Report und Conclusion Document.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Ethylene oxide, abgerufen am 26. März 2019.




