Glycolnitril
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glycolnitril | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H3NO | ||||||||||||||||||
| Kurzbeschreibung |
farblose ölige Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 57,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,10 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
sehr gut löslich in Wasser, Ethanol und Diethylether, unlöslich in Benzol[2] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Glycolnitril (Hydroxyacetonitril) ist ein sehr gut wasserlösliches α-Hydroxynitril und das einfachste Cyanhydrin, das durch Addition von Cyanwasserstoff an Formaldehyd entsteht.
Da Glycolnitril leicht in die giftigen Ausgangsverbindungen zerfällt und im Alkalischen polymerisiert,[6] wird Hydroxyacetonitril in sauren wässriger Lösungen (ca. 50 bis 70%ig) gehandelt.[7]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Die Bildung von Glycolnitril aus Formaldehyd und Cyanwasserstoff wurde bereits 1890 in der Literatur erwähnt:[8]

Die wahrscheinliche Existenz beider Reaktanden während der präbiotischen Phase der Erdgeschichte legt die spontane Bildung von Glycolnitril (und Folgeprodukten) in einem frühen Stadium der Geochemie nahe.[9]
Glycolnitril entsteht als erste Stufe der Biotransformation von Acetonitril durch eine NADPH-abhängige Cytochrom P450 Monooxygenase in menschlichen und tierischen Zellen.[10]
Nach einer Laborvorschrift kann Glycolnitril durch Reaktion äquimolarer Mengen Kaliumcyanid und Formaldehyd in wässriger Lösung nach Zugabe von verdünnter Schwefelsäure zur Freisetzung von Blausäure nach intensiver Extraktion mit Diethylether und anschließender Vakuumdestillation in 76–80 %iger Ausbeute erhalten werden.[11] Die Laborvorschrift basiert auf einen frühen Veröffentlichung,[3] in der diese Reaktion bereits beschrieben und das Produkt Glycolnitril nach Destillation in 88%iger Ausbeute erhalten wurde.
Bereits in der älteren Literatur[12] wird auf die Instabilität des Glycolnitrils und seine Neigung zu spontaner heftigen Zersetzung bzw. Polymerisation bei thermischer Belastung und höheren pH-Werten hingewiesen, und die Zugabe von Säuren bei Aufarbeitung und Lagerung empfohlen.
Um die Bildung von Nebenprodukten zu unterdrücken, werden in technischen Prozessen äquimolare Mengen gereinigter Formaldehyd als 37%ige Formalin-Lösung und ammoniakfreier Cyanwasserstoff bei 30 °C und pH 5,5 zur Reaktion gebracht und das erhaltene Glycolnitril durch Ansäuern auf pH 2 stabilisiert.[13]
In einem kontinuierlichen Verfahren werden die Reaktanden NH3 und (HCN + HCHO) im Verhältnis 3:1 in einem Rohrreaktor bei ca. 150 °C und einer Verweilzeit von ca. 15 Sekunden umgesetzt, wobei fast vollständige Reaktion zu Glycolnitril erfolgt. Als Nebenprodukt fällt durch zweimalige Substitution der Wasserstoffatome des Ammoniaks Iminodiacetonitril (IDAN) HN(CH2CN)2 an.[14]
Besonders reines (formaldehydfreies) Glycolnitril wird erhalten, wenn die in Formalinlösung vorhandenen Oligomeren und Polymeren des Formaldehyds vor der Reaktion mit HCN durch Erhitzen auf 120 °C depolymerisiert werden. Die Reaktion liefert bei kontinuierlichem Zudosieren der Reaktanden bei 20 °C Glycolnitril in Ausbeuten bis 95 % und Reinheiten bis 99,9 %.[15]
Die Herstellung von Glycolnitril durch Oxidation von Acetonitril mit Sauerstoff in der Dampfphase an Metallkatalysatoren ist wegen geringer Selektivitäten und Ausbeuten uninteressant.[16]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Glycolnitril ist eine klare, farblose, ölige und giftige Flüssigkeit, die leicht in die giftigen Ausgangsstoffe Formaldehyd und Cyanwasserstoff zerfällt und unter dem Einwirken von Alkalien explosionsartig polymerisieren kann.[1]
Anwendungen
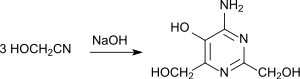
[Bearbeiten | Quelltext bearbeiten]Glycolnitril trimerisiert in verdünnter wässriger Lösung bei pH 8 und 0 °C in 47%iger Ausbeute zu 4-Amino-5-hydroxy-2,6-di(hydroxymethyl)-pyrimidin:[4][17]
Durch Umsetzung mit überschüssigem Ammoniak entsteht Aminoacetonitril,[18]
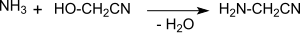
das durch alkalische[19] (neben Glycin entstehen andere α-Aminosäuren, wie z. B. Alanin oder Threonin) oder saure[20] Hydrolyse der Nitrilgruppe in die Aminosäure Glycin überführt wird.
Glycin ist auch direkt aus Glycolnitril durch Reaktion mit überschüssigem Ammoniak und Kohlendioxid in guter Ausbeute (ca. 85 %) und Reinheit (>98 %) unter Bildung des entsprechenden Hydantoins und direkt anschließender Spaltung in die Aminosäure zugänglich.[21]

bzw.

Das oft als Nebenprodukt des Glycolnitril-Synthese anfallende Iminodiacetonitril (IDAN) lässt sich gezielt durch Umsetzung von Glycolnitril mit Ammoniak bei pH 5 und 70 °C in Ausbeuten um 80 % durch Substitution von zwei Wasserstoffatomen des Ammoniaks durch zwei –CH2-CN-Gruppen herstellen.[13]
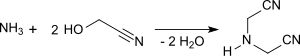
Die Synthese von Nitrilotriacetonitril (NTAN, durch Substitution sämtlicher Wasserstoffatome des Ammoniaks durch drei –CH2-CN-Gruppen) gemäß der Bruttoreaktionsgleichung
verläuft vermutlich über intermediär entstehendes Glycolnitril.[22] Dieser Reaktionsverlauf wurde bereits in einer frühen Publikation postuliert.[23]
Glycolsäure ist aus Glycolnitril über eine Nitrilase-katalysierte enzymatische Umsetzung zu Ammoniumglycolat, das mittels Elektrodialyse, Behandlung mit Ionenaustauschern, Reaktivextraktion, z. B. mit langkettigen (C8 – C10) Trialkylaminen, oder Veresterung mit Methanol zu Methylglycolat und anschließende Hydrolyse zugänglich.[24]

Glycolnitril (4 mol) reagiert mit Ethylendiamin (1 mol) in Gegenwart von Natronlauge zum Tetranatriumsalz der Ethylendiamintetraessigsäure (EDTA) – eines häufig verwendeten Komplexbildners.[25] Reaktionsbedingungen und Ausbeuten werden nicht angegeben.
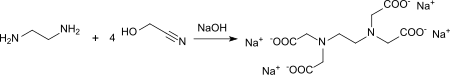
Die Reaktion von Glycolnitril (2 mol) mit Ethylendiamin (1 mol) bei 60 °C liefert Ethylendiamindiacetonitril (EDDN), das mit äquimolaren Mengen HCN und HCHO bei 60 °C Ethylendiamintetraacetonitril (EDTN) in 74%iger Ausbeute ergibt.[26]
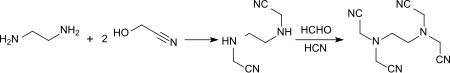
Durch Hydrolyse des Tetranitrils mit 40%iger Natronlauge wird analog das Tetranatriumsalz der Ethylendiamintetraessigsäure (EDTA) gebildet.
Mit Ethylendiamin oder substituierten Ethylendiaminen, wie z. B. 2-(2-Aminoethylamino)ethanol entstehen durch Reaktion mit Glycolnitril bei 100 °C 2-Piperazinone, die sich als Absorptionsmedium für Schwefeldioxid in Gaswäschern eignen.[27]
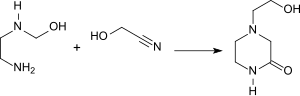
Der relativ gut bioabbaubare (80 % in 5 Tagen) Komplexbildner 2-Hydroxyethyliminodiessigsäure (HEIDA) ist durch zweimalige Reaktion von Glycolnitril mit 2-Aminoethanol zugänglich.[28]

Wegen seiner Instabilität wird Glycolnitril als Zwischenprodukt bei Reaktionen mit Cyanwasserstoff und Formaldehyd in der Regel nicht isoliert, sondern direkt zum gewünschten Endprodukt, z. B. Glycin, IDAN, NTAN oder EDTN verarbeitet.
Die Oligomerisierung von Glycolnitril zu Aminooxazolen wird als möglicher Bildungsweg von Heterocyclen in der frühen Erdgeschichte diskutiert.[29]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Formaldehyde Cyanohydrin bei Cameo Chemicals.
- ↑ a b c d Lide, DR (ed.), CRC Handbook of Chemistry and Physics, 79st Edition, CRC Press LLC, Boca Raton, FL 2000, p. 3–10
- ↑ a b K. Polstorff, H. Meyer: Über die Einwirkung von Cyankalium auf Formaldehyd. In: Ber. dtsch. chem. Ges. Band 45, Nr. 2, 1912, S. 1905–1912, doi:10.1002/cber.19120450263.
- ↑ a b c Patent US2723979: 4-Amino-5-hydroxy-2,6-di(hydroxymethyl)-pyrimidine and process of preparing same. Angemeldet am 2. August 1954, veröffentlicht am 15. November 1955, Anmelder: E.I. du Pont de Nemours and Company, Erfinder: D.B. Lake.
- ↑ a b Eintrag zu Glykolonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Richard J. Lewis, Sr., Hazardous Chemicals Desk Reference, 6st Edition, John Wiley & Sons, Hoboken, NJ 2008, S. 749.
- ↑ Datenblatt Glycolsäurenitril-Lösung bei Sigma-Aldrich, abgerufen am 1. März 2016 (PDF).
- ↑ L. Henry: Sur le nitrile glycolique et la synthèse directe de l’acide glycolique. In: Comp. Rend. Band 110, 1890, S. 759–760.
- ↑ H.J. Cleaves II: The prebiotic geochemistry of formaldehyde. In: Precambrian Res. Band 164, 2008, S. 111–118, doi:10.1016/j.precamres.2008.04.002.
- ↑ International Programme on Chemical Safety: Environmental Health Criteria 154. Acetonitrile. Hrsg.: World Health Organization. Geneva 1993 (Online).
- ↑ R. Gaudry: Glycolonitrile. In: Org. Synth., Coll. Vol. Band 3, 1955, S. 436, doi:10.15227/orgsyn.027.0041.
- ↑ Patent US2175805: Stabilized organic nitrile and process of making. Angemeldet am 8. Juni 1937, veröffentlicht am 10. Oktober 1939, Anmelder: E.I. du Pont de Nemours & Company, Erfinder: R.A. Jacobson.
- ↑ a b Patent US5187301: Preparation of iminodiacetonitrile from glycolonitrile. Angemeldet am 11. Oktober 1990, veröffentlicht am 16. Februar 1993, Anmelder: W.R. Grace & Co., Erfinder: B.A. Cullen, B.A. Parker.
- ↑ Patent US5079380: Adiabatic process for the preparation of glycolonitrile. Angemeldet am 23. Mai 1990, veröffentlicht am 7. Januar 1992, Anmelder: W.R. Grace & Co., Erfinder: J.C. Thunberg.
- ↑ Patent EP1833784B1: Process for the synthesis of glycolonitrile. Angemeldet am 21. Dezember 2005, veröffentlicht am 20. Oktober 2010, Anmelder: E.I. du Pont de Nemours and Company, Erfinder: T. Foo, A. Panova.
- ↑ Patent US4515732: Conversion of acetonitrile to glycolonitrile and/or glycolamide. Angemeldet am 29. Mai 1984, veröffentlicht am 7. Mai 1985, Anmelder: The Standard Oil Company, Erfinder: J.F. Brazdil, Jr., W.A. Marritt, M.D. Ward.
- ↑ D.B. Lake, T.E. Londergan: The trimerization of glycolonitrile. In: J. Org. Chem. Band 19, Nr. 12, 1954, S. 2004–2007, doi:10.1021/jo01377a018.
- ↑ Patent DE677713: Verfahren zur Herstellung von Aminonitrilen. Angemeldet am 21. Januar 1937, veröffentlicht am 8. Juni 1939, Anmelder: Bergwerksverband zur Verwertung von Schutzrechten der Kohlentechnik in Dortmund-Eving, Erfinder: W. Klempt.
- ↑ R.E. Moser, C.N. Matthews: Hydrolysis of aminoacetonitrile: Peptide formation. In: Experientia. Band 24, Nr. 7, 1968, S. 658–659, doi:10.1007/BF02138294.
- ↑ W.K. Anslow, H. King: Glycine [(A) (from Methyleneaminoacetonitrile)]. In: Org. Synth. Band 4, 1925, S. 31, doi:10.15227/orgsyn.004.0031.
- ↑ Patent EP0441588B1: Process for preparing glycine. Angemeldet am 5. Februar 1991, veröffentlicht am 10. Mai 1995, Anmelder: Mitsui Toatsu Chemicals, Inc., Erfinder: K. Fujiwara, Y. Matsuu, N. Ueda, H. Kato, A. Hiai.
- ↑ Patent US5008428: Integrated process for the production of aminoacetonitriles. Angemeldet am 26. Oktober 1989, veröffentlicht am 16. April 1991, Anmelder: W.R. Grace & Co., Erfinder: M.B. Sherwin, J.-L. Su.
- ↑ H. Franzen: Über die Einwirkung von Formaldehyd auf Cyankalium. In: J. Prakt. Chem. Band 86, Nr. 1, 1912, S. 133–149, doi:10.1002/prac.19120860108.
- ↑ Patent US7445917B2: Process for producing glycolic acid from formaldehyde and hydrogen cyanide. Angemeldet am 21. Dezember 2005, veröffentlicht am 4. November 2008, Anmelder: E.I. du Pont de Nemours and Company, Erfinder: R. DiCosimo, A. Panova, J.S. Thompson, F.G. Gallagher, T. Foo, X. Li, G.C. Fox, J.J. Zaher, M.S. Payne, D.P O’Keefe.
- ↑ Patent US2890238: Preparation of glycolonitrile. Angemeldet am 31. Januar 1957, veröffentlicht am 9. Juni 1959, Anmelder: The Dow Chemical Company, Erfinder: A.R. Sexton.
- ↑ Patent US5208363: Preparation of aminoacetonitriles. Angemeldet am 5. Mai 1992, veröffentlicht am 4. Mai 1993, Anmelder: The Dow Chemical Company, Erfinder: D.K. Crump, D.A. Wilson.
- ↑ Patent US4980471: Preparation of piperazinones for use as sulfur dioxide absorbents. Angemeldet am 6. Oktober 1989, veröffentlicht am 25. Dezember 1990, Anmelder: The Dow Chemical Company, Erfinder: S.A. Christiansen, D.A. Wilson, D. Chang.
- ↑ Patent EP1004660B1: An amino nitrile intermediate for the preparation of 2-hydroxyethyl iminoacetic acid. Angemeldet am 31. Oktober 1996, veröffentlicht am 9. November 2005, Anmelder: Dow Global Technologies, Inc., Erfinder: P.S. Athey, D.K. Crump, D.A. Wilson.
- ↑ G. Arrhenius, K.K. Baldridge, S. Richards-Gross, J.S. Siegel: Glycolonitrile Oligomerization: Structure of Isolated Oxazolines, Potential Heterocycles on the Early Earth. In: J. Org. Chem. Band 62, Nr. 16, 1997, S. 5522–5525, doi:10.1021/jo962185r.

