Lopinavir
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
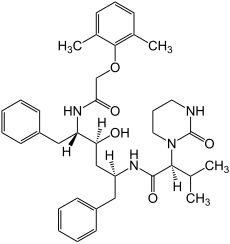
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Lopinavir | ||||||||||||||||||
| Andere Namen |
(2S)-N-[(2S,4S,5S)-5-{[(2,6-Dimethylphenoxy)acetyl]amino}-4-hydroxy-1,6-diphenyl-2-hexanyl]-3-methyl-2-(2-oxotetrahydro-1(2H)-pyrimidinyl)butanamid (IUPAC) | ||||||||||||||||||
| Summenformel | C37H48N4O5 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 628,81 g·mol−1 | ||||||||||||||||||
| Schmelzpunkt |
124–127 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Lopinavir (LPV/r) ist ein Arzneistoff, der als Proteaseinhibitor zur Behandlung einer HIV-Infektion zum Einsatz kommt. Dieser HIV-Proteaseinhibitor wird in Kombination mit Ritonavir vom Hersteller Abbott-AbbVie unter dem Handelsnamen Kaletra vertrieben.[1] Die Zulassung durch die EU-Kommission erfolgte im März 2001. Für den Markt in Drittweltstaaten wurde nach anfänglicher Weigerung der Hersteller die gleiche Wirkstoffkombination mit dem Namen Aluvia registriert. (Siehe Abbott – Kritik am Unternehmen)
Indikation
[Bearbeiten | Quelltext bearbeiten]Die Wirkstoffkombination von Kaletra ist sowohl bei Erwachsenen als auch bei Kindern über zwei Jahren zugelassen. Klinische Prüfungen ergaben eine höhere Wirksamkeit gegenüber den Vergleichssubstanzen Nelfinavir bzw. Indinavir.
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Der HIV-Protease-Inhibitor Lopinavir hemmt die Weiterverarbeitung der durch das HI-Virus neu gebildeten viralen Vorläuferproteine zu funktionstüchtigen Strukturproteinen und Enzymen und somit die Vermehrung des Virus.
Kombination mit Ritonavir
[Bearbeiten | Quelltext bearbeiten]Lopinavir wird im menschlichen Organismus durch das Cytochrom-P450-System sehr rasch metabolisiert. Die alleinige Gabe dieser Substanz hätte aufgrund der zu geringen erreichbaren Konzentration im Blutplasma keinen therapeutischen Effekt. Daher wird der Wirkstoff nur in fixer Kombination mit Ritonavir, einem Arzneistoff derselben Gruppe, verabreicht. Die Aufgabe dieses zweiten Protease-Inhibitors ist es, den Abbaumechanismus für Lopinavir, also die Cytochrom P450 Monooxygenasen zu blockieren.[1] Damit steht im Organismus ausreichende Konzentration von Lopinavir zur Verfügung, um eine effektive Hemmung der HIV-Proteasen zu bewirken. Der Nutzen dieser Strategie besteht in einer deutlichen Reduzierung der Dosis und somit der Tablettenanzahl für den Patienten.
Unerwünschte Wirkungen
[Bearbeiten | Quelltext bearbeiten]Entsprechend den Erfahrungen mit den anderen Vertretern der Protease-Inhibitoren treten auch bei der Therapie mit Lopinavir häufig gastrointestinale Störungen auf, wie Durchfall, Bauchschmerzen, abnormer Stuhl. Selten beobachtet man ZNS- oder Hautreaktionen sowie Pankreatitis und Rhabdomyolyse. Unter Umständen kann es zu erhöhten Laborwerten (Cholesterin und Triglyzeride) kommen.
Patienten mit einer strukturellen Herzerkrankung, Herz-Rhythmus-Störungen, einem minder durchblutetem Herz (Ischämie) oder Kardiomyopathies sollten Kaletra mit Vorsicht verwenden.[3]
Wechselwirkungen
[Bearbeiten | Quelltext bearbeiten]Bedingt durch den Wirkungsmechanismus und die dahinterliegende Strategie der Wirkstoffkombination von Kaletra kommt es zu vielen Beeinträchtigungen des Organismus und Interaktionen mit anderen Arzneistoffen. Die Hemmung der Enzyme des Cytochrom-P450-Systems in der Leber führt nicht nur zu einer Erhöhung der Konzentration der Protease-Inhibitoren im Organismus, sondern zwangsläufig auch zu einer größeren Bioverfügbarkeit und damit stärkerer Wirkung anderer Arzneistoffe, die über den gleichen Mechanismus eliminiert werden (z. B. Benzodiazepine, Antiarrhythmika, Mutterkornalkaloide). Außerdem kann dieses Enzymsystem durch verschiedenste Einflüsse in seiner Wirkung gehemmt oder gefördert werden, ist auch nicht bei jedem Menschen in gleichem Maße aktiv sowie höchstwahrscheinlich geschlechts- und ethnospezifisch. Diese Tatsache macht nicht nur die Kombination Kaletra, sondern die gesamte Gruppe der Protease-Inhibitoren zu Medikamenten, die einer besonders sorgfältigen Therapieüberwachung durch erfahrene Mediziner unterliegen. Eine Nutzen-Risiko-Abwägung ist in Hinsicht auf Mehrfachmedikation höchst angebracht.
Diverses
[Bearbeiten | Quelltext bearbeiten]Am 25. Juni 2005 drohte Brasilien damit, das Patent für das Anti-Aids-Medikament Kaletra zu ignorieren und Generika zuzulassen, wenn der Hersteller nicht binnen 10 Tagen die Preise senken würde.
Thailand beschloss im März 2007, das Patent für Kaletra auszusetzen, nachdem Verhandlungen mit dem Hersteller Abbott Laboratories gescheitert waren. Abbott hatte angeboten, den Preis von 1.850 Euro auf 1.700 Euro (Jahresdosis) zu senken. Ein Generikum kann bereits für ca. 760 Euro angeboten werden. Die Aussetzung des Patentes wird von Seiten der Regierung mit einer Notfall-Regelung aus einem Abkommen der Welthandelsorganisation begründet. In Thailand sind 500.000 Menschen an AIDS erkrankt. 20.000 erhalten Kaletra.[4]
Eine Kombination von Lopinavir und Ritonavir wird in klinischen Studien gegen COVID-19 erprobt.[5] Sie sind Teil der im März 2020 begonnenen „Solidarity“-Studie der Weltgesundheitsorganisation, in deren Rahmen sie teils in Beta-Interferon getestet werden. Sie sind ebenfalls Teil der Ende März 2020 begonnen „Discovery“-Großstudie, in deren Rahmen auch Remdesivir und Hydroxychloroquin mit der bisherigen Behandlung an mehr als 3000 Covid-19-Patienten in acht europäischen Ländern verglichen werden sollen.[6] Kaletra gehört zu einer Reihe von Medikamenten, von denen das deutsche Bundesgesundheitsministerium ab April 2020 Millionen von Packungen beschafft, um unterstützend bei schweren Verläufen gegen Covid-19 eingesetzt zu werden.[7]
Laut vorläufigen Zwischenergebnissen der Solidarity-Studie, die im Oktober 2020 vorgelegt wurden, konnte mit bis dahin 2062 Patienten (zzgl. Kontrollgruppe) kein nennenswerter Nutzen von Lopinavir sowie der Kombination von Lopinavir und Interferon festgestellt werden. Sie wurden im Juni 2020 aus der andauernden Studie genommen, in deren Rahmen verschiedene Medikationen auf ihre Wirksamkeit untersucht werden.[8][9]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Lopinavir. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juli 2019.
- ↑ a b Datenblatt Lopinavir bei Sigma-Aldrich, abgerufen am 26. Dezember 2022 (PDF).
- ↑ FDA Issues Safety Labeling Changes for Kaletra, 10. April 2009, Medscape Today.
- ↑ Aids-Medikamente: US-Pharmakonzern sagt Thailand den Kampf an. In: Spiegel Online. 15. März 2007, abgerufen am 29. Juni 2015.
- ↑ Anja Martini, Christian Drosten: Coronavirus-Update. (PDF) Folge 22. In: ndr.de. Norddeutscher Rundfunk, 26. März 2020, S. 4 f., abgerufen am 27. März 2020.
- ↑ Julia Koch: Irres Tempo. In: Der Spiegel. Nr. 14, 2020, S. 106 (online – 28. März 2020).
- ↑ Kazuhiro Nogi: Was kann das Grippemittel Avigan, das die Bundesregierung kauft? In: spiegel.de. 2. April 2020, abgerufen am 2. April 2020.
- ↑ Hongchao Pan, Richard Peto, Quarraisha Abdool Karim, Marissa Alejandria, Ana Maria Henao Restrepo, Cesar Hernandez Garcia, Marie Paule Kieny, Reza Malekzadeh, Srinivas Murthy, Marie-Pierre Preziosi, Srinath Reddy, Mirta Roses, Vasee Sathiyamoorthy, John-Arne Rottingen, Soumya Swaminathan: Repurposed antiviral drugs for COVID-19; interim WHO SOLIDARITY trial results. Weltgesundheitsorganisation, 15. Oktober 2020, abgerufen am 15. Oktober 2020.
- ↑ Repurposed antiviral drugs for COVID-19–interim WHO SOLIDARITY trial results. (PDF) In: medrxiv.org. WHO Solidarity trial consortium, 15. Oktober 2020, S. 2 f. 15, abgerufen am 17. Oktober 2020 (englisch, Preprint).