Methacrylsäureanhydrid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methacrylsäureanhydrid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H10O3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 154,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
löslich in Wasser (98 g·l−1 bei 20 °C)[5], >10 % in Ethanol und Ether[4] in Chloroform, Benzol, Toluol, Tetrahydrofuran[6] | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Methacrylsäureanhydrid oder Methacryloylanhydrid ist eine bifunktionelle α,β-ungesättigte Carbonylverbindung und als Anhydrid der Methacrylsäure und funktionales Alken ein sehr reaktives Acylierungsmittel und Monomer.
Mit Wasser reagiert Methacryloylanhydrid zu Methacrylsäure und in Kontakt mit Polymerisationsinitiatoren polymerisiert es zu Polymethacrylsäureanhydrid.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Auf klassische Weise reagiert Methacryloylchlorid mit Natriummethacrylat zum Methacrylsäureanhydrid.[8]
Methacryloylanhydrid kann auch durch Reaktion von Natriummethacrylat mit Benzoylchlorid in einer bescheidenen Ausbeute von 43 % erhalten werden.[9]
Methacrylsäureanhydrid entsteht bei der Reaktion von Methacrylsäure mit Phosgen in Gegenwart von Triethylamin als Säurefänger und Hydrochinon als Polymerisationsinhibitor[7] mit einer Ausbeute von 90,3 %.
Wegen der relativ aufwendig herzustellenden und unangenehmen (Methacryloylchlorid ist stark tränenreizend) bzw. giftigen (Phosgen) Reaktanden eignen sich die beschriebenen Verfahren nicht zur Herstellung von Methacrylsäureanhydrid im industriellen Maßstab.
Die Dehydratisierung von Methacrylsäure durch Reaktion mit Acetanhydrid ist besonders in der Patentliteratur in Batchreaktionen[10] und in kontinuierlich durchgeführten Reaktionen[11] umfangreich beschrieben. Die Umsetzung verläuft in zwei Gleichgewichtsreaktionen zunächst zum gemischten Anhydrid aus Methacryl- und Essigsäure (1), das mit weiteren Acetanhydrid zu Methacryloylanhydrid (2) reagiert.
Die Bruttoreaktion (3) beschreibt die mit Acetanhydrid ablaufende „Umanhydridisierung“. Zur Erzielung einer vernünftigen Raum-Zeit-Ausbeute muss die entstehende Essigsäure möglichst schnell und schonend durch Destillation aus dem Gleichgewicht entfernt werden.
Die Neigung der Methacrylsäure und des Methacrylsäureanhydrids zur Polymerisation (insbesondere bei erhöhter Temperatur und verlängerten Reaktionszeiten auch in Gegenwart von Polymerisationsinhibitoren!) und zur Bildung schwerer (höhermolekularer) Nebenprodukte durch Michael-Addition, sowie zur thermischen Zersetzung der gebildeten Produkte, reduziert die Selektivität der Umsetzung und erhöht das Risiko der Bildung von Belägen im Reaktor (Fouling).[12] Die Reaktion wird daher bei reduziertem Druck, z. B. bei 100 mmHg, teilweise in Gegenwart eines Katalysators, wie z. B. Chrom(III)-acetat[13] oder anderen Metallacetaten,[14] ausreichenden Mengen von Polymerisationsinhibitoren, wie z. B. Phenothiazin und Hydrochinon und gradueller Zugabe von Acetanhydrid bei Siedetemperaturen zwischen 80 und 95 °C (abhängig vom Innendruck der Reaktion) bis zum praktisch vollständigen Umsatz des Acetanhydrids durchgeführt. Die unterschiedlichen Prozessvarianten liefern Rohausbeuten von ca. 60 bis 80 % an Methacrylsäureanhydrid.
Die destillative Auftrennung des Mehrkomponentengemischs aus Essigsäure (Siedepunkt 118 °C), Acetanhydrid (139,4 °C), Methacrylsäure (161 °C), Methacrylsäureanhydrid (197 °C) und des gemischten Anhydrids (209,9 °C) bei vermindertem Druck wird meist nach Abtrennung der festen Nebenprodukte durchgeführt und liefert reines (ca. 95 %) bis hochreines (> 99,9 %) Produkt.
Mit der in der Praxis relativ anspruchsvollen Reaktivdestillation kann aus dem Reaktionsgemisch, ggf. mit Zugabe eines Schleppmittels, unter optimierten Bedingungen 99,95 % der Methacrylsäure umgesetzt und eine Ausbeute an Methacrylsäureanhydrid von 86,99 % erzielt werden.[15]
Die in einer Patentanmeldung beschriebene Synthese aus Methylmethacrylat und Kohlenmonoxid in Gegenwart von Rhodium(III)-chlorid, Triphenylphosphin und Methyliodid liefert bei 100 bar und 200 °C bis zu 18,2 Gew.-% Methacrylsäureanhydrid[16] und ist daher technisch irrelevant.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Methacrylsäureanhydrid ist in reinem Zustand eine klare, farblose, atem- und augenreizende und ätzende Flüssigkeit mit stechendem Geruch.[5] Die Substanz ist wasserlöslich, hydrolysiert in Wasser aber rasch in exothermer Reaktion zu Methacrylsäure. Wegen seiner Polymerisationsneigung wird Methacrylsäureanhydrid mit wirksamen Mengen eines Inhibitors, wie z. B. 2,4-Dimethyl-6-tert-butylphenol stabilisiert.[3]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Reaktionen mit niedermolekularen Verbindungen
[Bearbeiten | Quelltext bearbeiten]Trotz geringerer Reaktivität gegenüber Nucleophilen im Vergleich zu Säurechloriden ist Methacrylsäureanhydrid ein brauchbares (da milderes) Reagenz zur Bildung von Estern, Thioestern oder Amiden unter Einführung der polymerisationsaktiven Methacryloylgruppe. Allerdings geht dabei – wie bei allen Säureanhydriden – die Hälfte des Anhydridmoleküls als Methacrylsäure für die Acylierungsreaktion verloren.
Mit 2-Hydroxyethylacrylat reagiert Methacrylsäureanhydrid in Gegenwart eines stark sauren Ionenaustauschers bei Raumtemperatur glatt in Ausbeuten > 90 % zum 2-Methacroyloxyethylacrylat, das z. B. als asymmetrischer (Meth)acrylat-Vernetzer in Superabsorbern Verwendung finden kann.[17]

Mit Isopropylamin reagiert Methacrylsäureanhydrid bei Temperaturen unter 30 °C in hohen Ausbeuten (>90 %) und Reinheiten (>97 %) zum N-Isopropylmethacrylamid.[18]

Auch längerkettige Amine, wie z. B. Dodecylamin, können nach derselben Vorschrift in ausgezeichneten Ausbeuten (99 %) und Reinheiten (98 %) mit Methacryloylanhydrid zu den homologen Methacrylamiden umgesetzt werden.
Homo- und Copolymerisationsreaktionen
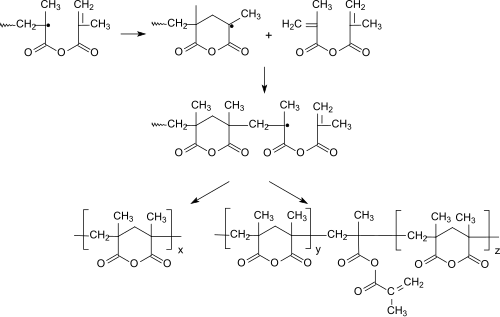
[Bearbeiten | Quelltext bearbeiten]Methacrylsäureanhydrid polymerisiert in Gegenwart von Radikalstartern zu Polymethacrylsäureanhydrid, dessen Polymerkette hauptsächlich aus sechsgliedrigen Ringen aufgebaut ist.[19]

Eingehendere Untersuchungen zeigten, dass die Cyclopolymerisation bei hohen Temperaturen, geringen Monomerkonzentrationen, „schlechten“, d. h. wenig solvatisierenden, Lösungsmitteln und bei hohem Umsatz bevorzugt stattfindet und gut lösliche cyclische Homopolymere liefert.[20] Die als Konkurrenzreaktion auftretende "„normale“ Vinylpolymerisation von Methacrylsäureanhydrid bedingt den Einbau von polymerisationsaktiven Methacryloylgruppen, die zur Vernetzung und geringeren Löslichkeit des Cyclopolymeren führen.
Durch geeignete Kombination eines Lithium-Esterenolats mit einem räumlich anspruchsvollen Aluminium-bisphenoxid kann Methacrylsäureanhydrid bei −78 °C auch anionisch zu einem weitgehend syndiotaktischen Makromolekül cyclopolymerisiert werden.[21]
Auch in Copolymeren, z. B. mit Vinylmonomeren[22] wie Styrol, Methylmethacrylat oder Methylacrylat, bildet Methacrylsäureanhydrid sechsgliedrige cyclische Strukturen aus.[23][24]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu Methacrylsäureanhydrid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ a b c Datenblatt Methacrylsäure-anhydrid bei Sigma-Aldrich, abgerufen am 19. Mai 2017 (PDF).
- ↑ a b c d Datenblatt Methacrylic anhydride bei Alfa Aesar, abgerufen am 15. Dezember 2014 (Seite nicht mehr abrufbar).
- ↑ a b c D.R. Lide: Handbook of Chemistry and Physics, 76th ed., 1995–1996. CRC Press, Boca Raton, 2010, ISBN 978-1-4398-2077-3, S. 3–291.
- ↑ a b c Evonik Industries AG, GPS Safety Summary, Methacrylic anhydride (MAAH), July 2013, Online=[1]
- ↑ X. Xiong, S.-X. Qu, Y.-M. Liu: Synthesis and characterization of dopamine graft compound N-methacrylyoyl-3,4-dihydroxyl-phenylamine. In: J. Phys.: Conf. Ser. Band 419, 2013, S. 012047, doi:10.1088/1742-6596/419/1/012047.
- ↑ a b T. Brotherton, J. Smith, Jr., J. Lynn: Notes-Acrylic and Methacrylic Anhydrides. In: J. Org. Chem. Band 26, Nr. 4, 1961, S. 1283–1284, doi:10.1021/jo01063a072.
- ↑ J.C.H. Hwa, W.A. Fleming, L. Miller: Acrylic anhydrides and polymers derived therefrom. In: J. Polym. Sci., A Gen. Pap. Band 2, Nr. 5, 1964, S. 2383–2400, doi:10.1002/pol.1964.100020527.
- ↑ Patent WO9532940: Process for the production of olefin acid anhydrides and esters thereof. Angemeldet am 30. Mai 1995, veröffentlicht am 7. Dezember 1995, Anmelder: Howard University, Erfinder: F. Ayorinde, M. Hassan.
- ↑ Patent US7074957: Process for preparing (meth)acrylic anhydride. Angemeldet am 28. Juni 2002, veröffentlicht am 11. Juli 2006, Anmelder: Arkema, Erfinder: B. Dupont, J.-M. Paul.
- ↑ Patent EP0196520: Verfahren zur Herstellung von Carbonsäureanhydriden. Angemeldet am 14. März 1986, veröffentlicht am 8. Oktober 1986, Anmelder: BASF AG, Erfinder: K. Bott, A. Anderlohr, T. Faust, J. Guth.
- ↑ Patent US8097757: Method for preparing (meth)acrylic anhydride. Angemeldet am 27. Januar 2009, veröffentlicht am 17. Januar 2012, Anmelder: Arkema France, Erfinder: J.-M. Paul, S. Tretjak.
- ↑ Patent EP1231201A1: Verfahren zur Herstellung von Anhydriden ungesättigter Carbonsäuren. Angemeldet am 29. Januar 2002, veröffentlicht am 14. August 2002, Anmelder: Röhm GmbH & Co. KG, Erfinder: B. Schmitt, J. Knebel, W. Klesse, A. Wittkowski, B. Laux.
- ↑ Patent US8586791B2: Method for producing (meth)acrylic anhydride, method for storing (meth)acrylic anhydride, and method for producing (meth)acrylate. Angemeldet am 4. August 2009, veröffentlicht am 19. November 2013, Anmelder: Mitsubishi Rayon Co., Ltd., Erfinder: R. Ansai, H. Nogami, K. Ogura.
- ↑ H. Wang, X. Bu, Z. Huang, J. Yang, T. Qiu: Synthesis of methacrylic anhydride by batch reactive distillation: reaction kinetics and process. In: Ind. Eng. Chem. Res. Band 53, Nr. 44, 2014, S. 17317–17324, doi:10.1021/ie501607v.
- ↑ Patent EP0226942A2: Verfahren zur Herstellung von ungesättigten aliphatischen Carbonsäureanhydriden. Angemeldet am 9. Dezember 1986, veröffentlicht am 1. Juli 1987, Anmelder: Röhm GmbH, Erfinder: K. Langerbein.
- ↑ Patent US6881858B2: Asymmetric (meth)acrylate crosslinking agents. Angemeldet am 11. Januar 2002, veröffentlicht am 19. April 2005, Anmelder: Roehm GmbH & Co. KG, Erfinder: W. Siol.
- ↑ Patent US20110218312A1: Method for producing N-isopropyl(meth)acrylamide. Angemeldet am 19. November 2009, veröffentlicht am 8. September 2011, Anmelder: Evonik Roehm GmbH, Erfinder: J. Knebel, W. Karnbrock, V. Kerscher.
- ↑ G. Smets, P. Hous, N. Deval: Cyclopolymerization. IV. Structure of polymethacrylic anhydride and kinetics of polymerization of methacrylic anhydride. In: J. Polym. Sci., A, Gen. Pap. Band 2, Nr. 1, 1964, S. 4825–4834, doi:10.1002/pol.1964.100021113.
- ↑ T.F. Gray, Jr., G.B. Butler: The fundamental basis for cyclopolymerization. X. A systematic study of the cyclopolymerization of methacrylic anhydride. In: J. Macromol. Sci. A., Chemistry. Band 9, Nr. 1, 1975, S. 45–82, doi:10.1080/00222337508068646.
- ↑ T. Kitaura, N. Moroi, T. Kitayama: Anionic cyclopolymerization of methacrylic anhydride with the aid of bulky aluminum Lewis acid. In: Polymer. Band 54, Nr. 8, 2013, S. 1987–1992, doi:10.1016/j.polymer.2012.12.078.
- ↑ J.C.H. Hwa, L. Miller: Copolymerization of methacrylic anhydride with vinyl monomers. In: J. Polym. Sci. Band 55, Nr. 161, 1961, S. 197–213, doi:10.1002/pol.1961.1205516120.
- ↑ F.C. Baines, J.C. Bevington: Studies of the polymerization and copolymerization of methacrylic anhydride. In: Polymer. Band 11, Nr. 12, 1970, S. 647–658, doi:10.1016/0032-3861(70)90017-0.
- ↑ G.B. Butler: Cyclopolymerization and Cyclocopolymerization. Marcel Dekker, Inc., 1992, ISBN 0-8247-8625-4, S. 251 ff.




