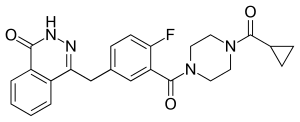
Olaparib
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Olaparib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C24H23FN4O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 434,46 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Dichte |
1,4 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt |
198 °C[1] | |||||||||||||||||||||
| Löslichkeit |
1 g/L in Wasser (25 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Olaparib wurde 2015 als erster Vertreter der Wirkstoffklasse der PARP-Inhibitoren zur Behandlung von Krebserkrankungen in den USA zugelassen (Handelsname: Lynparza, Hersteller: AstraZeneca).[2][3]
Physikalische und chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das Olaparib hat eine Dichte von 1,4 g/mL und schmilzt bei einer Temperatur von 198 ℃. Unter den Standardbedingungen hat Olaparib einen festen Aggregatzustand und liegt als farbloses Pulver vor.[4][5] Die Löslichkeit dieses Moleküls hängt stark von der Temperatur und der Wechselwirkung des Moleküls mit dem Lösungsmittel, Ausbildung von Wasserstoffbrückenbindung, ab. Ein Beispiel hierfür wäre die Löslichkeit von Olaparib in Tetrahydrofuran ist besser als in Methyl-tert-butylether. Zusammengefasst ist Olaparib in polar protischen Lösungsmittel löslich. Zusätzlich ist die Löslichkeit dieses Moleküls bei höheren Temperaturen besser aufgrund der Bewegung der Moleküle.[6] Darüber hinaus ist Olaparib thermisch und gegenüber Licht sehr stabil. Eine Zersetzung des Moleküls wird in einer sauren oder basischen Lösung mit einer höhen Konzentration beobachtet.[7]
Synthese
[Bearbeiten | Quelltext bearbeiten]Bei dem ursprünglich beschriebenen Herstellungsprozess wird Olaparib in einer sechsstufigen Synthese ausgehend von 2-Formylbenzoesäure in 46 %iger Ausbeute erhalten.[8]
Durch Umsetzung von 2-Formylbenzoesäure 1 mit Dimethylphosphit 2 erhält man das Phthalid-Derivat 3 das mit 2-Fluor-5-formylbenzonitril[S 1] 4 in einer Horner-Wadsworth-Emmons-Reaktion zu dem Olefin 5 umgesetzt wird. Die Hydrolyse der Nitrilgruppe unter alkalischen Bedingungen und anschließende Umsetzung mit Hydrazinhydrat führt zur Carbonsäure 6, die mit dem halbseitig mit einer Boc-Gruppe geschützten Piperazin 7 in Gegenwart von HBTU und Dimethylacetamid zu dem Carbonsäureamid 8 kondensiert wird. Die Abspaltung der Schutzgruppe mit Salzsäure ergibt das freie Amin 9, das mit Cyclopropancarbonylchlorid 10 zu Olaparib 11 kondensiert wird.
Anwendungsgebiete (Indikationen)
[Bearbeiten | Quelltext bearbeiten]Lynparza darf als Monotherapie für die Erhaltungstherapie bei erwachsenen Patienten mit Platin-sensitivem Rezidiv eines BRCA-mutierten hochgradig serösen epithelialen Eierstock-, Eileiter- oder Peritoneal-Karzinom eingesetzt werden. Vor Behandlungsbeginn muss in Blut oder Tumorgewebe eine Mutation in den Genen BRCA1 oder BRCA2 nachgewiesen sein.[5] Im Dezember 2017 wurden auf dem San Antonio Breast Cancer Symposium (SABCS) erste Daten zur Behandlung von HER2-negativem metastasiertem Brustkrebs präsentiert. Merck (MSD) und AstraZeneca kooperieren in der klinischen Entwicklung von Olaparib.[9] Im Januar 2018 hat die US-Arzneimittelbehörde FDA das Indikationsgebiet für Olaparib um das metastasierte Mammakarzinom mit spezifischer genetischer Mutation (BRCA-Mutation) erweitert.[10] Im Mai 2020 folgte die Zulassungserweiterung in der Indikation Prostatakrebs.[4] Olaparib ist auch in der EU seit 2014 zugelassen (Ovarialkarzinom),[11] die Indikationserweiterungen erfolgten 2019 (Brustkrebs) und 2020 (Prostatakrebs, Adenokarzinom des Pankreas).[6]
Biologische Wirkung
[Bearbeiten | Quelltext bearbeiten]Das Olaparib gehört zur Wirkstoffklasse der PARP-Inhibitoren. PARP steht für Poly(ADP-ribose)-Polymerase. Die Funktion des PARP-Enzyms ist die Reparatur von DNA-Einzelstrangbrüchen. Im Verlauf des Zellzyklus treten an der DNA immer wieder Schäden bzw. Fehler auf. Ein erheblicher Anteil an DNASchäden ergibt sich aus intrazellulären Prozessen wie Fehler bei der DNA-Replikation. Es können auch DNA-Schäden durch Strahlungen entstehen. Wird ein DNA-Einzelstrangbruch durch PARP-Enzym erkannt und lokalisiert, erfolgt die Bindung der PARP-Enzym an dem DNA-Bruch und durch seine enzymatische Aktivität die Rekrutierung von DNA-Reparaturproteinen. Nach der daraus resultierenden Chromatinmodifikation automodifiziert sich das PARP-Protein und dissoziiert von der DNA, um den Zugang für die Basenexzisionsreparatur-Enzyme zu erleichtern. Im Verlauf wird eine neue korrekte Base im DNA-Strang verknüpft, womit der Einzelstrangschaden wieder behoben ist. Die DNA liegt dann unbeschädigt vor.[12] Zur DNA-Reparation stehen verschiedene Proteine zur Verfügung. Unter anderen die Proteine BRCA1, BRCA2. BRCA1 und BRCA2 steht für (BReast CAncer Gene 1 und 2). Es sind Gene, die jeder Mensch von Geburt an trägt. BRCA-Gene bilden Eiweiße, die dabei helfen, Erbgutschäden zu reparieren. Somit besitzen sie eine wichtige Funktion bei der Reparatur von Zellschäden. Sie sind daran beteiligt, die Entstehung von Krebs zu verhindern. Manche Menschen haben eine angeborene Veränderung an diesen Genen. Immer wenn die DNA verdoppelt (repliziert) bzw. der Weg der Proteinsynthese beschritten wird (Transkription und Translation) besteht die Möglichkeit, dass spontan oder induziert (z. B. durch Strahlung, bestimmte Chemikalien) Fehler auftreten. Diese Änderungen des genetischen Materials bezeichnet man als Mutation. Dies erhöht das Risiko, an Brust- und Eierstockkrebs zu erkranken.[13]
Durch den Einzelstrangbruch kommt wieder das PARP-Enzym zum Einsatz. Jedoch wird dies vom Olaparib gehemmt bzw. deaktiviert, da das Olaparib an das aktive Zentrum der DNA bindet, verhindert es die Dissoziation von PARP und hält dies so an der DNA fest, wodurch die Reparatur blockiert wird. PARPInhibitoren verhindern die Reparatur der Krebszellen, welche durch die vorangegangene Chemotherapie geschädigt wurden. So entsteht bei der nächsten Zellteilung ein Doppelstrangbruch. Normalerweise werden diese Doppelstrangbrüche mittels homologer Rekombination repariert. Anders ist die Situation bei Krebszellen mit defekter homologen Rekombination. Da der notwendige Reparaturmechanismus der homologen Rekombination nicht mehr ausreichend funktioniert, sammeln sich DNA-Bruchstücke im Zellkern an, was dazu führt, dass ein genetisches Selbstmordprogramm in der Zelle aktiviert wird. Die Zelle vernichtet sich daraufhin selbst. Ein Mechanismus, welches auch als Apoptose bezeichnet wird und für die Krebstherapie von größter Bedeutung ist.[14][15]
Darreichungsformen
[Bearbeiten | Quelltext bearbeiten]Es sind zwei verschiedene Darreichungsformen von Lynparza (Wirkstoff: Olaparib) erhältlich, Lynparza 50 mg Hartkapseln und Lynparza 100 mg/-150 mg Filmtabletten (Stand Juni 2021). Die Dosierungsempfehlungen für die Hartkapseln und die Filmtabletten sind unterschiedlich; es besteht dadurch das Risiko einer Überdosierung mit Zunahme von unerwünschten Arzneimittelwirkungen.[16]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Datenblatt Olaparib bei Sigma-Aldrich, abgerufen am 22. Juli 2023 (PDF).
- ↑ Lynparza Approval History, Zulassungshistorie auf drugs.com, abgerufen am 19. September 2017.
- ↑ FDA approves olaparib tablets for maintenance treatment in ovarian cancer, PM FDA vom 17. August 2017, abgerufen am 19. September 2017.
- ↑ a b S. Siebenand: PARP-Hemmer Olaparib nun auch bei Prostatakrebs, www.pharmazeutische-zeitung.de, 20. Mai 2020.
- ↑ a b NEUE ARZNEISTOFFE, Pharmazeutische Zeitung, abgerufen am 19. September 2017.
- ↑ a b Europäische Arzneimittel-Agentur: Lynparza, abgerufen am 14. November 2020.
- ↑ A. Chaudhary, R. Tonk, P. Dagur, S. Dey, M. Ghosh, Stability Indicating Assay Method for the Quantitative Determination of Olaparib in Bulk and Pharmaceutical Dosage Form, Turkish Journal of Pharmaceutical Sciences, 2022, doi:10.4274/tjps.galenos.2021.48861, PMID 36317842, PMC 9634445 (freier Volltext).
- ↑ Zhaohang Chen, Shuai Wang, Kangjie Liu, Rui Zhang, Qiaoying Li, Weiguang Bian, Renzhong Qiao, Chao Li: Practical and Scalable Manufacturing Process for the Key Intermediate of Poly(ADP-Ribose) Polymerase Inhibitor Olaparib. In: ACS Omega. Band 7, Nr. 7, 22. Februar 2022, S. 6313–6321, doi:10.1021/acsomega.1c06920, PMID 35224393, PMC 8867798 (freier Volltext).
- ↑ New and Updated Data for Merck’s KEYTRUDA® (pembrolizumab) and Updated Data on LYNPARZA® (olaparib) in Multiple Breast Cancer Subtypes to Be Presented at the 2017 San Antonio Breast Cancer Symposium (SABCS), PM Merck/MSD vom 30. November 2017, abgerufen am 6. Dezember 2017.
- ↑ FDA approves first treatment for breast cancer with a certain inherited genetic mutation, PM FDA vom 12. Januar 2018, abgerufen am 18. Januar 2018.
- ↑ Übersicht über Lynparza und Begründung für die Zulassung in der EU, EMA vom April 2018, abgerufen am 18. Juni 2018.
- ↑ Heng Zhu, Miaoyan Wei, Jin Xu, Jie Hua, Chen Liang, Qingcai Meng, Yiyin Zhang, Jiang Liu, Bo Zhang, Xianjun Yu, Si Shi: PARP inhibitors in pancreatic cancer: molecular mechanisms and clinical applications. In: Molecular Cancer. Band 19, Nr. 1, 2. März 2020, S. 49, doi:10.1186/s12943-020-01167-9, PMID 32122376, PMC 7053129 (freier Volltext).
- ↑ S. C. Goulooze, A. F. Cohen, R. Rissmann: Olaparib. In: British Journal of Clinical Pharmacology. Band 81, Nr. 1, 2015, S. 171, doi:10.1111/bcp.12761, PMID 26344419, PMC 4693566 (freier Volltext).
- ↑ Avoxa-Mediengruppe Deutscher Apotheker GmbH: Ovarialkarzinom: Mäßige Prognose trotz neuer Therapien. Abgerufen am 21. Juli 2023.
- ↑ Arzneimittelprofil Olaparib. Abgerufen am 21. Juli 2023.
- ↑ LYNPARZA® 50 mg Hartkapseln (Wirkstoff Olaparib): Einstellung der Produktion Ende 2021, Informationsbrief AstraZeneca auf der WebSite der AKdÄ, abgerufen am 29. Juni 2021
