Paternò-Büchi-Reaktion
Die Paternò-Büchi-Reaktion ist eine nach Emanuele Paternò und George Hermann Büchi benannte photochemische [2+2]-Cycloaddition zur Bildung von viergliedrigen Oxetan-Ringen aus einer Carbonyl-Komponente und einem Alken.
Übersichtsreaktion
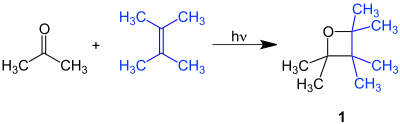
[Bearbeiten | Quelltext bearbeiten]Im Beispiel reagiert Aceton mit 2,3-Dimethylbut-2-en unter Lichteinwirkung zum Hexamethyloxetan (1):
Die Substituenten am Alken und der Carbonylkomponente bestimmen die Stereochemie der Produkte,[1] so entsteht bei der Reaktion von Benzaldehyd (Ph = Phenylrest) mit 2-Methylbuten ein Gemisch der beiden strukturisomeren Oxetane 2a und 2b:[2]
Mechanismus
[Bearbeiten | Quelltext bearbeiten]Die Reaktion wird durch Bestrahlung mit langwelligem UV-Licht, die nur die Carbonylverbindung anregt, initiiert. Die Carbonylverbindung (Aldehyd oder Keton) reagiert mit dem Alken konzertiert oder über eine Diradikal-Stufe. Olefine mit elektronenziehenden Substituenten bevorzugen einen konzertierten Mechanismus, während Donor-Substituenten einen radikalischen Mechanismus begünstigen, wobei die Diradikale über Abfangreaktionen nachgewiesen werden können.
Anwendung
[Bearbeiten | Quelltext bearbeiten]Die Reaktion wird in der Naturstoffsynthese eingesetzt, hat aber wegen der oft geringen Selektivität nur begrenzte Bedeutung.
Literatur
[Bearbeiten | Quelltext bearbeiten]- E. Paternò, G. Chieffi: Sintesi in chimica organica per mezzo della luce. Nota II. Composti degli idrocarburi non saturi con aldeidi e chetoni. In: Gazz. Chim. Ital., 39, 1909, S. 341–361.
- G. Büchi, Charles G. Inman, and E. S. Lipinsky: Light-catalyzed Organic Reactions. I. The Reaction of Carbonyl Compounds with 2-Methyl-2-butene in the Presence of Ultraviolet Light. In: Journal of the American Chemical Society. 76. Jahrgang, Nr. 17, 1954, S. 4327–4331, doi:10.1021/ja01646a024.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Thorsten Bach: Stereoselective Intermolecular [2 + 2]-Photocycloaddition Reactions and Their Application in Synthesis. In: Synthesis. 1998. Jahrgang, 1998, S. 683–703, doi:10.1055/s-1998-2054.
- ↑ László Kürti und Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 332–333, ISBN 978-0-12-429785-2.