Phloxin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phloxin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C20H2Br4Cl4Na2O5 | |||||||||||||||||||||
| Kurzbeschreibung |
dunkelrote Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 829,63 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Phloxin (genauer Phloxin B) ist ein synthetischer, wasserlöslicher roter Farbstoff, der ursprünglich als Färbemittel zum Mikroskopieren verwendet wurde (s. u.). Später wurde und wird er auch zum Färben von Kosmetika und Arzneistoffen benutzt. In der Europäischen Union (EU) und der Schweiz ist Phloxin für diese Anwendungsgebiete zugelassen, ebenso in den USA. In Japan wird Phloxin auch zum Färben von Lebensmitteln benutzt. Der Farbstoff ist das (Di)Natriumsalz des Tetrabrom-tetrachlorfluoresceins. Er kann in die Gruppe der Xanthenfarbstoffe eingeordnet und vom Fluorescein bzw. Uranin abgeleitet werden, unterscheidet sich jedoch von diesem durch Substitution durch vier Bromatome an den Positionen 2, 4, 5 and 7 des Xanthenrings und vier Chloratome im Carboxyphenyl-Ring. Somit ist es das Tetrachlor-Derivat des Eosin Y.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Carl Graebe stellte – in Analogie zur Synthese des Fluoresceins – aus Tetrachlorphthalsäure das Tetrachlorfluorescein her.[3] Daraus wurde durch Bromierung Tetrabrom-tetrachlorfluorescein erhalten, welches auch als Tetrachlor-eosin bezeichnet wurde.[4] Das Eosin war schon früher synthetisiert worden.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Tetrachlorphthalsäure wurde mit zwei Äquivalenten Resorcin kondensiert, wozu konzentrierte Schwefelsäure verwendet wurde. Unter Abspaltung von Wasser bildete sich ein Lacton. Ein Formelschema des Reaktionsmechanismus ist beim Lemma Fluorescein abgebildet. Das Reaktionsprodukt wurde mit molekularem Brom in Eisessig umgesetzt, wodurch elektrophile Substitution an den Kohlenstoffatomen C-2, C-4, C-5 und C-7 des Xanthenrings eintrat. Um Phloxin zu erhalten, wurde das Lacton mit Natronlauge umgesetzt („verseift“). Hierbei wurden auch die phenolischen OH-Gruppen deprotoniert, womit das Dianion gebildet und als Dinatriumsalz isoliert wurde.
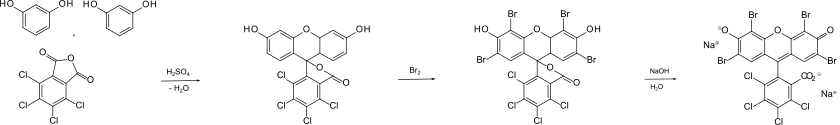
Nach diesem Prinzip wurde auch radioaktiv markiertes Phloxin hergestellt.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Analog zum Fluorescein und Phenolphthalein tritt Phloxin in verschiedenen Formen auf. Lange Zeit wurde die Verbindung als Lacton betrachtet mit der Strukturformel:

Diese kann jedoch die Farbe des Phloxins nicht erklären. Vielmehr sind die negativen Ladungen des Dianions zum größten Teil an der Carboxylatgruppe und den an C-3 und C-6 gebundenen Sauerstoffatomen des Xanthen-Rings lokalisiert. Die negative Ladung im Xanthen-Ring ist jedoch delokalisiert, was durch mesomere Grenzstrukturen des Anions beschrieben werden kann:

Das in Wasser gelöste Dinatriumsalz steht im Gleichgewicht mit korrespondierenden Säuren, in erster Linie mit dem Mononatriumsalz.[6]

Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Xanthenring und Phenylgruppe stehen nicht in einer Ebene, sondern sind um die C-6/C-9′-Achse verdreht. Das UV/VIS-Spektrum von Phloxin und der korrespondierenden Säure ist pH-abhängig. In alkalischer Lösung liegt das Absorptionsmaximum des Natriumsalzes bei 540 nm, ist also im Vergleich mit Fluorescein (485 nm) und Eosin (520 nm) nach längeren Wellenlängen (bathochrom) verschoben. Gelöstes Phloxin fluoresziert; das Maximum des Emissionsspektrums tritt bei 564 nm auf.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Phloxin wird zur histologischen Färbung, aber auch um ganze Organismen, z. B. Fadenwürmer (Nematoden), sichtbar zu machen. Das Bild zeigt das mit Phloxin/KOH gefärbte Gewebe des Pilzes Neottiella vivida (Nyl.).
Histologie
[Bearbeiten | Quelltext bearbeiten]Wie oben erwähnt, diente Phloxin ursprünglich zum Anfärben von Zellstrukturen in der Mikroskopie biologischer Präparate.[8][9][10] Häufig wird Phloxin mit anderen Farbstoffen kombiniert, z. B. mit Hämatoxylin. Gegenüber der Hämatoxylin-Eosin-Färbung (HE-Färbung) soll Phloxin Vorteile bieten.[11] So lassen sich größere Kontraste der Zellkomponenten erreichen; Kollagen und Muskelfasern lassen sich dadurch gut unterscheiden.[12]
Eine spezielle Verwendung ist die Hämatoxylin-Phloxin-Saffran-Färbung (HPS-Färbung). Dabei erscheinen das Cytoplasma und das Bindegewebe in rötlicher Farbe.[10]
Als Routineverfahren für die Entwicklungsbiologie wurde die PHTA-Färbung empfohlen: Das Objekt wird zunächst mit Hämatoxylin (H) angefärbt, dann mit Gerbsäure (tannic acid, T) behandelt. Schließlich lässt man Phloxin (P) und Azure B (Dimethyl-[7-(methylamino)phenothiazin-3-ylidene]azaniumchlorid) einwirken.[13]
Phloxin wird auch als Indikator für Bakterienbeläge (Plaques) in Kombination mit Brillantblau in der Zahnmedizin verwendet. Alte Beläge werden blau, neuere rot angefärbt.
Viability Assays werden ebenfalls mit Phloxin durchgeführt. Beispielsweise kann Phloxin B zum Anfärben toter Zellen verschiedener Hefen benutzt werden, einschließlich Saccharomyces cerevisiae und Schizosaccharomyces pombe. Verdünnte Lösungen in Kulturmedien von Hefen haben den Effekt, dass der Farbstoff in die lebenden Zellen nicht eindringen kann. Tote Hefezellen haben Schäden an der Zellmembran erlitten; so kann Phloxin B die Zellmembran durchdringen und die Zellbestandteile im Cytosol anfärben. Daher bietet die Färbung ein Maß für den Zelltod. Um die Zahl der Zellen zu bestimmen (cell counting assay), kann in einem Hämocytometer die Zahl der fluoreszierenden (d. h. toten) Zellen mit der Gesamtzahl der Zellen verglichen werden; so wird ein Maß für die Mortalität definiert.[14]
Dasselbe Prinzip kann – mit höherem Durchsatz – durch Fluoreszenz-aktivierte Durchflusszytometrie angewandt werden; hierbei werden alle durch Phloxin B gefärbte Zellen in der Probe gezählt.[15]
Anmerkung: In einigen Berichten wurde dagegen die Ansicht vertreten, dass Phloxin B von lebenden Hefezellen ausgeschieden wird, jedoch in toten bzw. absterbenden Hefezellen zurückgehalten wird.[16][17] Eine definitive Entscheidung für eines der Modelle steht noch aus.
Antimikrobielle Eigenschaften
[Bearbeiten | Quelltext bearbeiten]In vitro Tests zeigten, dass Phloxin B gegen einige Bakterien wirksam ist.[18][19]
Der bakterizide Effekt von Phloxin B auf gram-positive Bakterienstämme wird in Gegenwart von Licht erhöht, wie z. B. auf Bacillus subtilis, Bacillus cereus, und verschiedene Methicillin-resistente Staphylococcus aureus (MRSA) Stämme.[20] Bei einer Minimalen Hemm-Konzentration von 25 μM ist das Wachstum innerhalb 2,5 Stunden auf ein Zehntel reduziert. Bei Konzentrationen von 50 μM und 100 μM wird das Wachstum vollständig gestoppt, und Cell Counts nehmen um den Faktor 104 bis 105 ab.[18] Für Menschen hält die Food and Drug Administration Phloxin B bis zu einer Tagesdosis von 1,25 mg/kg für sicher.
Wirkungsmechanismus
[Bearbeiten | Quelltext bearbeiten]Bakterien, die Phloxin B ausgesetzt werden, erleiden oxidative Schädigung und sterben ab. In wässrigem Milieu bindet das negativ geladene Ion an positiv geladene Zellbestandteile.
Bei der Einwirkung von Licht auf Phloxin B erfolgt Debromierung. Freie Radikale und Singulett-Sauerstoff werden gebildet. Diese Moleküle verursachen irreversible Schäden an den Bakterien, was ihr Wachstum beendet und schließlich zum Zelltod führt. Gram-negative Bakterien sind gegen Phloxin B resistent. Ihre äußere Zellmembran besteht aus einer Lipid-Doppelschicht, die mit Polysacchariden bedeckt ist. Dieses Strukturelement bildet eine Barriere der Permeabilität, welche eine wirksame Aufnahme der Verbindung verhindert.
Ethylendiamintetraessigsäure (EDTA) wirkt, indem sie Lipopolysaccharide ablöst. Dadurch wird die Permeabilität der Membran erhöht. Fügt man EDTA der Bakterienkultur zu, so wird die Phloxin-Resistenz aufgehoben; gram-negative Bakterien werden ebenfalls abgetötet.[21]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu ACID RED 92 in der CosIng-Datenbank der EU-Kommission, abgerufen am 29. Dezember 2022.
- ↑ a b c d Datenblatt Phloxine B bei Sigma-Aldrich, abgerufen am 29. Dezember 2022 (PDF).
- ↑ C. Graebe: Ueber Tetrachlorphtalsäure. In: Justus Liebigs Annalen der Chemie. 1887, Bd. 238, S. 318–338, hier S. 333. doi:10.1002/jlac.18872380308.
- ↑ W. R. Orndorff, E. F. Hitch: Tetrachlorofluorescein and some of its derivatives. In: Journal of the American Chemical Society Jg. 1914, Bd. 36, Heft 4, S. 680–725. DOI:10.1021/ja02181a009.
- ↑ Allan H. Gobuty, Jay A. Spicer, Robert L. Dressler: Preparation of a radiobrominated fluorescein for liver scanning. In: Journal of Labelled Compounds and Radiopharmaceuticals. Band 17, Nr. 1, Januar 1980, S. 73–80, doi:10.1002/jlcr.2580170108.
- ↑ Nikolay O. Mchedlov-Petrossyan, Mikhail I. Rubtsov, Lyubov L. Lukatskaya: Ionization and Tautomerism of Chloro-Derivatives of Fluorescein in Water and Aqueous Acetone. In: Dyes and Pigments. Band 18, Nr. 3, 1. Januar 1992, S. 179–198, doi:10.1016/0143-7208(92)87002-I.
- ↑ J. Coppeta, C. Rogers: Dual emission laser induced fluorescence for direct planar scalar behavior measurements. In: Experiments in Fluids. Band 25, Nr. 1, 16. Juni 1998, S. 1–15, doi:10.1007/s003480050202.
- ↑ Charles J. Chamberlain: Staining with Phloxine. In: Stain Technology. Band 2, Nr. 3, Januar 1927, S. 91–93, doi:10.3109/10520292709115663.
- ↑ Surgical Pathology. 14. Juli 2007, archiviert vom am 14. Juli 2007; abgerufen am 9. Januar 2023.
- ↑ a b Hermina Borgerink: HPS stain. In: Narkive Mailing List Archive, abgerufen am 18. April 2016.
- ↑ Robert Rosenbaum: Phloxine As An Histologic Stain, Especially In Combination With Hematoxylin. In: Stain Technology. Band 22, Nr. 4, Januar 1947, S. 149–153, doi:10.3109/10520294709108304.
- ↑ Gudrun Lang: Histotechnik, Praxislehrbuch für die biomedizinische Analytik, 2. Auflage, Kapitel 10: Histologische Färbung, S. 169-250. Springer, Wien/New York, 2013. ISBN 978-3-7091-1189-5.
- ↑ Haymo Kurz, Dietrich Wittekind: A new panoptic stain for developmental biology — The mouse placenta paradigm. In: Annals of Anatomy - Anatomischer Anzeiger. Band 183, Nr. 5, September 2001, S. 437–441, doi:10.1016/S0940-9602(01)80199-0.
- ↑ Takeshi Noda: Chapter 2 Viability Assays to Monitor Yeast Autophagy. In: Methods in Enzymology. Band 451. Elsevier, 2008, ISBN 978-0-12-374548-4, S. 27–32, doi:10.1016/s0076-6879(08)03202-3.
- ↑ Renée Guérin, Pascale B. Beauregard, Alexandre Leroux, Luis A. Rokeach: Calnexin Regulates Apoptosis Induced by Inositol Starvation in Fission Yeast. In: PLoS ONE. Band 4, Nr. 7, 16. Juli 2009, S. e6244, doi:10.1371/journal.pone.0006244, PMID 19606215, PMC 2705804 (freier Volltext).
- ↑ Magdalena Kwolek-Mirek, Renata Zadrag-Tecza: Comparison of methods used for assessing the viability and vitality of yeast cells. In: FEMS Yeast Research. September 2014, doi:10.1111/1567-1364.12202.
- ↑ Nadège Minois, Magdalena Frajnt, Chris Wilson, James W. Vaupel: Advances in measuring lifespan in the yeast Saccharomyces cerevisiae. In: Proceedings of the National Academy of Sciences. Band 102, Nr. 2, 11. Januar 2005, S. 402–406, doi:10.1073/pnas.0408332102, PMID 15625107, PMC 544282 (freier Volltext).
- ↑ a b Patentanmeldung US2002165267A1: Phloxin B a color additive in cosmetics and food use thereof as anti-microbial agent. Angemeldet am 4. Mai 2001, veröffentlicht am 7. November 2002, Erfinder: Reuven Rasooly.
- ↑ Avraham Rasooly, Adrian Weisz: In Vitro Antibacterial Activities of Phloxine B and Other Halogenated Fluoresceins against Methicillin-Resistant Staphylococcus aureus. In: Antimicrobial Agents and Chemotherapy. Band 46, Nr. 11, November 2002, S. 3650–3653, doi:10.1128/AAC.46.11.3650-3653.2002, PMID 12384384, PMC 128710 (freier Volltext).
- ↑ Reuven Rasooly: Expanding the bactericidal action of the food color additive phloxine B to gram-negative bacteria. In: FEMS Immunology & Medical Microbiology. Band 45, Nr. 2, August 2005, S. 239–244, doi:10.1016/j.femsim.2005.04.004.
- ↑ Loretta Leive, Virginia Kollin: Controlling EDTA treatment to produce permeable escherichia coli with normal metabolic processes. In: Biochemical and Biophysical Research Communications. Band 28, Nr. 2, Juli 1967, S. 229–236, doi:10.1016/0006-291X(67)90434-2.
