Pyrrolidin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
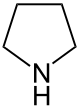
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pyrrolidin (IUPAC) | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H9N | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit durchdringendem aminartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 71,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,86 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
−63 °C[1] | ||||||||||||||||||
| Siedepunkt |
87 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Pyrrolidin, auch als Azolidin bezeichnet, ist eine organisch-chemische Verbindung aus der Stoffgruppe der sekundären heterocyclischen aliphatischen Amine. Es ist ein wichtiges Intermediat, welches in der pharmazeutischen Industrie und Feinchemie eingesetzt wird.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Pyrrolidin kommt in der Natur in verschiedenen Gemüsearten (z. B. Radieschen und eingelegten Paprika) vor. Einige Nahrungsmittel wie der Tilsiter Käse und Genussmittel wie Pulverkaffee können Pyrrolidin in geringen Konzentrationen enthalten. Es bildet sich u. a. leicht aus der Aminosäure Prolin. Pyrrolidin ist der Grundkörper der Pyrrolidin-Alkaloide, die sich entweder vom Prolin oder von Ornithin ableiten. Im Übrigen sind Pyrrolidin-Derivate auch in anderen Naturstoffen zahlreich vertreten, z. B. in Iminozuckern oder in Polyhydroxy-Alkaloiden als Glycosidase-Inhibitoren.[4]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Pyrrolidin wurde erstmals 1883 von den Chemikern Giacomo Luigi Ciamician und Max Dennstedt durch die Reduktion von Pyrrol gewonnen.[6][7]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Zur technischen Herstellung von Pyrrolidin setzt man 1,4-Butandiol mit Ammoniak bei Temperaturen von 165–220 °C und Drücken von 170–210 bar in Gegenwart von Cobalt- und Nickeloxid-Katalysatoren, welche auf Aluminiumoxid (Al2O3) geträgert sind, um.[8]
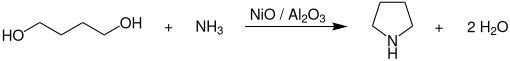
Die komplette Reaktion verläuft dabei in der flüssigen Phase in einem kontinuierlichen Rohr- oder Rohrbündelreaktor, welcher in der Kreisgasfahrweise betrieben wird. Der Katalysator wird als Festbett angeordnet und die Umsetzung in der Rieselfahrweise durchgeführt. Die Reinigung und Aufarbeitung des Produkts erfolgt durch mehrstufige Extraktiv- und Azeotropdestillation in Rektifikationskolonnen.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Pyrrolidin hat eine relative Gasdichte von 2,45 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,09 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Des Weiteren beträgt die dynamische Viskosität 0,94 mPa·s bei 20 °C.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 6,2, B = 1242 und C = −61 im Temperaturbereich von 296 bis 353 K.[9]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Pyrrolidin ist eine leicht entzündbare Flüssigkeit aus der Stoffgruppe der heterocyclischen sekundären Amine. Es ist mit Wasser vollständig und mit den meisten organischen Lösungsmitteln gut mischbar. Außerdem ist es leicht flüchtig. Durch Hitzeeinwirkung zersetzt sich der Stoff. Bei Kontakt mit starken Oxidationsmitteln, Chlorkohlenwasserstoffen, Glycolethern, Leichtmetallen und Phenol kann es zu gefährlichen chemischen Reaktionen kommen. Des Weiteren bildet Pyrrolidin mit nitrosierenden Agenzien (z. B. Nitriten, salpetriger Säure, nitrosen Gasen) krebserzeugenden Nitrosaminen. Eine wässrige Lösung der Konzentration 100 g/l weist bei einer Temperatur von 20 °C einen pH-Wert von 12,9 auf.[1]
Als sekundäres Amin ist Pyrrolidin eine relativ starke Base.[4] Durch Protonierung am freien Elektronenpaar des Stickstoffs wird das Pyrrolidinium-Ion als konjugierte Säure gebildet.
Das gebildete Pyrrolidinium-Ion ist mit einem pKS-Wert von 11,27 eine schwache Säure.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Pyrrolidin ist ein wertvolles Zwischenprodukt für zahlreiche Anwendungen in der Pharmazeutischen Industrie und zur Herstellung von Feinchemikalien. Es ist Ausgangsstoff für Arzneimittel wie Antihistaminika oder Antibiotika. Des Weiteren wird zur Herstellung von Fungiziden, Insektiziden, Vulkanisationsbeschleuniger, Antioxidantien, Weichmachern, Photochemikalien, Dispergiermitteln und Korrosionsinhibitoren genutzt. Außerdem ist es ein Härtungsmittel für Epoxidharze und dient als Katalysator für die Polyurethan-Herstellung. Ferner findet Pyrrolidin Verwendung in der Polymermodifikation und wird als Vorlage zur Herstellung von Silica-Gelen oder Zeolithe eingesetzt.[4]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Die Dämpfe von Pyrrolidin können mit Luft beim Erhitzen des Stoffes über den Flammpunkt explosive Gemische bilden. Hauptsächlich wird der Stoff über den Atemtrakt und die Haut aufgenommen. Des Weiteren wurde eine sehr effektive Resorption in den Magen-Darm-Trakt erkannt. Bei Aufnahme oder Exposition kommt es akut zu starken Reizungen bis hin zu Verätzungen der Haut und der Schleimhäute. Chronisch kann es zudem zu Befindlichkeitsstörungen kommen. Besonders besorgniserregend ist die schnelle Bildung von hochgiftigen und krebserzeugenden Nitrosaminen, die bei Kontakt mit nitrosierenden Agenzien entstehen. Eine direkte mutagene Wirkung konnte jedoch ausgeschlossen werden. Zur Reproduktionstoxizität und Kanzerogenität liegen keine ausreichenden Angaben vor. Pyrrolidin weist eine untere Explosionsgrenze (UEG) von ca. 1,6 Vol.-% (48 g/cm3) und eine obere Explosionsgrenze (OEG) von ca. 10,6 Vol.-% auf. Die Zündtemperatur beträgt 320 °C. Der Stoff fällt somit in die Temperaturklasse T2 und in die Explosionsgruppe IIA. Mit einem Flammpunkt von 3 °C gilt Pyrrolidin als leicht entflammbar.[1]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n o Eintrag zu Pyrrolidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Juni 2023. (JavaScript erforderlich)
- ↑ a b H. K. Hall, Jr.: Correlation of the Base Strengths of Amines. In: Journal of the American Chemical Society. Band 79, 1957, S. 5441–5444, doi:10.1021/ja01577a030.
- ↑ Frederick G. Bordwell, George E. Drucker, Herbert E. Fried: Acidities of carbon and nitrogen acids: the aromaticity of the cyclopentadienyl anion. In: Journal of Organic Chemistry. Band 46, 1981, S. 632–635, doi:10.1021/jo00316a032.
- ↑ a b c d Eintrag zu Pyrrolidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Juni 2023.
- ↑ Eintrag zu Pyrrolidine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. Mai 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ G. L. Ciamician, M. Dennstedt: Einwirkung nascirenden Wasserstoffs auf Pyrrol. In: Berichte der deutschen chemischen Gesellschaft. Band 16, 1883, S. 1536–1544, doi:10.1002/cber.18830160206.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 146 pdf.
- ↑ a b Patent EP2872494B1: Verfahren zur Herstellung von Pyrrolidin. Veröffentlicht am 15. Juni 2016, Anmelder: BASF SE, Erfinder: Roland Bou Chedid, Johann-Peter Melder, Roman Dostalek, Jörg Pastre, Aik Meam Tan.
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.



