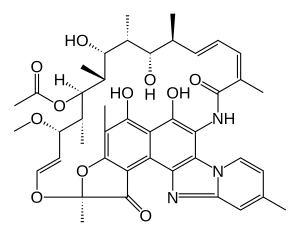
Rifaximin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Rifaximin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C43H51N3O11 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Hemmer der Proteinbiosynthese | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 785,88 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Rifaximin, ein halbsynthetisches Derivat von Rifamycin, ist ein bakterizides orales Breitbandantibiotikum.
Aufgrund der Pyridoimidazol-Struktur wird Rifaximin praktisch nicht resorbiert (< 1 %) und ist ausschließlich im Darmlumen wirksam, wodurch es sich von den systemischen Antibiotika unterscheidet.[2]
Das breite Keimspektrum,[3] fehlende systemische Nebenwirkungen[4][5] und Interaktionen sowie eine praktisch bisher nicht beobachtete Resistenzentwicklung[6][7][8][9] machen Rifaximin zu einer Therapieoption bei intestinalen bakteriellen Infektionen.
Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Zugelassene Indikationen in Deutschland
[Bearbeiten | Quelltext bearbeiten]In Deutschland ist Rifaximin für die Behandlung der durch nicht-invasive enteropathogene Bakterien (wie z. B. Escherichia coli) verursachten Reisediarrhoe bei Erwachsenen zugelassen, wobei die Reisediarrhoe als eine in einem mediterranen, subtropischen oder tropischen Land erworbene Diarrhoe bei Reisenden definiert ist. Seit 2013 ist Rifaximin auch in Deutschland zur Therapie und Prophylaxe der hepatischen Enzephalopathie zugelassen.
Die Zulassung beruht unter anderem auf einer randomisierten Doppelblindstudie, in der Rifaximin gegen Ciprofloxacin getestet wurde. 187 Patienten mit Diarrhoe erhielten entweder drei Tage lang zweimal täglich 400 mg Rifaximin oder zweimal täglich 500 mg Ciprofloxacin. In beiden Gruppen nahm die Anzahl erkrankter Patienten vergleichbar ab. Beide Antibiotika verkürzten die Durchfalldauer um rund einen Tag.[10]
International zugelassene Indikationen
[Bearbeiten | Quelltext bearbeiten]Die Eigenschaften von Rifaximin werden bereits seit 1983 in der medizinischen Literatur beschrieben.
Bis zum heutigen Zeitpunkt konnte die Wirksamkeit und Verträglichkeit in zahlreichen klinischen Studien belegt werden, welche international zu weiteren Zulassungen geführt haben. So ist Rifaximin in anderen Ländern, wie z. B. Österreich, zur Behandlung der folgenden Erkrankungen zugelassen:
- Bakterielles Überwucherungssyndrom (Dünndarmfehlbesiedlung)*
- Pseudomembranöse Kolitis durch Clostridioides difficile*
- Hepatische Enzephalopathie
- Divertikelerkrankungen*
- Präoperative Darmdekontamination*
(* in Deutschland sind diese Indikationen derzeit noch nicht zugelassen)
Status von Rifaximin weltweit
[Bearbeiten | Quelltext bearbeiten]Seit 2008 ist der Arzneistoff in Deutschland erhältlich. Weltweit wird der Wirkstoff in 17 Ländern vertrieben.
Pharmakologische Angaben
[Bearbeiten | Quelltext bearbeiten]Nach oraler Gabe wird Rifaximin zu weniger als 1 % über den Magen-Darm-Trakt resorbiert.[2] Dies gilt auch für Patienten, deren Mucosa (Darmschleimhaut) durch Entzündungen und Ulcerationen geschädigt ist.[11] Im Darm werden nach oraler Gabe von Rifaximin sehr hohe Konzentrationen von bis zu 8000 μg/g erreicht.[12] Damit liegt die Wirkstoffkonzentration deutlich höher als die minimale Hemmkonzentration (MIC) der bakteriellen Erreger. Rifaximin wird fast vollständig unverändert mit dem Stuhl ausgeschieden.[4]
Wirkung
[Bearbeiten | Quelltext bearbeiten]In zwei kleinen Studien halbiert Rifaximin im Placebovergleich den Zeitraum bis zum letzten ungeformten Stuhl. Das wenig erprobte Mittel ist für Kinder und Ältere nicht ausreichend geprüft.[13][14]
Eine antibiotische Therapie ist umstritten, da sie die Resistenzentwicklung fördert. Zudem sind potenzielle Störwirkungen wie allergische Reaktionen zu bedenken.
Für Rifaximin sieht das Arznei-Telegramm bei Reisediarrhoe keine Indikation.[15]
Wirkmechanismus
[Bearbeiten | Quelltext bearbeiten]Wie andere Antibiotika der Rifamycin-Gruppe bindet Rifaximin irreversibel an die Beta-Untereinheit der prokaryotischen DNA-abhängigen RNA-Polymerase. Auf diese Weise blockiert es die Bindung des Enzyms an die DNA und damit die Initiierung der Kettenbildung. Durch die Unterdrückung der RNA-Transkription wird letztlich die Proteinsynthese gehemmt.[5] Die Wirkung von Rifaximin ist bakterizid.[11]
Wirkspektrum
[Bearbeiten | Quelltext bearbeiten]Der Wirkstoff Rifaximin besitzt ein breites antimikrobielles Wirkspektrum gegen die meisten grampositiven und -negativen, aeroben und anaeroben Bakterien und deckt damit die meisten Bakterien ab, die Darminfektionen hervorrufen.[3]
| Grampositive Erreger | Gramnegative Erreger | ||
|---|---|---|---|
| Aerobier | Anaerobier | Aerobier | Anaerobier |
|
|
|
|
|
Microaerophile
| |||
Tab. 1: Auswahl Rifaximin-sensitiver Erreger[16]
Unerwünschte Wirkungen (Nebenwirkungen)
[Bearbeiten | Quelltext bearbeiten]Rifaximin verfügt über ein günstiges Verträglichkeitsprofil, das sich aus seiner minimalen systemischen Verfügbarkeit ableiten lässt. Die Häufigkeit liegt in Studien auf Placebo-Niveau.[4][5]
| Rifaximin (600 mg /d) n = 320 |
Placebo n = 228 | |
|---|---|---|
| (% Patienten) | ||
| Flatulenz | 9,7 | 19,3 |
| Abdominelle Schmerzen | 5,9 | 9,2 |
| Nausea | 4,7 | 8,3 |
| Rektaler Tenesmus | 4,1 | 6,1 |
| Stuhldrang | 3,8 | 6,6 |
| Obstipation | 3,4 | 2,6 |
| Kopfschmerz | 5,3 | 5,7 |
| Fieber | 3,1 | 4,4 |
Tab. 2: In den Zulassungsstudien von Rifaximin berichtete unerwünschte Ereignisse[16]
Wechselwirkungen mit anderen Medikamenten
[Bearbeiten | Quelltext bearbeiten]Hinweise auf Wechselwirkungen von Rifaximin mit anderen Arzneimitteln liegen nicht vor.
Da die Absorption von oral verabreichtem Rifaximin über den Magen-Darm-Trakt vernachlässigbar (< 1 %) ist, sind keine systemischen Wechselwirkungen mit anderen Arzneimitteln anzunehmen.
Gegenanzeigen (Kontraindikationen)
[Bearbeiten | Quelltext bearbeiten]Rifaximin ist nicht anzuwenden bei Patienten mit klinischen Zeichen einer invasiven Enteritis, z. B. bei Fieber oder blutigem Stuhl. Bei Überempfindlichkeit gegen den Wirkstoff, gegen andere Rifamycin-Derivate oder einen der sonstigen Bestandteile darf Rifaximin nicht angewendet werden. Für die Behandlung von Kindern liegt keine Erfahrung vor.
Sonstiges
[Bearbeiten | Quelltext bearbeiten]- Rifaximin ist seit 1987 in Italien erhältlich[17] und 2009 wurde es in Deutschland mit dem Innovationspreis des H. G. Creutzfeldt-Instituts ausgezeichnet.[18]
- Im Jahre 2005 hat Rifaximin von der amerikanischen Food and Drug Administration (FDA) für die hepatische Enzephalopathie (HE) den sog. Orphan drug status erhalten.[19]
- Das United Nations Medical Services Department hat die Mitnahme des deutschen Präparates in der Reiseapotheke für die Mitglieder der Organisation empfohlen.[20]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate Colidimin (A), XIFAXAN (CH, D), Rifacol (I), TARGAXAN (UK, LX, B),
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Rifaximin bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- ↑ a b J. J. Descombe, D. Dubourg, M. Picard, E. Palazzini: Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. In: Int J Clin Pharmacol Res. 14 (2), 1994, S. 51–56.
- ↑ a b W. W. Hoover, E. H. Gerlach, D. J. Hoban, G. M. Eliopoulos, M. A. Pfaller, R. N. Jones: Antimicrobial activity and spectrum of rifaximin, a new topical rifamycin derivative. In: Diagn Microbiol Infect Dis. 16, 1993, S. 111–118.
- ↑ a b c Veteran Health Administration. VHA Pharmacy Benefits Management Strategic Healthcare Group and Medical Advisory Panel. National PBM Drug Monograph. Rifaximin (Xifaxan™) ( vom 15. Dezember 2006 im Internet Archive) (2004).
- ↑ a b c L. L. Brunton, J. S. Lazo, Parker KL (eds): Goodman & Gilman’s The pharmacological basis of therapeutics. 11. Auflage. New York u. a. 2006.
- ↑ C. De Leo, C. Eftimiadi, G. C. Schito: Rapid disappearance from the intestinal tract of bacteria resistant to rifaximin. In: Drugs Exptl Clin Res. 12, 1986, S. 979–981.
- ↑ H. L. DuPont, Z. D. Jiang: Influence of rifaximin treatment on the susceptibility of intestinal Gram-negative flora and enterococci. In: Clin Micro Infect Dis. 10 (11), 2004, S. 1009–1011.
- ↑ H. L. DuPont, Z. D. Jiang, C. D. Ericsson, J. A. Adachi, J. J. Mathewson, M. W. DuPont, E. Palazzini, L. M. Riopel, D. Ashley, F. Martinez-Sandoval: Rifaximin versus ciprofloxacin for the treatment of traveler’s diarrhea: a randomized, double-blind clinical trial. In: Clin Infect Dis. 33, 2001, S. 1807–1815.
- ↑ F. Castelli, N. Saleri, L. R. Tomasoni, G. Carosi: Prevention and treatment of traveler’s diarrhea. Focus on antimicrobial agents. In: Digestion. 73 (suppl 1), 2006, S. 109–168.
- ↑ H. L. DuPont, Z. D. Jiang, C. D. Ericsson, J. A. Adachi, J. J. Mathewson, M. W. DuPont, E. Palazzini, L. M. Riopel, D. Ashley, F. Martinez-Sandoval: Rifaximin versus ciprofloxacin for the treatment of traveler’s diarrhea: a randomized, double-blind clinical trial. In: Clin Infect Dis. 33, 2001, S. 1807–1815. PMID 11692292.
- ↑ a b P. Gionchetti, F. Rizzello, A. Venturi, F. Ugolini, M. Rossi, P. Brigidi, R. Johansson, A. Ferrieri, G. Poggioli, M. Campieri: Review-antibiotic treatment in inflammatory bowel disease: rifaximin, a new possible approach. In: Eur Rev Med Pharmacol Sci. 3 (1), 1999, S. 27–30. PMID 10710827.
- ↑ Z. D. Jiang, S. Ke, E. Palazzini, L. Riopel, H. Dupont: In vitro activity and fecal concentration of rifaximin after oral administration. In: Antimicrob Agents Chemother. 44 (8), 2000, S. 2205–2206. PMID 10898704; PMC 90042 (freier Volltext).
- ↑ R. Steffen, D. A. Sack, L. Riopel, Z. D. Jiang, M. Stürchler, C. D. Ericsson, B. Lowe, P. Waiyaki, M. White, H. L. DuPont: Therapy of travelers’ diarrhea with rifaximin on various continents. In: American Journal of Gastroenterology. Band 98, Nummer 5, Mai 2003, S. 1073–1078, doi:10.1111/j.1572-0241.2003.07283.x. PMID 12809830.
- ↑ D. N. Taylor, A. L. Bourgeois, C. D. Ericsson, R. Steffen, Z. D. Jiang, J. Halpern, R. Haake, H. L. Dupont: A randomized, double-blind, multicenter study of rifaximin compared with placebo and with ciprofloxacin in the treatment of travelers’ diarrhea. In: The American journal of tropical medicine and hygiene. Band 74, Nummer 6, Juni 2006, S. 1060–1066. PMID 16760520.
- ↑ Arznei-Telegramm a-t 39, 2008, S. 121–3.
- ↑ a b K. U. Petersen: Rifaximin: Ein lokal wirksames Antibiotikum für den Gastrointestinaltrakt. Premium Selection 2008.
- ↑ RIFAXIMIN (XIFAXAN) BEI REISEDURCHFALL? In: Arznei-Telegramm. Dezember 2008.
- ↑ Sabine Stürmer: Innovationspreis für darmselektive Antibiose. In: Ärzte Zeitung. 22. April 2009.
- ↑ U.S. Food and Drug Administration: List of orphan products designation and approvals (PDF; 6 MB) as of October 3, 2007.
- ↑ Pressemitteilung Salix Pharmaceuticals, Inc., 4. August 2008.