Tosylmethylisocyanid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tosylmethylisocyanid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C9H9NO2S | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 195,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Tosylmethylisocyanid (TosMIC) ist eine chemische Verbindung. Sie ist auch bekannt als Van-Leusen-Reagenz, da sie beispielsweise in der Van-Leusen-Reaktion zur Synthese von Nitrilen eingesetzt werden kann. Außerdem kann TosMIC verwendet werden, um Oxazole und Imidazole zu synthetisieren.[3][4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]TosMIC besitzt am Kohlenstoff-Atom zwischen der Isonitril- und der Sulfonyl-Gruppe acide Wasserstoff-Atome. Durch Deprotonierung erhält TosMIC dort ein nucleophiles Zentrum. Der Isocyanidkohlenstoff ist ein elektrophiles Zentrum.[5]
Synthese
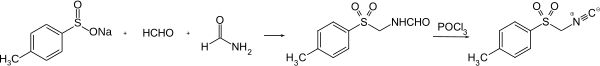
[Bearbeiten | Quelltext bearbeiten]TosMIC wird in einer zweistufigen Reaktion gewonnen. Zuerst reagieren Natrium-p-toluolsulfinat,[S 1] Formaldehyd und Formamid zu N-(Tosylmethyl)formamid,[S 2] welches dann mit Phosphoroxychlorid zu TosMIC dehydratisiert wird.[6][7]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]TosMIC eignet sich für die Synthese von Pyrrolen, Imidazolen, Indolen, 1,2,4-Triazolen und Oxazolen.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt Tosylmethyl isocyanide bei Fisher Scientific, abgerufen am 13. Februar 2014 (PDF).
- ↑ a b Datenblatt p-Toluenesulfonylmethyl isocyanide, 98% bei Sigma-Aldrich, abgerufen am 14. Juli 2013 (PDF).
- ↑ Daan Van Leusen, Albert M. Van Leusen: Synthetic Uses of Tosylmethyl Isocyanide (TosMIC). In: Organic Reactions. Band 57, Nr. 3, 2004, doi:10.1002/0471264180.or057.03.
- ↑ Jie Jack Li: Name reactions: A collection of detailed mechanisms and synthetic applications, 5. Auflage, Springer, Heidelberg, 2014, S. 613–614, ISBN 978-3-319-03979-4.
- ↑ TosMIC (PDF; 56 kB).
- ↑ Otto H. Oldenziel, Daan Van Leusen, Albert M. Van Leusen: Chemistry of sulfonylmethyl isocyanides. 13. A general one-step synthesis of nitriles from ketones using tosylmethyl isocyanide. Introduction of a one-carbon unit. In: The Journal of Organic Chemistry. Bd. 42, Nr. 19, 1977, S. 3114–3118doi:10.1021/jo00439a002.
- ↑ B. E. Hoogenboom, O. H. Oldenziel, A. M. van Leusen: p-Tolylsulfonylmethyl Isocyanide In: Organic Syntheses. 57, 1977, S. 102, doi:10.15227/orgsyn.057.0102; Coll. Vol. 6, 1988, S. 987 (PDF).
- ↑ Kapil Kumar: TosMIC: A Powerful Synthon for Cyclization and Sulfonylation. In: ChemistrySelect. Band 5, Nr. 33, 7. September 2020, S. 10298–10328, doi:10.1002/slct.202001344.
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Natrium-p-tolylsulfinat: CAS-Nr.: 824-79-3, EG-Nr.: 212-538-5, ECHA-InfoCard: 100.011.398, PubChem: 2723791, ChemSpider: 12660, Wikidata: Q27268078.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu N-Tosylmethylformamid: CAS-Nr.: 36635-56-0, EG-Nr.: 700-490-2, ECHA-InfoCard: 100.149.277, PubChem: 547321, Wikidata: Q72509325.