Uran(V)-chlorid
| Kristallstruktur | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| _ U5+ _ Cl− | |||||||||
| Allgemeines | |||||||||
| Name | Uran(V)-chlorid | ||||||||
| Andere Namen |
Uranpentachlorid | ||||||||
| Verhältnisformel | UCl5 | ||||||||
| Kurzbeschreibung |
rotbrauner Feststoff[1] | ||||||||
| Externe Identifikatoren/Datenbanken | |||||||||
| |||||||||
| Eigenschaften | |||||||||
| Molare Masse | 415,29 g·mol−1 | ||||||||
| Aggregatzustand |
fest[1] | ||||||||
| Dichte |
3,81 g·cm−3[2] | ||||||||
| Löslichkeit | |||||||||
| Gefahren- und Sicherheitshinweise | |||||||||
 Radioaktiv | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||
Uran(V)-chlorid ist eine chemische Verbindung des Urans aus der Gruppe der Chloride.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Uran(V)-chlorid kann durch Reaktion von Uran(VI)-oxid mit Tetrachlorkohlenstoff gewonnen werden, wobei eine vorher hergestellte Menge der Verbindung als Katalysator dient.[1]
Es kann auch durch Reaktion von Uran(IV)-chlorid mit Chlor im Wirbelschichtreaktor bei 550 °C gewonnen werden.[1]
Eigenschaften
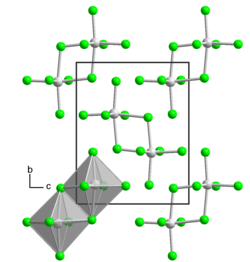
[Bearbeiten | Quelltext bearbeiten]Uran(V)-chlorid liegt in Form eines rotbraunen, mikrokristallinen Pulvers oder als schwarzrote Kristalle mit metallisch glänzenden Oberflächen vor. Er ist im Gegensatz zu Uran(IV)-chlorid in flüssigem Chlor löslich. Die Verbindung ist sehr hygroskopisch und zersetzt sich in Wasser oder beim Erhitzen in Uran(VI)-chlorid und Uran(IV)-chlorid. Mit organischen Lösungsmitteln wie Alkoholen, Aceton, Diethylether oder Dioxan reagiert sie. Mit einigen anderen Lösungsmitteln wie Tetrachlorkohlenstoff, Kohlenstoffdisulfid und Thionylchlorid bilden sich stabile Lösungen. Die Verbindung besitzt meist (α-Form) eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2) und den Gitterparametern a = 799 pm, b = 1069 pm, c = 848 pm und β = 91,5°.[1] Es kommt jedoch auch eine trikline β-Form mit der Raumgruppe P1 (Nr. 2) vor, die durch Kristallisation von Uran(VI)-chlorid mit Tetrachlorkohlenstoff oder Dichlormethan entsteht.[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 1208.
- ↑ a b Lester R. Morss, Norman M. Edelstein, J. Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements. Bände 1-6. Springer, Dordrecht 2010, ISBN 978-94-007-0211-0, S. 522, 1795 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. November 2021. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Uranverbindungen, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. November 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.



