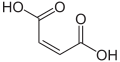
Fumarata acido
| Fumarata acido | ||

| ||
fumarata acido | ||

| ||
fumarata acido | ||
| Alternativa(j) Nomo(j) | ||
| (E-)-Butenodiojka acido Boletikata acido Likenikata acido Etilenodukarboksilata acido E 297 | ||
| Kemia formulo | HO2CCH=CHCO2H aŭ C4H4O4 | |
| PubChem-kodo | 723 | |
| ChemSpider kodo | 10197150 | |
| CAS-numero-kodo | 110-17-8 | |
| Karakterizaĵoj | ||
| Aspekto | blanka solidaĵo | |
| Acideco (pKa) | pka1= 3.03, pKa2 = 4.44 (18 °C) | |
| Molmaso | 116.07216 g·mol-1 | |
| Smiles | C(=C/C(=O)O)\C(=O)O | |
| Denseco | 1.635 g/cm3 (20 °C) | |
| Vaporpremo | <1.54 x 10−4 mm Hg (25 °C) | |
| Fandopunkto | 287 °C (549 ℉; 560 K) (malkomponiĝa temperaturo) | |
| Akva solvebleco | Solvebla en akvo (4.3 g/ml) 20 °C (7.0 g/ml) 25 °C solvebla en etanolo, koncentrita sulfata acido, malmulte solvebla en Dietila etero kaj acetono nesolvebla en kloroformo kaj benzeno | |
| Ekflama temperaturo | 273 °C, 287 °C (mema malkomponiĝo) | |
| Sekurecaj Indikoj | ||
| Riskoj | R36 | |
| Sekureco | S2 S26 | |
| Pridanĝeraj indikoj | ||
| Danĝero |
| |
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H319[1] | |
| GHS Deklaroj pri antaŭgardoj | P264, P280, P305+351+338, P313 | |
(25 °C kaj 100 kPa) | ||
Fumarata acido aŭ trans-butenodiojka acido estas kemia kombinaĵo kun formulo HO2CCH=CHCO2H. Ĉi-kombinaĵo blanka kristaleca estas unu el la du dukarboksilataj izomeraj acidoj, kune kun la maleata acido. En la fumarata acido, la karboksilataj grupoj estas trans-aj kaj en la maleata acido ili estas cis-aj. Fumarata acido posedas fruktecan guston. La saloj kaj esteroj estas konataj kiel fumaratoj.

Fumarata acido estis unue preparita el la sukcenata acido. Tradicia sintezo envolvas la oksidadon de la furfuralo (el la maiza procezigo) uzante kloraton en la ĉeesto de vanadobaza katalizilo. Nuntempe, la industria sintezo de la fumarata acido ĉefe baziĝas sur kataliza izomerigo de la maleata acido en akva solvaĵo kun malalta pH. Maleata acido estas disponebla je altaj volumenoj kiel hidroliza[2] produkto de la maleata anhidrido[3], produktita per kataliza oksidado de benzeno[4] aŭ butano[5].
La kemiaj proprecoj de la fumarata acido estas anticipeblaj elde ties funkcia grupo de la komponanto. Ĉi tiu malforta acido estigas diesteron, ĝi suferas aldonojn pere de la duobla ligo, kaj ĝi estas bonega dienofilo[6].
Fumarata acido ne brulas en Bombo kalorimetro sub kondiĉoj kie la maleata acido eksplodas senprobleme. Kiel instrueksperimento, kreitaj por mezuri la energian diferencon inter la cis- kaj trans-izomeroj, iu mezurita kvanto da karbono estas muelebla kune kun la respektiva kombinaĵo kaj la entalpio pri brulado komputiĝas per diferenco.
Biologio
[redakti | redakti fonton]Fumarata acido troviĝas en fumario[7], manĝeblaj boletoj, ĉefe la Boletus fomentarius var. pseudo-igniarius, likenoj kaj islandaj muskoj.
La fumarato estas peranto en la ciklo de la citrata acido uzata de la ĉeloj por produktado da energio laŭ la formo de ATP el la nutraĵoj. Ĝi estiĝas per oksidado de la sukcenato de la enzimo sukcenata malhidrogenazo. La fumarato tiam konvertiĝas de la enzimo fumarazo al maleato. La homa haŭto estigas fumaratan acidon kiam ekspoziciita al sunlumo[8].
Fumarato same produktiĝas dum la Ciklo de Ureo.
Uzo kiel nutraĵo
[redakti | redakti fonton]Kiel nutroaldonaĵo, uzata en Usono, Aŭstralio kaj Nov-Zelando, la fumarata acido uziĝas kiel acidokontrolanto kaj estas agnoskita de la E-numero 297. Fumarata acido estas nutroacidiganto uzata ekde 1946. Ĝenerale, ĝi estas uzata en trinkaĵoj kaj bakpulvoroj por kies uzo necesas alta grado de pureco. Kutime ĝi uzatas kiel substituanto de la tartrata acido kaj okaze kiel anstataŭanto de la citrata acido, kun grado je 1.36 g da citrata acido por ĉiu 0.91 gramoj de fumarata acido por aldoni acidecon, laŭmaniere kiel uziĝas la malikata acido. Krom esti komponanto en kelkaj artefaritaj gustigiloj por vinagroj, ĝi ankaŭ uzatas kiel koagulanto en porpudingaj miksaĵoj.
En pacientoj kun recidiva multobla sklerozo, la dumetila fumarato malpliigas sufiĉe la recidivon kaj malpermesis la pludaŭron de la malsano en trietapa provo. Ĝi aktivigas la efikon de la Nrf2 kontraŭoksida responso[9][10], la primara ĉeldefendo kontraŭ la citotoksajn efektojn de la oksidiva tensio.
Fumarata acido same uziĝas en la manufakturo de poliesteraj rezinoj kaj polihidrataj alkoholoj kaj kiel mordanto por tinkturo. La fumarata acido konvertiĝas en la irita maleata anhidrido pere de parta oksidado. Ĝi entute estas netoksa, tamen, altaj dozoj certe kaŭzas nefrotoksiĝon post longatempa uzado.
Komponaĵoj
[redakti | redakti fonton]Vidu ankaŭ
[redakti | redakti fonton]Referencoj
[redakti | redakti fonton]- ↑ Pubchem
- ↑ Handbook of Environmental Fate and Exposure Data For Organic Chemicals, Volume 5, Philip H. Howard
- ↑ Petrochemical Processes...., Alain Chauvel, Gilles Lefebvre
- ↑ Aqueous Organometallic Catalysis, Ferenc Joó
- ↑ Enzyme Catalysis in Organic Synthesis: A Comprehensive Handbook, Volume 1, Karlheinz Drauz
- ↑ Organic Chemistry, William Brown, Christopher Foote, Brent Iverson, Eric Anslyn
- ↑ The Chemist: A Monthly Journal of Chemical and Physical Science..., Volume 3
- ↑ Active Ingredients Used in Cosmetics: Safety Survey, Council of Europe. Committee of Experts on Cosmetic Products
- ↑ NCBI
- ↑ Redox and Cancer, Part 1