Amy Rosenzweig
| Amy Rosenzweig | ||
|---|---|---|
| Información personal | ||
| Nombre de nacimiento | Amy Claire Rosenzweig | |
| Nacimiento |
1967 Pittsburgh, Pennsylvania | |
| Nacionalidad | Estadounidense | |
| Educación | ||
| Educación | Doctorado | |
| Educada en | ||
| Posgrado | Amherst College, Instituto Tecnológico de Massachusetts | |
| Información profesional | ||
| Ocupación | Químico, Bioquímico | |
| Empleador | Universidad del Noroeste | |
| Distinciones |
| |
Amy C. Rosenzweig es una profesora de Química y Biociencias Moleculares en la Universidad del Noroeste.[1] Nació en 1967 en Pittsburgh, Pennsylvania. Se graduó en química en el Amherst College en 1988, y obtuvo su doctorado en el Instituto Tecnológico de Massachusetts (MIT) en 1994. En el MIT, Rosenzweig trabajó bajo la supervisión de Stephen J. Lippard y fue pionera en estudios sobre la estructura de los componentes de hidroxilasa presentes en la metano monooxigenasa de methyloccous capsulatus. Sus investigaciones incluyen la bología estructural y la química bioinorgánica, ingesta y transporte de metales, activación de oxígeno por metaloenzimas, y caracterización de proteínas de membranas. Su trabajo fue reconocido por distintos premios domésticos e internacionales, incluyendo el premio "Genio" de las becas MacArthur en 2003.
Oxidación biológica del metano
[editar]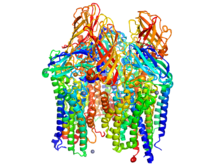
Rosenzeig determinó las estructuras moleculares de los catalistas principales de la oxidación del metano en la naturaleza. Las Metano monooxigenasas (MMO por sus siglas en inglés) son metaloenzimas que se encuentran en las bacterias metanotróficas. Estas enzimas pertenecen a la categoría de oxidoreductasas. Estas activan los enlaces de carbono-hidrógeno para instalar selectivamente oxígeno a su sustrato. Existen dos especies principales de MMOs—solubles (sMMO) y MMOs particuladas (pMMO). A pesar de que actúan en la misma reacción química, la estructura de estas dos enzimas, su estructura y mecanismo son significativamente distintas.
Desde el inicio de la década de 1990, Rosenzweig ha estudiado a las enzimas MMO en diversos sistemas biológicos. Ella y su equipo fueron los primeros en resolver la estructura cristalina de las MMO particuladas en 1993. En los años siguientes, ella hizo avances mayores para determinar la bioactividad y constitución química—incluyendo amplias contribuciones a las investigaciones sobre el sitio activo de coordinación metálica.[2][3]
El mecanismo propuesto actualmente para las sMMO involucra un complejo coordinado de Hierro (II) que se oxida dos veces para formar una especie de metaloperóxido. Esta especie experimenta entonces una reducción en la presencia de un sustrato de metano para poder pagar el alquil metanol. También se ha determinado la estructura cristalina del complejo proteínico de las sMMO.[3][4]

Actualmente, aún hay desconocimiento en las interacciones directas pMMO-sustrato, particularmente para diagnisticar un mecanismo complejo. De acuerdo con Rosenzweig, este problema elusivo sigue siendo "uno de los mayores problemas sin resolver en la química bioorgánica"[1]
Transporte de metales
[editar]En su trabajo con las pMMO, Rosenzweig elucidó la base molecular para manejar seguramente varios iones metálicos potencialmente tóxicos a través de la entrega directa entre compañeros proteínicos. Los metanótrofos secretan metanobactina. La metanobactina tiene una alta afinidad para quelarse con el cobre, y forma un complejo (CuMbn) que puede ser reinternalizado por la célula a través del transporte activo. Existen interacciones específicas entre CuMbn y las proteínas MbnT y MbnE. Estos resultados revelan mecanismos de reconocimiento y transporte de CuMbn.[2]
Funciones de Metaloproteínas
[editar]Rosenzeig determinó las estructoras de metaloproteínas importantes, ejerciendo influencia sostenida en el campo de la química bioinorgánica. Entre las proteínas cuya estructura determinó se encuentran E. coli Mn (II) 2-NrdF y Fe (II) 2-NrdF, que tienen diferentes sitios de coordinación. Esto sugiere distintos sitios iniciales de unión para los oxidantes durante la activación de cofactores en E. coli y nucleótidos.[5]
Palmarés
[editar]- Miembro electo, Academia Nacional de las Ciencias (Estados Unidos), 2017[6]
- Fellow, Academia Estadounidense de las Artes y las Ciencias, 2014[7]
- Royal Society of Chemistry Premio Joseph Chatt, 2014[8]
- Premio Ivano Bertini, 2014[9]
- American Chemical Society Nobel Laureate Signature Award for Graduate Education, 2006[10]
- Grado honorífico de Doctorado en Ciencias, Amherst College, 2005[11]
- MacArthur Fellow, 2003[1]
Obras
[editar]- Lieberman, R. L & Rosenzweig, A. C. "Crystal structure of a membrane-bound metalloenzyme that catalyses the biological oxidation of methane", Nature 2005, 434, 177-182.
- Lieberman, R. L., Kondapalli, K. C., Shrestha, D. B., Hakemian, A. S., Smith, S. M., Telser, J., Kuzelka, J., Gupta, R., Borovik, A. S., Lippard, S. J., Hoffman, B. M., Rosenzweig, A. C., & Stemmler, T. L. "Characterization of the particulate methane monooxygenase metal centers in multiple redox states by X-ray absorption spectroscopy". Inorg. Chem. 2006, 45, 8372-8381.
- Sazinsky, M. H., Mandal, A. L, Argüello, J. M., & Rosenzweig, A. C. "Structure of the ATP binding domain from the Archaeglobus fulgidus Cu1+-ATPase". J. Biol. Chem.. 2006, 281, 11161-11166.
- Yatsunyk, L. A. & Rosenzweig, A. C. "Copper binding and transfer by the N-terminus of the Wilson disease protein", J. Biol. Chem.. 2007, 282, 8622-8631.
- Rosenzweig, Lippard, "Structure and Biochemistry Methane Monooxygenase Enzyme Systems", Transition metals in microbial metabolism, Editors Günther Winkelmann, Carl J. Carrano, CRC Press, 1997, ISBN 978-90-5702-220-3
- Rosenzweig, Feng, Lippard, "Studies of Methane Monooxygenase and Alkane Oxidation Model Complexes", Applications of enzyme biotechnology, Editors Jeffery W. Kelly, Thomas O. Baldwin, Springer, 1991, ISBN 978-0-306-44095-3
Referencias
[editar]- ↑ a b c «Members of the Rosenzweig Lab». northwestern.edu (en inglés estadounidense). Universidad del Noroeste. Consultado el 13 de febrero de 2020.
- ↑ a b Sirajuddin, Sarah; Rosenzweig, Amy C. (14 de abril de 2015). «Enzymatic Oxidation of Methane». Biochemistry 54 (14): 2283-2294. ISSN 0006-2960. PMC 5257249. PMID 25806595. doi:10.1021/acs.biochem.5b00198.
- ↑ a b Rosenzweig, Amy C.; Frederick, Christin A.; Lippard, Stephen J.; P& Auml; Nordlund, R (9 de diciembre de 1993). «Crystal structure of a bacterial non-haem iron hydroxylase that catalyses the biological oxidation of methane». Nature (en inglés) 366 (6455): 537-543. Bibcode:1993Natur.366..537R. PMID 8255292. doi:10.1038/366537a0.
- ↑ Lawton, Thomas J; Rosenzweig, Amy C (1 de diciembre de 2016). «Biocatalysts for methane conversion: big progress on breaking a small substrate». Current Opinion in Chemical Biology. Energy Mechanistic Biology 35: 142-149. PMC 5161620. PMID 27768948. doi:10.1016/j.cbpa.2016.10.001.
- ↑ Boal, Amie K.; Cotruvo, Joseph A.; Stubbe, JoAnne; Rosenzweig, Amy C. (17 de septiembre de 2010). «Structural Basis for Activation of Class Ib Ribonucleotide Reductase». Science (en inglés) 329 (5998): 1526-1530. Bibcode:2010Sci...329.1526B. ISSN 0036-8075. PMC 3020666. PMID 20688982. doi:10.1126/science.1190187.
- ↑ «Amy Rosenzweig». National Academy of Sciences. Consultado el 22 de marzo de 2018.
- ↑ «Index of Active Members».
- ↑ «Joseph Chatt Award 2014 Winner». www.rsc.org (en inglés). Consultado el 5 de abril de 2018.
- ↑ «Amy C. Rosenzweig CV». October 2017.
- ↑ «Nobel Laureate Signature Award for Graduate Education in Chemistry - American Chemical Society». American Chemical Society (en inglés). Consultado el 22 de marzo de 2018.
- ↑ «Honorary Degrees & Awards | Recipients by Name | Amherst College». www.amherst.edu (en inglés). Archivado desde el original el 10 de septiembre de 2017. Consultado el 23 de marzo de 2018.
Enlaces externos
[editar]- "Amy Rosenzweig" Archivado el 17 de marzo de 2009 en Wayback Machine., Faculty of 1000
- Esta obra contiene una traducción derivada de «Amy Rosenzw» de Wikipedia en inglés, concretamente de esta versión del 20 de noviembre de 2021, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.