Cloruro de sulfurilo
| Cloruro de sulfurilo | ||
|---|---|---|
 | ||
 | ||
 | ||
| General | ||
| Otros nombres |
Dicloruro de sulfurilo Cloruro de sulfonilo Cloruro de óxido de azufre. | |
| Fórmula semidesarrollada | ClS(Cl)(=O)=O | |
| Fórmula estructural | SO2Cl2 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7791-25-5[1] | |
| ChEMBL | CHEMBL3186735 | |
| ChemSpider | 23050 | |
| PubChem | 24648 | |
| Propiedades físicas | ||
| Apariencia | Incoloro a amarillo, de olor acre, vira a amarillo por exposición al aire y a la luz. | |
| Densidad | 1670 kg/m³; 1,67 g/cm³ | |
| Masa molar | 134,96 g/mol | |
| Punto de fusión | −54.1 | |
| Punto de ebullición | 69,4 °C (343 K) | |
| Presión de vapor | 14.8 kPa a 20º | |
| Índice de refracción (nD) | 1.4437[2] | |
| Propiedades químicas | ||
| Solubilidad | miscible con benceno, tolueno, cloroformo, CCl4, ácido acético glacial | |
| Peligrosidad | ||
| NFPA 704 |
0
3
2
W
| |
| Frases R | R14, RR34, RR37 | |
| Frases S | SS1/2, SS26, SS30, SS45 | |
| Riesgos | ||
| Inhalación | Sensación de quemazón. Tos. Dificultad respiratoria. Jadeo. Dolor de | |
| Piel | Enrojecimiento. Quemaduras cutáneas. Dolor. Ampollas. | |
| Ojos | Enrojecimiento. Dolor. Pérdida de visión. Quemaduras profundas graves. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cloruro de sulfurilo es un compuesto inorgánico de fórmula SO2Cl2.[3] A temperatura ambiental es un líquido incoloro de olor acre. No se encuentra en la naturaleza debido a su rápida hidrolización.
Es frecuentemente confundido con el cloruro de tionilo, SOCl2, sin embargo las propiedades de estos dos compuesto son muy diferentes. El cloruro de sulfurilo es una fuente de cloro mientras que el cloruro de tionilo es una fuente de iones de cloruro.
La IUPAC recoge como nombre alternativo dicloruro de sulfurilo.
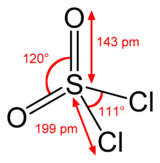
Estructura
[editar]La estructura del azufre es tetraédrica en SO2Cl2 y el estado de oxidación del átomo de azufre es +6, como en el ácido sulfúrico H2SO4.
Síntesis
[editar]El SO2Cl2 se obtiene por reacción entre el dióxido de azufre y cloro en presencia de un catalizador, como el carbón activo.[4]
- SO2 + Cl2 → SO2Cl2
El producto obtenido puede purificarse por destilación fraccionada.
El cloruro de sulfurilo fuo obtenido por primera vez en 1838 por el químico francés Henri Victor Regnault.[5]
Reacciones
[editar]El cloruro de sulfurilo reaciona con el agua, liberando cloruro de hidrógeno gas y ácido sulfúrico:
- SO2Cl2 + 2 H2O → 2 HCl + H2SO4
Además, el SO2Cl2 se descompone cuando es calentado hasta los 100 °C o por encima, aproximadamente a unos 30 °C sobre su punto de ebullición.
Al almacenarse se descompone en dióxido de azufre y cloro gas, lo que le da a las muestras antiguas un color ligeramente amarillento.[4]
Usos
[editar]El cloruro de sulfurilo es usado a menudo como una fuente de Cl2. Debido a que es un líquido vertible se considera más cómodo de dispensar que el Cl2. El SO2Cl2 se utiliza ampliamente como reactivo para la conversión de C-H → C-Cl adyacentes en la activación de sustituyentes como carbonilos y sulfóxidos. También se usa en la cloración de alcanos, alquenos, alquinos, compuestos aromáticos y epóxidos, reacciones que ocurren en la presencia de radicales libres y que requieren el empleo de algún iniciador como el AIBN. También se puede usar para convertir disulfuros en sus correspondientes cloruros de sulfenilo.[6] El SO2Cl2 también puede convertir alcoholes en cloruros de alquilo y, en la industria, se utiliza sobre todo en la producción de pesticidas.
El SO2Cl2 también se emplea para tratar la lana y prevenir que encoja.
Precauciones
[editar]SO2Cl2 es tóxico, corrosivo, y actúa como un gas lacrimógeno. Puede formar humo tóxico al mezclarse con agua, así como con disolventes donantes, tales como DMSO y DMF.
Referencias
[editar]- ↑ Número CAS
- ↑ Patnaik, P. (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8.
- ↑ «Wayback Machine». web.archive.org. 28 de febrero de 2007. Archivado desde el original el 28 de febrero de 2007. Consultado el 10 de enero de 2023.
- ↑ a b F. Fehér (1963). «Sulfuryl Chloride». En G. Brauer, ed. Handbook of Preparative Inorganic Chemistry, 2nd Ed. 1. NY,NY: Academic Press. pp. 382-384.
- ↑ Regnault, Victor (1838). «Sur l'acide chlorosulfurique et la sulfamide» [On sulfuryl chloride and sulfamide]. Annales de Chimie et de Physique. Série 2 (en francés) 69: 170-184.
- Reprinted as: Regnault, Victor (1839). «Ueber die Chlorschwefelsäure und das Sulfamid» [On sulfuryl chloride and sulfamide]. Journal für Praktische Chemie (en alemán) 18: 93-104. doi:10.1002/prac.18390180104.
- ↑ Page, P. C. B.; Wilkes, R. D.; Reynolds, D. (1995). «Alkyl Chalcogenides: Sulfur-based Functional Groups». En Ley, Steven V., ed. Synthesis: Carbon with One Heteroatom Attached by a Single Bond. Comprehensive Organic Functional Group Transformations. Elsevier. pp. 113–276. ISBN 9780080423234.
Otras lecturas
[editar]- (2002) "[4+3] Cycloaddition in Water. Synthesis of 2,4-endo,endo-Dimethyl-8-Oxabicyclo[3.2.1]oct-6-en-3-one". Org. Synth. 79: 251.
- McKee, R. H.; Salls, C. M. (1924). «Sulfuryl Chloride». Industrial and Engineering Chemistry 16 (4): 351-353. doi:10.1021/ie50172a008.
- Moussa, V. N. (2012). «Sulfuryl Chloride: A Versatile Alternative to Chlorine». Australian Journal of Chemistry 65 (1): 95-96. doi:10.1071/CH11367.
- North, H. B. (1910). «The Action of Thionyl and Sulphuryl Chlorides on Mercury and Mercury Oxide». Journal of the American Chemical Society 32 (2): 184-187. doi:10.1021/ja01920a004.
- North, H. B.; Hageman, A. G. (1913). «Some New Reactions with Thionyl Chloride». Journal of the American Chemical Society 35 (5): 543-546. doi:10.1021/ja02194a004.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Sulfuryl chloride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
