Hipótesis del ciclol

La hipótesis del ciclol es una teoría científica obsoleta considerada el primer modelo estructural creado para describir el plegamiento de una proteína globular.[1] Fue propuesta por la matemática inglesa Dorothy Wrinch a finales de los años 1930 basándose en tres premisas. Primera, la hipótesis asume que dos grupos peptídicos pueden unirse mediante la reacción del ciclol, formando enlaces covalentes análogos a enlaces de hidrógeno. Estas reacciones fueron observadas en los ergopéptidos y otros compuestos. En segundo lugar asume que, en determinadas condiciones, los aminoácidos tienden naturalmente a formar el máximo número posible de «enlaces ciclol», dando lugar a moléculas de cicloles y estructuras de cicloles. Ambas estructuras hipotéticas no han sido nunca observadas. Finalmente, la hipótesis supone que las proteínas globulares tienen una estructura terciaria que se corresponde con los sólidos platónicos y los poliedros semirregulares formados por estructuras de ciclol sin bordes libres. Estos «cicloles cerrados» tampoco han sido observados experimentalmente.
Aunque los datos experimentales obtenidos en el laboratorio demostraron que este modelo no se corresponde con la realidad, algunos de sus elementos, como la reacción del ciclol y la hipótesis de la interacción hidrófoba, son parte fundamental del plegamiento de proteínas. La hipótesis del ciclol abrió el camino a la investigación de muchos científicos en torno a la estructura de las proteínas y su reactividad y fue la precursora de los modelos hipotéticos de la doble hélice de ADN y la estructura secundaria de las proteínas. La propuesta de Wrinch y la comprobación del modelo se consideran, en la literatura científica, un ejemplo excelente de aplicación del falsacionismo empírico como parte del método científico.
Contexto histórico
[editar]A mediados de los años 1930 los estudios de ultracentrifugación analítica de Theodor Svedberg mostraron que las proteínas poseían una estructura química definida y no eran un conjunto de pequeñas moléculas.[2] Los mismos estudios aparentemente mostraban que el peso molecular de las proteínas podían clasificarse en unos grupos bien definidos por números enteros,[3] como Pmolecular = 2p3q uma, donde p y q eran enteros y positivos.[4] Sin embargo, resultaba complicado determinar el peso molecular exacto y el número de aminoácidos de una proteína. Svedberg también demostró que un cambio de las condiciones de la disolución podía causar que la proteína se desintegrase en unidades menores, un hecho que no parecía coincidir con lo conocido acerca de la estructura cuaternaria.[5]
En aquella época todavía se discutía acerca de la estructura química de las proteínas.[6] La hipótesis más aceptada, y que después se demostraría correcta, es que las proteínas eran polipéptidos lineares, esto es, polímeros no ramificados de aminoácidos unidos por enlace peptídico.[7][8] No obstante, una proteína típica es un polímero muy largo, formado por cientos de aminoácidos, por lo que bastantes científicos distinguidos discutían si una macromolécula tan larga y lineal podía ser estable en disolución.[9][10] Además, la observación experimental de que algunas enzimas eran capaces de romper proteínas pero no péptidos, mientras que otras dividían péptidos pero no proteínas plegadas provocaba serias dudas.[11] Los intentos de síntesis de proteínas en tubos de ensayo fueron fallidos, debidos principalmente a la quiralidad de los aminoácidos, pues las proteínas naturales están compuestas exclusivamente de aminoácidos levógiros. Todas estas dudas hicieron que se considerasen otros modelos de proteínas, como la «hipótesis de la dicetopiperacina» de Emil Abderhalden.[12][13] Sin embargo, ningún modelo alternativo fue capaz de explicar por qué las proteínas liberaban solo aminoácidos y péptidos por hidrólisis y proteólisis. Como clarificó Linderstrøm-Lang,[14] estos datos experimentales mostraban que las proteínas desnaturalizadas eran polipéptidos, pero no aportaban información acerca de la estructura o el plegamiento de estas macromoléculas, pues la desnaturalización podía provocar una transformación química que convirtiese en polipéptidos sencillos a las proteínas.
Los procesos de desnaturalización de proteínas, una vez diferenciados de la coagulación, fueron descubiertos en 1910 por Harriette Chick y Charles Martin,[15][16][17][18] pero su naturaleza exacta seguía siendo un misterio. Tim Anson y Alfred Mirsky demostraron que la desnaturalización era un «proceso reversible en dos fases»[19] que daba como resultado que muchos grupos funcionales anteriormente plegados estuvieran disponibles para reaccionar, incluyendo la posibilidad de que una enzima cortase la cadena.[20] En 1929, Hsien Wu propuso correctamente que la desnaturalización se producía por el despliegue de las proteínas, un cambio puramente conformacional que provocaba la exposición de las cadenas de aminoácidos al disolvente o a otros reactivos.[21] La hipótesis de Wu fue también propuesta independientemente en 1936 por Mirsky y Linus Pauling.[22] No obstante, los científicos no podían todavía excluir la posibilidad de que la desnaturalización fuera un cambio «químico» en la estructura de la proteína,[20] una hipótesis que fue considerada verosímil, aunque remota, hasta los años 1950.[23][24]

La cristalografía de rayos X comenzó como disciplina en 1911[25] y había avanzado rápidamente desde el estudio de cristales de sales sencillas a moléculas más complejas, como el colesterol.[26] Sin embargo, hasta la proteína más pequeña tiene al menos mil átomos, lo que hace que su determinación estructural sea mucho más compleja. En 1934, Dorothy Crowfoot Hodgkin[27] obtuvo datos cristalográficos de la estructura de una proteína pequeña, la insulina, aunque su estructura final no fue elucidada hasta finales de los años 1960.[28] Sin embargo, los primeros datos de difracción de fibras con rayos X de escleroproteínas (proteínas con estructura de fibra) naturales como la lana o el pelo fueron obtenidos a principios de los años 1930 por William Astbury,[29] que propuso algunos modelos rudimentarios para la estructura secundaria, como la presencia de hélices alfa y beta-láminas.[30]
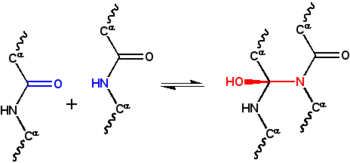
Del mismo modo que la estructura proteica estaba poco estudiada en la década de 1930, las interacciones físicas responsables de la estabilización de la estructura resultaban un misterio. Astbury propuso que la estructura de las proteínas fibrosas se estabilizaba mediante enlaces de hidrógeno en las láminas β.[31][32] La idea de que las proteínas globulares también se estabilizaban por puntes de hidrógeno fue propuesta por Dorothy Jordan Lloyd[33][34] en 1932, y defendida posteriormente por Mirsky y Pauling.[22] En una conferencia de Astbury en 1933 a la Oxford Junior Scientific Society, el físico Frederick Frank sugirió que la alfa-queratina, una escleroproteína, podría estabilizarse gracias a un mecanismo alternativo, la interacción covalente entre los enlaces peptídicos según la reacción del ciclol.[35] Esta estructura de cicloles permite que los dos grupos peptídicos se coloquen cerca (los átomos de nitrógeno y carbono se situarían a ~1.5 Å, mientras que mediante enlaces de hidrógeno se sitúan a ~3 Å). Considerando la propuesta de Frank, J. D. Bernal sugirió a la matemática Dorothy Wrinch que explorase esta posibilidad para entender la estructura de las proteínas.[36]
Teoría
[editar]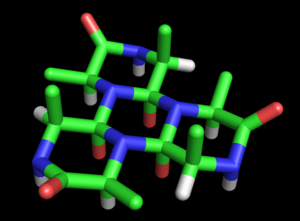
Dorothy Maud Wrinch propuso un modelo completo para explicar la estructura de las proteínas basado en la hipótesis del ciclol. El modelo básico del ciclol apareció por primera vez en un artículo de 1936.[37] En él, Wrinch muestra que los polipéptidos pueden formar ciclos (hipótesis que se demostró correcta) y que estos anillos pueden presentar interacciones enlazantes internas mediante la reacción del ciclol, hipótesis que es cierta, pero que después se demostró infrecuente en las proteínas. Asumiendo que la forma de ciclol del enlace peptídico puede ser más estable que en forma de amida, Wrinch concluyó que ciertos péptidos cíclicos formarán el máximo número posible de enlaces tipo ciclol (como el ciclol 6, en la figura). Estas moléculas tipo ciclol tendrían simetría hexagonal si los enlaces químicos tienen la misma longitud, aproximadamente 1.5 Å; en comparación, los enlaces nitrógeno-carbono y C-C tienen una longitud de 1.42 Å y 1.54 Å, respectivamente.[38]
Estos anillos pueden extenderse indefinidamente para formar una estructura de cicloles, que muestran un orden extenso y casi cristalino que Wrinch propuso como adecuado para englobar cientos de residuos de aminoácidos, como en el caso de una proteína.[39] Además, sus cadenas laterales apuntan axialmente hacia arriba solo desde una cara, es decir, una de las caras de la estructura es completamente independiente de la estructura primaria del péptido, lo que podría explicar las propiedades independientes de la secuencia de la cadena que muestran las proteínas.[37]
En su artículo inicial, Wrinch expone claramente que el modelo del ciclol es simplemente una «hipótesis de trabajo», una hipótesis potencialmente válida que debía contrastarse con los datos empíricos. Su éxito radica en proponer un modelo bien definido y examinable, de tal manera que se podía utilizar para predecir resultados experimentales. Sin embargo, los experimentos realizados en los años siguientes demostraron que la hipótesis del ciclol no era válida para las proteínas globulares.[38]
Energía de estabilización
[editar]En dos cartas conjuntas al director (1936),[40][41] Wrinch y Frank contestan a la pregunta de si la forma de ciclol para el grupo peptídico es más estable que la forma de amida. Las amidas se forman a partir de los grupos amino de los aminoácidos según los siguientes mecanismos:
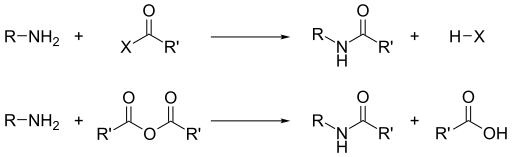
Además, las amidas están fuertemente estabilizadas por efecto mesómero: el par de electrones libres del nitrógeno se desolocaliza en el carbonilo, formando un doble enlace parcial. La acetamida resultante es descrita a la vez por las dos formas resonantes, colaborando la primera en un 62 % y la segunda en un 28 %.[42]

Un cálculo relativamente simple muestra que la forma de ciclol es significativamente menos estable que la amida, por lo que el modelo debería haber sido abandonado hasta identificar un efecto que compensase la energía. Inicialmente Frank propuso que la forma de ciclol podía estabilizarse por sus interacciones con el disolvente; posteriormente, Wrinch y Irving Langmuir presentaron la hipótesis de que la interacción hidrofóbica de las cadenas laterales, apolares, proporciona la suficiente energía de estabilización para compensar el coste energético de los cicloles.[43][44]

La labilidad del enlace del ciclol se consideró una «ventaja» del modelo, puesto que proporcionaba una explicación directa para la desnaturalización: la reversión de los cicloles a las amidas, más estables, abría la estructura y permitía que los enlaces fueran atacados por proteasas, datos a priori consistentes con los resultados experimentales.[45][46] Los primeros estudios mostraron que las proteínas desnaturalizadas por presión se encontraban frecuentemente en un estado diferente a las mismas proteínas desnaturalizadas por alta temperatura, lo que fue interpretado como una confirmación del modelo del ciclol.[47]
La hipótesis de Langmuir y Wrinch de la estabilización hidrofóbica fue desestimada al mismo tiempo que la hipótesis del ciclol, debido principalmente a la influencia de Linus Pauling, defensor de la estabilización por enlaces de hidrógeno.[48] Tuvieron que pasar veinte años para que las interacciones hidrofóbicas fueran reconocidas como los agentes principales del plegamiento en las proteínas.[49]
Complementariedad estérica
[editar]En su tercer artículo sobre los cicloles, (1936),[50] Wrinch hace notar que muchas sustancias «fisiológicamente activas», como los esteroides estaban formadas por anillos de carbono hexagonales, derivados del benceno, que podían actuar como complementos estéricos de la cara de las estructuras de cicloles sin cadenas laterales de aminoácidos. Wrinch presentó esta complementariedad como uno de los factores predominantes para determinar si una molécula pequeña podía enlazarse con moléculas semejantes formando una proteína.
En el mismo artículo especula, acertadamente, sobre cómo las proteínas debían ser las responsables de la síntesis de todas las moléculas biológicas. Observando que las células solo digieren sus proteínas en condiciones de hambre extrema, propuso que la vida no podría existir sin proteínas.[38]
Modelos híbridos
[editar]Desde el principio la reacción del ciclol fue considerada un análogo covalente del enlace de hidrógeno, por lo que era normal considerar modelos híbridos con ambos tipos de enlaces. Este fue el tema del cuarto artículo de Wrinch sobre el modelo del ciclol (1936),[51] escrito conjuntamente con Dorothy Jordan Lloyd, que propuso en un principio que las moléculas globulares se estabilizaban por enlaces de hidrógeno.[33] Le siguió un nuevo artículo, escrito en 1937, que incluía las investigaciones acerca del enlace de hidrógeno en proteínas, como las de Maurice Loyal Huggins y Linus Pauling.[52]
Wrinch también escribió un artículo con William Astbury, presentando la posibilidad de que la tautomería ceto-enólica del >CαHα y el carbonilo de un grupo amida >C=O, formaran un enlace mixto >Cα-C(OHα)< dejando libre un oxígeno para el grupo hidroxilo.[53] El mecanismo general de la tautomería ceto-enólica es el siguiente:
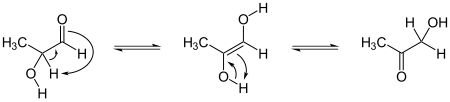
Estas reacciones pueden producir anillos de cinco átomos, mientras que la hipótesis del ciclol clásica los forma siempre de seis eslabones. Esta hipótesis pronto cayó en el olvido.[54]
Estructuras tridimensionales
[editar]
En su quinto artículo sobre los cicloles (1937),[55] Wrinch identificó las condiciones bajo las cuales dos estructuras tipo ciclol planas podían unirse para formar un nuevo ángulo entre sus planos respetando sus ángulos de enlace. En el artículo propone una simplificación matemática, en la que anillos de seis eslabones no planos pueden ser asimilados a medios hexágonos construidos por los puntos medios de los enlaces químicos. Esta representación de «medios hexágonos» permite que los planos de estructuras de cicloles se unan correctamente si el ángulo diedro entre los planos se iguala al ángulo tetraédrico, δ = arccos(-1/3) ≈ 109.47°.
Usando este mismo criterio se pueden proponer una gran cantidad de poliedros, entre los cuales los más simples son el tetraedro truncado, el octaedro truncado y el octaedro, que son sólidos platónicos y poliedros semirregulares. Considerando la primera serie de «cicloles cerrados», aquellos modelados a partir del tetraedro truncado, Wrinch demostró que el número de aminoácidos crecía de forma cuadrática según la expresión 72n2, donde n es el índice del ciclol Cn. De esta forma, el ciclol C1 tiene 72 residuos, el C2 288 residuos, etcétera. Los experimentos preliminares de Max Bergmann y Carl Niemann parecían confirmar esta hipótesis,[4] pues sugerían que las proteínas estaban compuestas por múltiplos enteros de 288 aminoácidos (correspondiente a n = 2). Más generalmente, el modelo del ciclol para proteínas globulares era consistente con los datos experimentales obtenidos por ultracentrifugación por Theodor Svedberg, lo que sugería que el peso molecular de las proteínas podía asimilarse a unas pocas clases de números enteros.[2][3]
El modelo del ciclol se mostró consistente con las propiedades características que presentan las proteínas plegadas.[56] En primer lugar, los estudios mediante centrifugación concluyeron que las proteínas plegadas eran significativamente más densas que el agua (~1.4 g/mL), por lo que debían estar firmemente empaquetadas; Wrinch asumió que un empaquetado denso implicaba una estructura regular. En segundo lugar, a pesar de su gran tamaño, algunas proteínas cristalizaban rápidamente formando cristales simétricos, un hecho consistente con la idea de caras simétricas capaces de encajar entre sí. En tercer lugar, algunas proteínas, como la hemoglobina, pueden formar enlaces organometálicos; como los metales de transición presentan geometrías de enlace específicas y regulares (por ejemplo octaédricas), se veía razonable que la proteína globalmente tuviera una estructura geométrica similar. En cuarto lugar, la hipótesis del ciclol proporciona una explicación químicamente simple para la desnaturalización y la dificultad de romper proteínas plegadas mediante proteasas. En quinto lugar, se suponía que las proteínas eran las responsables de la síntesis de todas las moléculas biológicas, incluyendo otras proteínas. Wrinch observó que una estructura uniforme podía ser muy útil para la síntesis de otras proteínas, análogamente al modelo de autorreplicación del ADN propuesto por Watson y Crick. Dado que muchas moléculas biológicas como los carbohidratos y los esteroles tienen una estructura hexagonal, se podía asumir que las proteínas que los sintetizaban también tenían una estructura hexaédrica. Wrinch finalmente resumió su modelo y los datos experimentales que parecían confirmarlo en tres artículos.[57][58][59]
Predicción de estructuras
[editar]Tras haber propuesto un modelo verosímil para el plegamiento de las proteínas globulares, Wrinch investigó si era consistente con los datos estructurales disponibles en aquel tiempo. Entre 1937 y 1939 propuso la posibilidad de que la proteína tuberculina bovina (523) fuera un ciclol cerrado C1 de 72 residuos[60] y que la pepsina, una enzima digestiva descubierta en 1836 por Theodor Schwann[61] y cristalizada en 1929 por John H. Northrop,[62] fuera un ciclol cerrado C2 de 288 aminoácidos.[63][64] Con los métodos conocidos en la década de 1930 resultaba altamente complicado e inexacto medir la masa de las proteínas, por lo que no se disponía de suficientes datos experimentales para contrastar sus hipótesis.
Con el mismo modelo, Wrinch también predijo que la estructura de la insulina correspondía a un C2, usando los escasos datos de cristalografía de rayos X disponibles entonces para confirmar su propuesta.[65][66][67][68][69][70] Sin embargo, esta interpretación fue muy criticada por prematura.[71][72][73] Estudios exhaustivos de los diagramas de Patterson de la insulina realizados por Dorothy Crowfoot Hodgkin mostraron que su estructura se ajustaba con cierta dificultad al modelo del ciclol, pero no eran lo suficientemente concluyentes como para confirmar definitivamente la teoría.[74][75][76]
Desestimación
[editar]
Las estructuras de tipo ciclol se consideraron no verosímiles por varias razones. Hans Neurath y Henry Bull demostraron que el denso empaquetado de las cadenas laterales de los cicloles eran inconsistentes con la densidad experimental observada en películas proteínicas.[77] Maurice Huggins calculó que bastantes de los átomos no enlazados de las estructuras de cicloles estaban más cerca de lo que permiten los radios de van der Waals; por ejemplo, el Hα interior y el Cα de los espacios intramoleculares estarían separados por solo 1.68 Å, una longitud ligeramente menor del radio de van der Waals medio del carbono, de 1.70 Å.[78] Por su parte, Haurowitz demostró químicamente que el exterior de las proteínas no podía albergar un gran número de grupos hidroxilos, una de las claves del modelo del ciclol,[79] mientras que Meyer y Hohenemser demostraron que las condensaciones de tipo ciclol de los aminoácidos simplemente no existían en las proteínas naturales ni siquiera en los estados de transición.[80]
Bergmann y Niemann proporcionaron más argumentos químicos en contra de la hipótesis del ciclol,[81] como hizo también Neuberger.[82][83] Los datos obtenidos mediante espectroscopia de infrarrojo mostraban que el número de grupos carbonilo presentes en una proteína no cambiaban tras una hidrólisis,[84] y que las proteínas plegadas e intactas contenían grupos amida-carbonilo complementarios;[85] ambas observaciones contradicen la hipótesis del ciclol de que los carbonilos se transforman en hidroxilos en las proteínas plegadas.
Finalmente, se descubrió que las proteínas contienen prolina en cantidades significativas (típicamente un 5 %); ya que la prolina no dispone de un átomo de hidrógeno en un grupo amida y el nitrógeno existente forma ya tres enlaces covalentes, es incapaz de actuar según la reacción del ciclol y, por lo tanto, no puede incorporarse a una estructura de cicloles. Todos los argumentos químicos y estructurales en contra de la hipótesis del ciclol fueron resumidos por Pauling y Niemann en 1939.[86] Además, el mismo año se demostró que uno de los datos experimentales fundamentales para confirmar la hipótesis del ciclol, la afirmación de que todas las proteínas contenían un múltiplo entero de 288 aminoácidos,[4] era errónea.[87]
Wrinch respondió a todas estas cuestiones en varios artículos. Respecto a los impedimentos estéricos por excesiva cercanía de los átomos, propuso que pequeñas deformaciones en los ángulos y longitudes de enlace podían aliviar los impedimentos o al menos reducirlos a un nivel razonable.[88] También destacó que las distancias entre dos grupos no enlazados en una misma molécula pueden ser menores de lo esperado según sus radios de van der Waals, como la distancia de 2.93 Å entre los grupos metilo en el hexametilbenceno. Respecto a los niveles de energía, Wrinch se mostró en desacuerdo con los cálculos de Pauling y recordó que se sabía demasiado poco acerca de las energías intramoleculares en macromoléculas como para descartar a priori la hipótesis del ciclol.[88]
Respecto a los argumentos químicos en contra de su hipótesis, propuso que las reacciones bimoleculares simples estudiadas no tenían que corresponder necesariamente con las estructuras de cicloles, pues los impedimentos estéricos podrían haber impedido la reactividad de los grupos hidroxilo.[89]
Respecto al cálculo del número de aminoácidos por proteína, Wrinch amplió su modelo original para permitir otros números enteros de aminoácidos. En particular, introdujo un ciclol cerrado mínimo de sólo 48 residuos,[90] a partir del cual predijo, incorrectamente, que el monómero de insulina tendría un peso molecular de aproximadamente 6000 uma.[91][92]
A pesar de todas las críticas, Wrinch mantuvo que la hipótesis del ciclol para proteínas globulares era potencialmente viable[93][94] e incluso propuso una estructura de cicloles para el citoesqueleto.[95] Sin embargo, la mayoría de los científicos dedicados al estudio de las proteínas dejaron de considerar el modelo como verosímil y Wrinch se dedicó a resolver cuestiones matemáticas relacionadas con la cristalografía de rayos X, disciplina en la que consiguió contribuciones notables.[96]
Una excepción fue el médico Gladys Anslow, colega de Wrinch en el Smith College, que estudió los espectros de absorción ultravioleta de numerosos péptidos y proteínas en la década de 1940 considerando el modelo del ciclol como una de las soluciones.[97][98] Cuando se determinó la secuencia de la insulina por parte de Frederick Sanger, Anslow propuso un modelo tridimensional de cicloles con cadenas laterales,[99] basado en el «ciclol mínimo» descrito por Wrinch en 1948.[90]
Redención parcial
[editar]
La desestimación de todo el modelo del ciclol llevó al rechazo de todos sus elementos, excepto la breve aceptación por parte de J. D. Bernal de la hipótesis planteada por Langmuir y Wrinch de que el plegamiento de las proteínas se debía a la interacción hidrofóbica.[101] A pesar de esto, se identificaron enlaces de cicloles naturales en péptidos cíclicos en la década de 1950.[38]
Actualmente, se considera que la reacción clásica del ciclol consiste en la adición de un grupo amina NH procedente de un enlace peptídico que se une a un carbonilo C=O de otro aminoácido. El compuesto resultante se denomina azaciclol. Por analogía, un oxaciclol se forma cuando el OH de un hidroxilo se une al carbonilo y un tiociclol cuando el grupo que se une es un SH.[102]
El oxaciclol alcaloide ergotamina, extraído del hongo Claviceps purpurea fue el primer ciclol natural identificado.[103] La serratamilida, un depsipéptido cíclico, también se forma mediante la reacción del oxociclol.[104] También se han obtenido tiocicloles químicamente análogos,[105] mientras que los clásicos azacicloles han sido observados en pequeñas moléculas[106] y tripéptidos.[107][108][109]
Se pueden formar péptidos naturalmente por reversión de los azacicloles,[110][111][112] uno de los aspectos clave en la hipótesis del ciclol.
En la actualidad se han identificado cientos de moléculas de tipo ciclol, a pesar del cálculo de Linus Pauling de que esas moléculas no podrían existir por estar termodinámicamente desfavorecidas, al ser de alta energía.[86]
Tras un largo periodo en el que trabajó principalmente en los aspectos matemáticos de la cristalografía de rayos X, en 1957 Wrinch recogió los nuevos descubrimientos sobre cicloles y renovó el modelo teórico propuesto veinte años antes.[113][114][115][116][117] También publicó dos libros en los que describió de nuevo la hipótesis del ciclol y los pequeños péptidos en general.[118][96]
Ilustración del método científico
[editar]La hipótesis del ciclol para la estructura de las proteínas es un ejemplo de la aplicación del falsacionismo empírico como parte del método científico. Se propone una hipótesis original para explicar observaciones experimentales; se desarrollan las consecuencias de esta hipótesis y sus predicciones son comprobadas en laboratorio. En este caso la hipótesis central era que la forma de ciclol del grupo peptídico estaba favorecida frente a la amida. Esta propuesta conllevó las predicciones acerca de la molécula de ciclol-6 y de la estructura de cicloles, que a su vez sugerían el modelo de poliedros semirregulares para las proteínas globulares. El estudio experimental debía demostrar si los grupos carbonilo de la proteína se transformaban masivamente en hidroxilos. Sin embargo, los datos químicos y espectroscópicos demostraron que la estructura era incorrecta.[96] El modelo del ciclol también predecía una alta densidad lateral de aminoácidos en las proteínas plegadas y en película, que no se observó experimentalmente. Debido a estos factores, la hipótesis fue desestimada y se buscaron alternativas, como la estructura de alfa hélice propuesta en las décadas de 1940 y 1950.[119]
Algunos autores han argumentado que la hipótesis del ciclol nunca debió ser considerada[120] debido a sus defectos de partida, v.gr. los impedimentos estéricos, la imposibilidad de acomodar la prolina y la energía desfavorable de la reacción en sí.[38] Sin embargo, la opinión general es que, si bien estos defectos la hacían poco verosímil, no la convertían en imposible. El modelo de cicloles fue la primera estructura bien definida propuesta para proteínas globulares y, cuando se presentó, se conocían demasiados pocos aspectos de las fuerzas intramoleculares y de la estructura de macromoléculas como para descartarla inmediatamente. Era capaz de explicar la mayoría de las propiedades generales de las proteínas y se ajustaba a los datos experimentales, que después se revelaron inexactos. Aunque se demostró incorrecta, algunos elementos de la teoría del ciclol fueron eventualmente verificados, como la propia reacción y el papel de las interacciones hidrofóbicas en el plegamiento de proteínas. Es, en cierto modo,[38] comparable al modelo de Bohr para el átomo de hidrógeno, que desde el principio se sabía inexacto, incluso por parte de su creador,[121][122][123][124] pero aun así ayudó decisivamente al desarrollo de la mecánica cuántica. De forma similar, el modelo para el ADN propuesto por Linus Pauling,[125] que, al igual que el ciclol, resultó erróneo pero actuó como aliciente para el trabajo de otros investigadores.[126][127] La historia de toda la hipótesis del ciclol es un ejemplo de cómo el conocimiento científico se desarrolla proponiendo hipótesis, comprobándolas y descartando las erróneas.
Curiosamente, el modelo del ciclol es un ejemplo de cómo una teoría científica de gran simetría y belleza, dos cualidades que suelen caracterizar a las teorías científicas «obviamente ciertas», se revela errónea. Por ejemplo, la doble hélice de Watson y Crick como modelo para el ADN[127] es un modelo «obvio» por sus enlaces de hidrógeno y simetría, mientras que otras estructuras mucho menos simétricas están favorecidas en condiciones diferentes.[128] También la teoría de la relatividad general fue considerada una hipótesis tan «elegante» que para Albert Einstein no parecía necesitar verificación experimental, aunque tuvo que revisarse para hacerla consistente con la teoría cuántica de campos.[129] El ejemplo de la hipótesis del ciclol ilustra cómo todas las teorías científicas, incluso las más elegantes, deben ser verificadas empíricamente y nunca ser consideradas ciertas a priori.[130]
Véase también
[editar]- La estructura de las revoluciones científicas.
- La lógica de la investigación científica, de Karl Popper.
Referencias
[editar]- ↑ Tiselius, A (1939). «The Chemistry of Proteins and Amino Acids». Annual Review of Biochemistry 8: 155-184. doi:10.1146/annurev.bi.08.070139.001103.
- ↑ a b Svedberg, T (1929). «Mass and size of protein molecules». Nature 123: 871. doi:10.1038/123871a0.
- ↑ a b Svedberg, T (1934). «Sedimentation of molecules in centrifugal fields». Chemical Reviews 14: 1-15. doi:10.1021/cr60047a001.
- ↑ a b c Bergmann, M; Niemann C (1937). «On the structure of proteins: cattle hemoglobin, egg albumin, cattle fibrin, and gelatin». Journal of Biological Chemistry 118: 301-314.
- ↑ Svedberg, T (1930). «The pH Stability Regions of Proteins». Transactions of the Faraday Society 26: 741-744.
- ↑ Fruton, JS (1979). «Early theories of protein structure». Ann. N.Y. Acad. Sci. 325: 1-18. doi:10.1111/j.1749-6632.1979.tb14125.x.
- ↑ Hofmeister, F (1902). «Über Bau und Gruppierung der Eiweisskörper». Ergebnisse der Physiologie 1: 759-802.
- ↑ Fischer, E (1902). «Über die Hydrolyse der Proteinstoffe». Chemiker Zeitung 26: 939-940.
- ↑ Fischer, E (1913). «Synthese von Depsiden, Flechtenstoffen und Gerbstoffen». Berichte der deutschen chemischen Gesellschaft 46: 3253-3289. doi:10.1002/cber.191304603109.
- ↑ Sørensen, SPL (1930). «The constitution of soluble proteins as reversibly dissociable component systems». Comptes rendus des travaux du Laboratoire Carlsberg 18: 1-124.
- ↑ Fruton, JS (1999). Proteins, Enzymes, Genes: The Interplay of Chemistry and Biology. New Haven, CT: Yale University Press.
- ↑ Abderhalden, E (1924). «Diketopiperazines». Naturwissenschaften 12: 716.
- ↑ Abderhalden, E; Komm E (1924). «Über die Anhydridstruktur der Proteine». Zeitschrift für physiologische Chemie 139: 181-204.
- ↑ Linderstrøm-Lang, K; Hotchkiss RD, Johansen G (1938). «Peptide Bonds in Globular Proteins». Nature 142: 996. doi:10.1038/142996a0.
- ↑ Chick, H; Martin CJ (1910). «On the "Heat" Coagulation of Proteins». Journal of Physiology 40: 404-430.
- ↑ Chick, H; Martin CJ (1911). «On the "Heat" Coagulation of Proteins. II. The Action of Hot Water upon Egg-albumen and the Influence of Acid and Salts upon Reaction Velocity». Journal of Physiology 43: 1-27.
- ↑ Chick, H; Martin CJ (1912). «On the "Heat" Coagulation of Proteins. III. The Influence of Alkali upon Reaction Velocity». Journal of Physiology 45: 61-69.
- ↑ Chick, H; Martin CJ (1912). «On the "Heat" Coagulation of Proteins. IV. The Conditions controlling the Agglutination of Proteins already acted upon by Hot Water». Journal of Physiology 45: 261-295.
- ↑ Anson, ML; Mirsky AE (1929). «Protein Coagulation and Its Reversal». Journal of General Physiology 13: 121-132.
- ↑ a b Anson, ML (1945). «Protein Denaturation and the Properties of Protein Groups». Advances in Protein Chemistry 2: 361-386. doi:10.1016/S0065-3233(08)60629-4.
- ↑ Wu, H (1931). «Studies on Denaturation of Proteins. XIII. A Theory of Denaturation». Chinese Journal of Physiology 5: 321-344. Preliminary reports were presented before the XIIIth International Congress of Physiology at Boston (19–24 August 1929) and in the October 1929 issue of the American Journal of Physiology.
- ↑ a b Mirsky, AE; Pauling L (1936). «On the Structure of Native, Denatured, and Coagulated Proteins». Proceedings of the National Academy of Science USA 22: 439-447. doi:10.1073/pnas.22.7.439.
- ↑ Neurath, H; Greenstein JP, Putnam FW, and Erickson JO (1944). «The Chemistry of Protein Denaturation». Chemical Reviews 34: 157-265. doi:10.1021/cr60108a003.
- ↑ Putnam, F (1953). «Protein Denaturation». The Proteins (H. Neurath and K. Bailey, eds.). 1B: 807-892.
- ↑ Bragg WH (1908). «The nature of γ- and X-rays». Nature 77: 270. doi:10.1038/077270a0. y Nature, 78, 271, 293–294, 665 (1908).
- ↑ Blow D (2002). Outline of Crystallography for Biologists. Oxford: Oxford University Press. ISBN 0198510519.
- ↑ Glusker, Jenny P., Margaret J. Adams (1995). «Dorothy Crowfoot Hodgkin». Physics Today 48: 80-81. doi:10.1063/1.2808036.
- ↑ Guy Dodson (2002). «Dorothy Mary Crowfoot Hodgkin, O.M. 12 May 1910--29 July 1994». Biographical Memoirs of Fellows of the Royal Society 48: 179-219.
- ↑ Astbury, W.T.; Street A. (1931). «X-ray studies of the structures of hair, wool and related fibres. I. General». Trans. R. Soc. Lond. (en inglés). A230: 75-101.
- ↑ Huggins, M. (1943). «The structure of fibrous proteins». Chemical Reviews 32: 195-218. doi:10.1021/cr60102a002.
- ↑ Astbury, WT; Woods HJ (1931). «The Molecular Weight of Proteins». Nature 127: 663-665. doi:10.1038/127663b0.
- ↑ Astbury, WT (1933). «Some Problems in the X-Ray Analysis of the Structure of Animal Hairs and Other Protein Fibres». Transactions of the Faraday Society 29: 193-211. doi:10.1039/tf9332900193.
- ↑ a b Jordan Lloyd, D (1932). «Colloidal Structure and its Biological Significance». Biological Review 7: 254-273.
- ↑ Jordan Lloyd, D; Marriott (1933). «Title unknown». Transactions of the Faraday Society 29: 1228.
- ↑ Astbury, WT (1936). «Unknown title». Journal of the Textile Institute 27: 282-?.
- ↑ Abir-Am, P. G. (1987). «Synergy or Clash: Disciplinary and Marital Strategies in the Career of Mathematical Biologist Dorothy Wrinch». En P. G. Abir-Am y D. Outram, ed. Uneasy Careers and Intimate Lives, Women in Science 1789-1979 (en inglés). New Brunswick: Rutgers University Press. pp. 239-280. ISBN 9780813512563. Consultado el 12 de diciembre de 2009.
- ↑ a b Wrinch, DM (1936). «The Pattern of Proteins». Nature 137: 411-412. doi:10.1038/137411a0.
- ↑ a b c d e f Tanford, Charles; Reynols, J. (2001). Nature's Robots: A History of Proteins (en inglés). Oxford: Oxford University Press. ISBN 9780198606949.
- ↑ Cohen, Louis A. (1961). «Chemical Aspects of the Structure of Small Peptides. An Introduction». J. Am. Chem. Soc. (en inglés) 83 (21): 4488. doi:10.1021/ja01482a059.
- ↑ Wrinch, DM (1936). «Energy of Formation of 'Cyclol' Molecules». Nature 138: 241-242. doi:10.1038/138241a0.
- ↑ Frank, FC (1936). «Energy of Formation of 'Cyclol' Molecules». Nature 138: 242. doi:10.1038/138242a0.
- ↑ Kemnitz, Carl R.; Loewen, Mark J. (2007). «"Amide Resonance" Correlates with a Breadth of C-N Rotation Barriers». J. Am. Chem. Soc. (en inglés) 129 (9): 2521 - 2528. doi:10.1021/ja0663024.
- ↑ Langmuir, I; Wrinch DM (1939). «Nature of the Cyclol Bond». Nature 143: 49-52. doi:10.1038/143049a0.
- ↑ Langmuir, I (1939). «The Structure of Proteins». Proceedings of the Physical Society of London 51: 592-612. doi:10.1088/0959-5309/51/4/305.
- ↑ Wrinch, DM (1938). «On the Hydration and Denaturation of Proteins». Philosophical Magazine 25: 705-739.
- ↑ Wrinch, DM (1936). «Hydration and Denaturation of Proteins». Nature 142: 260.
- ↑ Dow, RB; Matthews JE, Jr. and Thorp WTS (1940). «The Effect of High Pressure Treatment on the Physiological Activity of Insulin». American Journal of Physiology 131: 382-387.
- ↑ Dunitz, Jack D. (Noviembre de 1996). «Linus Carl Pauling, February 28, 1901–August 19, 1994». Biographical Memoirs of Fellows of the Royal Society 42: 316-338. doi:10.1098/rsbm.1996.0020.
- ↑ Kauzmann, W (1959). «Some Factors in the Interpretation of Protein Denaturation». Advances in Protein Chemistry 14: 1-63. doi:10.1016/S0065-3233(08)60608-7.
- ↑ Wrinch, DM (1936). «Structure of Proteins and of Certain Physiologically Active Compounds». Nature 138: 651-652. doi:10.1038/138651a0.
- ↑ Wrinch, DM; Jordan Lloyd D (1936). «The Hydrogen Bond and the Structure of Proteins». Nature 138: 758-759. doi:10.1038/138758a0.
- ↑ Wrinch, DM (1937). «Nature of the Linkage in Proteins». Nature 139: 718. doi:10.1038/139718a0.
- ↑ Astbury, WT; Wrinch DM (1937). «The Hydrogen Bond and the Structure of Proteins». Nature 139: 798.
- ↑ Wrinch, D. «The Fabric Theory of Protein Structure». Philosophical Magazine 30: 64-67.
- ↑ Wrinch, DM (1937). «The Cyclol Theory and the 'Globular' Proteins». Nature 139: 972-973. doi:10.1038/139972a0.
- ↑ Wrinch, DM (1947). «The Native Protein». Science 106: 73-76. doi:10.1126/science.106.2743.73.
- ↑ Wrinch, DM (1937). «On the Pattern of Proteins». Proceedings of the Royal Society. A160: 59-86.
- ↑ Wrinch, DM (1937). «The Cyclol Hypothesis and the "Globular" Proteins». Proceedings of the Royal Society. A161: 505-524.
- ↑ Wrinch, DM (1938). «On the Molecular Weights of the Globular Proteins». Philosophical Magazine 26: 313-332.
- ↑ Wrinch, DM (1939). «The Tuberculin Protein TBU-Bovine (523)». Nature 144: 77. doi:10.1038/144077a0.
- ↑ Florkin M (marzo de 1957). «[Discovery of pepsin by Theodor Schwann.]». Rev Med Liege (en francés) 12 (5): 139-44. PMID 13432398.
- ↑ Northrop JH (mayo de 1929). «Crystalline pepsin». Science (journal) (en inglés) 69 (1796): 580. PMID 17758437. doi:10.1126/science.69.1796.580.
- ↑ Wrinch, DM (1937). «On the structure of pepsin». Philosophical Magazine 24: 940.
- ↑ Wrinch, DM (1938). «Structure of Pepsin». Nature 142: 217.
- ↑ Wrinch, DM (1937). «On the Structure of Insulin». Science 85: 566-567. doi:10.1126/science.85.2215.566.
- ↑ Wrinch, DM (1937). «On the Structure of Insulin». Transactions of the Faraday Society 33: 1368-1380. doi:10.1039/tf9373301368.
- ↑ Wrinch, DM (1938). «The Structure of the Insulin Molecule». Journal of the American Chemical Society 60: 2005-2006. doi:10.1021/ja01275a514.
- ↑ Wrinch, DM (1938). «The Structure of the Insulin Molecule». Science 88: 148-149. doi:10.1126/science.88.2276.148-a.
- ↑ Wrinch, DM; Langmuir I (1938). «The Structure of the Insulin Molecule». Journal of the American Chemical Society 60: 2247-2255. doi:10.1021/ja01276a062.
- ↑ Langmuir, I; Wrinch DM (1939). «A Note on the Structure of Insulin». Proceedings of the Physical Society of London 51: 613-624. doi:10.1088/0959-5309/51/4/306.
- ↑ Bragg, WL (1939). «Patterson Diagrams in Crystal Analysis». Nature 143: 73-74. doi:10.1038/143073a0.
- ↑ Bernal, J. D. (1939). «Vector Maps and the Cyclol Hypothesis». Nature 143: 74-75. doi:10.1038/143074a0.
- ↑ Robertson, JM (1939). «Vector Maps and Heavy Atoms in Crystal Analysis and the Insulin Structure». Nature 143: 75-76. doi:10.1038/143075a0.
- ↑ Riley, DP; Fankuchen I (1939). «A Derived Patterson Analysis of the Skeleton of the Cyclol C2 Molecule». Nature 143: 648-649. doi:10.1038/143648a0.
- ↑ Wrinch, DM (1940). «Patterson Projection of the Skeletons of the Structure proposed for the Insulin Molecule». Nature 145: 1018. doi:10.1038/1451018a0.
- ↑ Riley, D (1940). «A Patterson Analysis derived from the Cyclol C2 Skeleton». Nature 146: 231. doi:10.1038/146231a0.
- ↑ Neurath, H; Bull HB (1938). «The Surface Activity of Proteins». Chemical Reviews 23: 391-435. doi:10.1021/cr60076a001.
- ↑ Huggins, M (1939). «The Structure of Proteins». Journal of the American Chemical Society 61: 755. doi:10.1021/ja01872a512.
- ↑ Haurowitz, F (1938). «The arrangement of peptide chains in sphaero protein-molecules». Zeitschrift der physiologischen Chemie 256: 28-32.
- ↑ Meyer, KH; Hohenemser W (1938). «Possibility of the Formation of Cyclols from Simple Peptides». Nature 141: 1138-1139. doi:10.1038/1411138b0.
- ↑ Bergmann, M; Niemann C (1938). «The Chemistry of Amino Acids and Proteins». Annual Reviews in Biochemistry 7: 99-124. doi:10.1146/annurev.bi.07.070138.000531.
- ↑ Neuberger, A (1939). «Chemical criticism of the cyclol and frequency hypothesis of protein structure». Proceedings of the Royal Society 170: 64-65.
- ↑ Neuberger, A (1939). «Chemical Aspects of the Cyclol Hypothesis». Nature 143: 473. doi:10.1038/143473a0.
- ↑ Haurowitz, F; Astrup T (1939). «Ultraviolet absorption of genuine and hydrolysed protein». Nature 143: 118-119. doi:10.1038/143118b0.
- ↑ Klotz, IM; Griswold P (1949). «Infrared Spectra and the Amide Linkage in a Native Globular Protein». Science 109: 309-310. doi:10.1126/science.109.2830.309.
- ↑ a b Pauling, L; Niemann C (1939). «The Structure of Proteins». Journal of the American Chemical Society 61: 1860-1867. doi:10.1021/ja01876a065.
- ↑ Hotchkiss, RD (1939). «The Determination of Peptide Bonds in Crystalline Lactoglobulin». Journal of Biological Chemistry 131: 387-395.
- ↑ a b Wrinch, DM (1941). «The Geometrical Attack on Protein Structure». Journal of the American Chemical Society 63: 330-33. doi:10.1021/ja01847a004.
- ↑ Wrinch, DM (1940). «The Cyclol Hypothesis». Nature 145: 669-670. doi:10.1038/145669a0.
- ↑ a b Wrinch, DM (1948). «The Native Proteins as Polycondensations of Amino Acids». Science 107: 445-446. doi:10.1126/science.107.2783.445-a.
- ↑ Wrinch, DM (1948). «Skeletal Units in Protein Crystals». Science 115: 356-357. doi:10.1126/science.115.2987.356.
- ↑ Wrinch, DM (1948). «Molecules of the Insulin Structure». Science 116: 562-564. doi:10.1126/science.116.3021.562.
- ↑ Wrinch, DM (1939). «The Structure of the Globular Proteins». Nature 143: 482-483. doi:10.1038/143482a0.
- ↑ Wrinch, DM (1939). «The Cyclol Theory and the Structure of Insulin». Nature 143: 763-764. doi:10.1038/143763a0.
- ↑ Wrinch, DM (1939). «Native Proteins, Flexible Frameworks and Cytoplasmic Organization». Nature 150: 270-271. doi:10.1038/150270a0.
- ↑ a b c Wrinch, DM (1965). Chemical Aspects of Polypeptide Chain Structures and the Cyclol Theory. New York: Plenum Press.
- ↑ Anslow, GA (1942). «Bond Energies in Some Protein Fabrics and Side Chains». Physical Review 61: 547.
- ↑ Anslow, GA (1945). «Ultraviolet Spectra of Biologically Important Molecules». Journal of Applied Physics 16: 41-49. doi:10.1063/1.1707499.
- ↑ Anslow, GA (1953). «The Sites of the Amino-Acid Residues on a Cyclol Model of Insulin». Journal of Chemical Physics 21: 2083-2084. doi:10.1063/1.1698765.
- ↑ Guedez, T; Núñez A, Tineo E, Núñez O (2002). «Ring size configuration effect and the transannular intrinsic rates in bislactam macrocycles». Journal of the Chemical Society, Perkin Transactions 2 2002: 2078-2082. doi:10.1039/b207233e.
- ↑ Bernal, JD (1939). «Structure of proteins». Nature 143: 663-667. doi:10.1038/143663a0.
- ↑ Wieland T and Bodanszky M, The World of Peptides, Springer Verlag, pp.193-198. ISBN 0-387-52830-X
- ↑ Hofmann, A; Ott H, Griot R, Stadler PA and Frey AJ (1963). «Synthese von Ergotamin». Helvetica Chimica Acta 46: 2306-2336.
- ↑ Shemyakin, MM; Antonov VK, and Shkrob AM (1963). «Activation of the amide group by acylation». Peptides, Proc. 6th Europ. Pept. Symp., Athens: 319-328.
- ↑ Zanotti, G; Pinnen F, Lucente G, Cerrini S, Fedeli W and Mazza F (1984). «Peptide thiacyclols. Synthesis and structural studies». J. Chem. Soc. Perkin Trans. 1: 1153-1157. doi:10.1039/p19840001153.
- ↑ Griot, RG; Frey AJ (1963). «The formation of cyclols from N-hydroxyacyl lactames». Tetrahedron 19: 1661-1673. doi:10.1016/S0040-4020(01)99239-7.
- ↑ Lucente, G; Romeo A (1971). «Synthesis of cyclols from small peptides via amide-amide reaction». Chem. Commun. ?: 1605-1607.
- ↑ Rothe, M; Schindler W, Pudill R, Kostrzewa U, Theyson R, and Steinberger R. (1971). «Zum Problem der Cycloltripeptidsynthese». Peptides, Proc. 11th Europ. Pept. Symp., Wien: 388-399.
- ↑ Rothe, M; Roser KL. (1988). «Conformational flexibility of cyclic tripeptides». Abstr. 20th Europ. Pept. Symp. Tübingen: 36.
- ↑ Wieland, T.; Mohr H. (1956). «Diacylamide als energiereiche Verbindungen. Diglycylimid». Liebigs Ann. Chem. 599: 222-232.
- ↑ Wieland, T.; Urbach H. (1958). «Weitere Di-Aminoacylimide und ihre intramolekulare Umlagerung». Liebigs Ann. Chem. 613: 84-95.
- ↑ Brenner, M (1958). «The aminoacyl insertion». En Wolstenholme GEW and O'Connor CM, eds., Churchill, ed. Ciba Foundation Symposium on Amino acids and peptides with antimetabolic activity.
- ↑ Wrinch, DM (1957). «Structure of Bacitracin A». Nature 179: 536-537. doi:10.1038/179536a0.
- ↑ Wrinch, DM (1957). «An Approach to the Synthesis of Polycyclic Peptides». Nature 180: 502-503. doi:10.1038/180502b0.
- ↑ Wrinch, DM (1962). «Some Issues in Molecular Biology and Recent Advances in the Organic Chemistry of Small Peptides». Nature 193: 245-247. doi:10.1038/193245a0.
- ↑ Wrinch, DM (1963). «Recent Advances in Cyclol Chemistry». Nature 199: 564-566. doi:10.1038/199564a0.
- ↑ Wrinch, DM (1965). «A Contemporary Picture of the Chemical Aspects of Polypeptide Chain Structures and Certain Problems of Molecular Biology». Nature 206: 459-461. doi:10.1038/206459a0.
- ↑ Wrinch, DM (1960). Chemical Aspects of the Structures of Small Peptides: An Introduction. Copenhagen: Munksgaard.
- ↑ Rayner-Canham, Marelene F. (2005). Women in chemistry: their changing roles from alchemical times to the mid-twentieth century (en inglés). History of modern chemical sciences. Chemical Heritage Foundation. ISBN 9780941901277. Consultado el 13 de diciembre de 2009.
- ↑ Kauzmann, W (1993). «Reminiscences from a life in protein physical chemistry». Protein Science 2: 671-691.
- ↑ Pais, A (1986). Inward Bound: Of Matter and Forces in the Physical World. Oxford University Press.
- ↑ Bohr, Niels (1913). «On the Constitution of Atoms and Molecules (Parte 1 de 3)». Philosophical Magazine 26: 1-25.
- ↑ Bohr, N (1913). «On the Constitution of Atoms and Molecules, Part III». Philosophical Magazine 26: 857-875.
- ↑ Bohr, N (1914). «The spectra of helium and hydrogen». Nature 92: 231-232. doi:10.1038/092231d0.
- ↑ Pauling, L; Corey RB (1953). «A proposed structure for the nucleic acids». Proceedings of the National Academy of Science 39: 84-97. doi:10.1073/pnas.39.2.84.
- ↑ Franklin, RE; Gosling R (1953). «Molecular configuration of sodium thymonucleate». Nature 171: 740-741. doi:10.1038/171740a0.
- ↑ a b Watson, JD; Crick F. (1953). «Molecular structure of nucleic acids: A structure for deoxyribonucleic acid». Nature 171: 737-738. doi:10.1038/171737a0.
- ↑ Saenger, W (1988). Principles of Nucleic Acid Structure. Springer Verlag.
- ↑ Pais, A. (1982). Subtle is the Lord: The Science and the Life of Albert Einstein. Oxford University Press.
- ↑ Rota, Gian-Carlo (1977). «The phenomenology of mathematical beauty». Synthese 111 (2): 171-182. doi:10.1023/A:1004930722234.
Enlaces externos
[editar]- Falsificationism and scientific method (en inglés)