Ionona
| α-Ionona | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| (3E)-4-(2,6,6-Trimetilciclohex-2-en-1-il)but-3-en-2-ona | ||
| General | ||
| Fórmula molecular | C13H20O | |
| Identificadores | ||
| Número CAS | 79-76-5[1] | |
| ChEBI | 49248 | |
| Propiedades físicas | ||
| Apariencia | Líquido claro amarillento con olor a violetas. | |
| Densidad | 0,933 kg/m³; 0,000933 g/cm³ | |
| Masa molar | 192,3 g/mol | |
| Punto de ebullición | 126 °C (399 K) - 128 °C (401 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Las iononas son un conjunto de productos naturales que provienen de la degradación de los carotenoides. Son compuestos fragantes que se encuentran en diversos aceites esenciales, como por ejemplo el aceite de rosa. Son utilizadas en perfumería[2] y como saborizantes en alimentos.[3]
Biosíntesis
[editar]Los carotenoides son precursores de compuestos importantes en la fragancia de las flores Rosa canina y Osmanthus fragrans var. aurantiacus, que presentan la mayor diversidad de compuestos volátiles en carotenoides obtenidos entre las angiospermas. Un estudio detectó ADNc que codifica una enzima para la escisión de carotenoides, OfCCD1, el cual fue identificado a partir de transcripciones aisladas de las flores de O. fragrans. Dos enzimas recombinantes denominadas Carotenoide dioxigenasas (CCD) produjeron α-ionona y β-ionona en ensayos in vitro. También se constató que el contenido de carotenoides y las emisiones de volátiles incrementaron durante las horas del día. La emisión de iononas también fue mayor durante el día, sin embargo, las emisiones disminuyeron a un ritmo menor que los niveles de transcripción.[4]

Síntesis
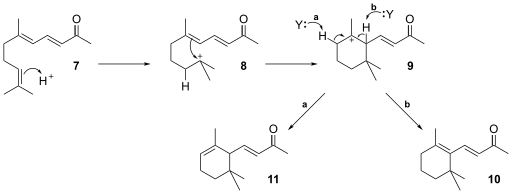
[editar]Las iononas pueden ser sintetizadas a partir de citral y acetona con óxido de calcio como base, a través de una condensación aldólica seguida de una transposición.[5][6]
La adición nucleofílica del carbanión 3 de la acetona (1) al grupo carbonilo en el citral 4 es catalizado por bases. El producto de la condensación aldólica 5 elimina agua para dar el ion enolato, 6 el cual tautomeriza a la pseudoionona 7.
Otra reacción que procede por catálisis ácida se lleva a cabo cuando el doble enlace en 7 forma el carbocatión 8. La transposición del carbocatión da lugar al cierre del anillo para dar el intermediario 9. Finalmente un átomo de hidrógeno es abstraído por una molécula aceptora (Y) para formar así la ionona 10 u 11.
Referencias
[editar]- ↑ Número CAS
- ↑ Rose (Rosa damascena), John C. Leffingwell
- ↑ Diccionario de los alimentos, Salvador Badui, Editorial Alhambra Mexicana, 1ª ed. (1988) ISBN 968 444 071 5
- ↑ Susanne Baldermann1,Masaya Kato, Miwako Kurosawa, Yoshiko Kurobayashi, Akira Fujita, Peter Fleischmann, Naoharu Watanabe (2010). «Functional characterization of a carotenoid cleavage dioxygenase 1 and its relation to the carotenoid accumulation and volatile emission during the floral development of Osmanthus fragrans Lour.». Journal of Experimental Botany 61 (11): 2967-2977. doi:10.1093/jxb/erq123.
- ↑ NODA, C., ALT, G. P., WERNECK, R. M. et al. (1998). «Aldol Condensation of Citral with Acetone on Basic Solid Catalysts». Braz. J. Chem. Eng. 15 (2). doi:10.1590/S0104-66321998000200004.
- ↑ Alfred Russell and R. L. Kenyon. «Pseudoionone». Organic Syntheses, Coll. Vol. 3 23: 78. Archivado desde el original el 16 de julio de 2012. Consultado el 12 de febrero de 2011.