Síntesis solvotermal
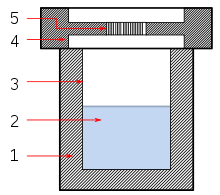
La síntesis solvotermal es un método para preparar materiales semiconductores, cerámicos, polímeros y metales. En este tipo de síntesis el solvente (si el solvente es agua, se le llama síntesis hidrotermal) y el precursor se calientan en un sistema cerrado a temperaturas por encima del punto de ebullición del solvente, esto hace que aumente la presión (entre 1atm a 10,000 atm), facilitando la interacción entre el solvente y el precursor durante la síntesis.[1][2]
Historia
[editar]
Luis Brus fue el primero que explicó que al preparar nanopartículas de sulfuro de cadmio (CdS) mediante la síntesis hidrotermal en una suspensión acuosa, tenía un corrimiento al azul (disminuye la longitud de onda) en el espectro visible de absorción y emisión en comparación de un bulk de CdS, con esto se dieron cuenta de que las partículas que tienen un radio menor al radio de excitación de Bohr presentan niveles de energía similares a la de un solo átomo. Diferente a las bandas de energía observadas en los materiales bulk, donde cada cristal con un diámetro único en la nanoescala corresponde a una energía discreta, materiales que exhiben esta característica son llamados “átomos artificiales”, eso dio entrada a que en la actualidad se ocupe la síntesis solvotermal para controlar el tamaño de algunos materiales semiconductores.[3][4]
Factores para la síntesis solvotermal
[editar]Algunos de los factores que se deben de tomar en cuenta para poder realizar este tipo de síntesis, son[3][5]
Factores químicos
[editar]- La naturaleza química del solvente y sus propiedades fisicoquímicas. Algunos de los solventes más utilizados son, disolventes orgánicos, por ejemplo, amoniaco, hidracina, agua, etc.
- La composición química (es uno de los factores más importantes para tener control de la forma de los nanocristales resultantes de la síntesis), estructura y propiedades del precursor.
- La naturaleza de los aditivos.
- El pH de la reacción entre el solvente y el precursor.
Factores termodinámicos
[editar]- Temperatura a la que se calienta el solvente
- Presión adquirida por la interacción y calentamiento entre el solvente y el precursor en un sistema cerrado
- Tiempo de reacción
El rol del Solvente
[editar]Cuando se desean reacciones en estado líquido, el solvente puede jugar diferentes roles a través de sus propiedades fisicoquímicas[6]
- Puede controlar la concentración de las especies químicas afectando las reacciones cinéticas
- Es capaz de modificar la coordinación de las especies solventadas e inducir estructuras específicas.
Las propiedades fisicoquímicas del solvente pueden ser modificadas usando solventes mixtos. Tales modificaciones fungen un rol crucial para la nucleación y el crecimiento general del cristal. Diferentes estudios del desarrollo de nanocristales a través de la síntesis solvotermal han remarcado éstas propiedades del solvente en el tamaño y morfología de las partículas resultantes.
En la mayoría de los casos de este proceso envuelve la disolución de los reactivos, consecuentemente, toda correlación estructural entre los reactivos y los productos es perdida, dejando solamente a las especies químicas desenvolviendo un rol. Si los reactivos se dejan en estado sólido bajo condiciones solvotermales, se vuelve posible iniciar la estructuración del producto final a través de un reactivo insoluble.
La elección del solvente afecta mucho el resultado de la síntesis, un solvente orgánico ayuda a controlar la estructura y morfología del producto resultante. Debido a su forma y las propiedades dependientes del tamaño, ya que por ejemplo al añadir un solvente orgánico al agua esto crea una excelente medio de reacción para el tratamiento hidrotermal de nanopartículas. Esto se debe a que esta mezcla de solventes modulará la velocidad de reacción y de equilibrio mediante el ajuste de la constante dieléctrica y la densidad del disolvente con respecto a presión y temperatura. Produciendo así unas velocidades de reacción más elevadas y partículas más pequeñas. Ejemplo de solventes orgánicos son:
| Solvente | Formula | Punto de ebullición (°C) | Densidad(g/mL) | Solubilidad en agua (g/100g) | Constante dieléctrica |
|---|---|---|---|---|---|
| Acetona | C3H6O | 56.2 | 0.786 | - | 20.7 |
| Benceno | C5H6 | 80.1 | 0.879 | 0.18 | 2.28 |
| 1-Butanol | C4H10O | 117.6 | 0.81 | 6.3 | 17.8 |
| Etanol | C2H6O | 78.5 | 0.789 | - | 24.6 |
| Glicerina | C3H8O3 | 290 | 1.261 | 42.5 | |
| 1-Propanol | C3H8O | 97 | 0.803 | - | 20.1 |
| Tetrahidrofurano (THF) | C4H8O | 66 | 0.886 | 30 | 7.6 |
En óxidos condensados
[editar]Cuando es usada la síntesis solvotermica a partir de una ruta cerámica, son necesarias la trituración y calentamiento repetido para alcanzar homogeneidad de muestras. La interdifusión aumentada de los reactivos en la solución mediada por reacciones hidrotérmicas permite una cristalización rápida y directo de un material de una sola fase. Uno de los más estudiados es el BaTiO3 y su síntesis ocurre a temperaturas a partir de los 80 °C a partir de soluciones de sales báricas y TiO2 sólido. El polimorfo de este material se encuentra usado en muchos lados. Desde condensadores de muchas capas hasta dispositivos opto-electrónicos.[8]
En calcogenuros[8]
[editar]La síntesis de los calcogenuros sólidos suelen ser más difícil de llevar a cabo que la de los óxidos. A temperaturas elevadas, la formación de SO2 o SeO2 es entrópicamente muy favorable y ayuda a la formación de óxidos metálicos en lugar del calcogenuro desado. Para el uso de la síntesis, aparte de usar contenedores sellados, el uso de solventes permite un mayor control de la naturaleza del producto a crear que el uso de reacciones sólido-sólido.
Un ejemplo de ellos es la síntesis de CdS que, con la ruta solvotérmica, permite la formación de sólidos directamente de una variedad de sales de cadmio y tiurea en compuestos orgánicos. Su aplicación yace en la fotónica.
En reacciones solvotermicas para nanoláminas de grafeno, el etanol es uno de varios solventes usados que permite dispersar el grafeno de manera homogénea según sus parámetros de soludibilidad Hansen. Este método presenta muchas ventajas, principalmente el hecho de que es barato y nada tóxico. Se han obtenido gramos de nanoláminas de grafeno de alta pureza al pilorizar rápidamente el precursor de grafeno preparado a partir de sódio y etanol a través de una reacción solvotérmica. Esto tiene su aplicación para generar supercapacitores.[9]
Usos
[editar]Este método es usado en:[6]
- química de los materiales, con la síntesis de nuevos nanomateriales (en la fase metaestable, mejorando la cinética de los materiales).
- química molecular, con la síntesis de nuevos polímeros
- química híbrida, con la estabilización de nuevos marcos, a través de la preparación de materiales involucrando componentes orgánicos/inorgánicos o inorgánicos/biológicos.
- ciencia de materiales
- elaboración de nanocristalita
- crecimiento cristalino de materiales funcionales, caracterizados por propiedades físicas específicas para aplicaciones industriales
- preparación de materiales cerámicos, usando condiciones de temperatura baja
- biotecnología, con el desarrollo de sistemas nanofuncionales bioinspirados.
Aplicaciones
[editar]Gracias a que esta síntesis puede controlar el tamaño y forma de las nanopartículas, estas pueden ser diseñadas con diferentes propósitos, por ejemplo,[5]
- Nanocircuitos
- Nanocircuitos ópticos
- Partículas nanomagnéticas
- Biotecnología
- Dispositivos de celdas solares (esta técnica puede obtener nanopartículas con un band gap de 1.05 eV para espectro UV visible)[10]
- Síntesis de nuevos materiales
- Crecimiento del cristal a bajas temperaturas
- Deposición de filmes delgados
Materiales nuevos
[editar]Algunos de los materiales que se pueden sintetizar a partir de esta técnica, son,[5]
- Materiales inspirados en la naturaleza (óxidos bidimensionales derivados de filosilicatos naturales)
- Materiales con elementos ligeros.
- Síntesis hidrotermal del diamante
- Preparación solvotermal de nitruro de boro cúbico (c- BN)
- Elaboración solvotermal del compuesto C3N4
- Materiales híbridos entre química orgánica e inorgánica y la estabilización de nuevas estructuras.
Referencias
[editar]- ↑ Zanella, O (2012). «Metodologías para la síntesis de nanopartículas: Controlando forma y tamaño». Mundo Nano 5: 69-81.
- ↑ Gersten, B. «Solvothermal Synthesis of Nanoparticles».
- ↑ a b Byrappa, K; Yoshimura, Masahiro (12 de octubre de 2008). Handbook Of Hydrothermal Technology. Cambridge University Press.
- ↑ Rabenau, Albrecht (de diciembre de 1985). «The Role of Hydrothermal Synthesis in Preparative Chemistry». Angewandte Chemie International Edition in English 24 (12): 1026-1040. doi:10.1002/anie.198510261.
- ↑ a b c Demazeau, Gérard (2007). «Solvothermal Reactions: An Original Route for the Synthesis of Novel Materials». J Mater Sci Journal of Materials Science 43.
- ↑ a b Demazeau, G. «Solvothermal processes: Definition, Key Factors Governing the Involved Chemical Reactions and New Trends». Universidad de Bordeaux., Francia.
- ↑ Nam, Chau Thanh; Yang, Wein-Duo; Duc, Le Minh (de de 2013). «Solvothermal Synthesis of TiO Photocatalysts in Ketone Solvents with Low Boiling Points». Journal of Nanomaterials 2013: 1-11. doi:10.1155/2013/627385.
- ↑ a b Walton, R. L. (2002). Subcritical solvothermal synthesis of condensed inorganic materials.
- ↑ Liu, Yunfu; Yuan, Guohui; Jiang, Zhaohua; Yao, Zhongping; Yue, Min. [: http://link.springer.com/article/10.1007/s11581-014-1222-0/fulltext.html Solvothermal synthesis of graphene nanosheets as the electrode materials for supercapacitors].
- ↑ Chen, Huiyu; Yu, Seong-Man; Shin, Dong-Wook; Yoo, Ji-Beom (1 de noviembre de 2009). «Solvothermal Synthesis and Characterization of Chalcopyrite CuInSe2 Nanoparticles». Nanoscale Research Letters 5 (1): 217-223. doi:10.1007/s11671-009-9468-6.